2021-2022学年高一下学期化学人教版(2019)必修第二册6.2化学反应的速率与限度 课件(36张ppt)
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册6.2化学反应的速率与限度 课件(36张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-09 09:21:35 | ||
图片预览









文档简介
(共36张PPT)
《化学反应的速率与限度》
第1课时 化学反应的速率
化学反应快慢不同
情境引入
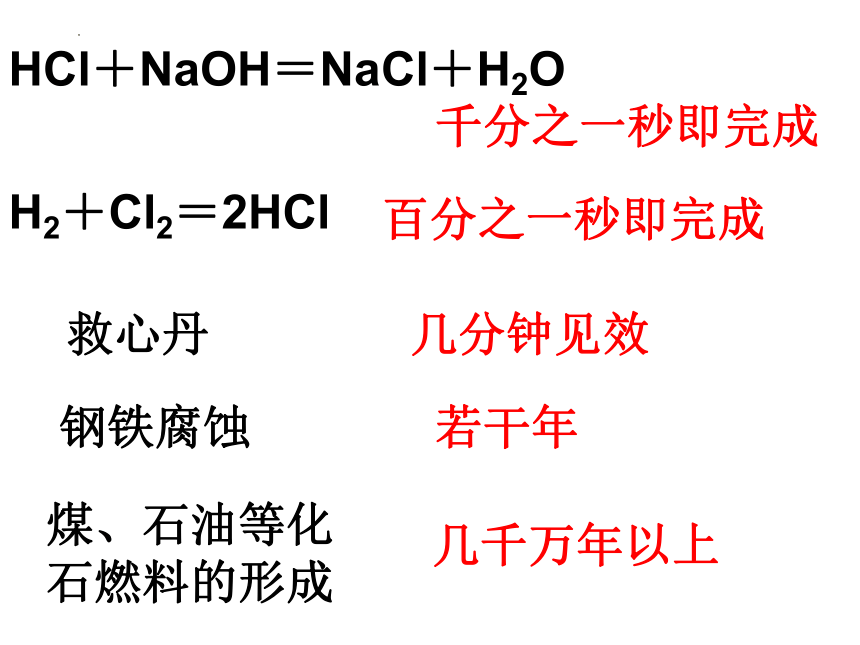
HCl+NaOH=NaCl+H2O
千分之一秒即完成
H2+Cl2=2HCl
百分之一秒即完成
救心丹
几分钟见效
钢铁腐蚀
若干年
煤、石油等化石燃料的形成
几千万年以上
2.定义:化学反应速率用单位时间(如每秒,每分,每小时)内 的减小量或
的增加量来表示。
一、化学反应速率
3.表达式:v=
△C
t
△C=
△n
V
4.单位:mol/(L.min) 或 mol/(L.s)
1.意义:表示化学反应 的物理量
速度快慢
反应物浓度
生成物浓度
例:H2和N2反应生成NH3,5min内H2由6mol/L变成了2mol/L,则用H2表示的化学反应速率是多少?
V(H2)=
=
=
△C(H2)
t
(6-2)mol/L
5min
0.8mol/(L.min)
(1)化学反应速率是平均速率,同一反应用不同物质表示的化学反应速率数值可能不同,但意义相同,且必须注明物质。
(2)起始浓度与化学计量数比无关,但是
一定与化学计量数成比例。
注意事项
变化浓度
(3)同一反应中,各物质的反应速率之比等于化学计量数之比。例如 2A+3B = C+4D(A、B、C、D都不是固体或纯液体) ν(A):ν(B):ν(C):ν(D) =
(4)同一方程式中,比较用不同物质表示的化学反应速率的快慢,用每种物质表示的速率 除以各自的化学计量数 即可比较。
(5)固体和纯液体比如水,不能表示化学反应速率。只有溶液中的溶质 和 气体 可以表示速率。
2:3:1:4
随堂测1:
1.某反应的反应物浓度在5 min内由11 mol/L变成了1 mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为______________。
2.在一密闭容器里装有氮气和氢气。反应开始时,氮气的浓度为2mol/L,氢气的浓度为5mol/L, 2min时测得容器中氮气的浓度为1.8mol/L。2min内氮气、氢气和氨气的平均反应速率分别是__________、________、__________
3.在 N2+3H2
2NH3反应中,下列各表示该反应的
速度最快的是 ( )
A.v(N2)=0.2mol/(L·min) B.v(H2)=0.5mol/(L·min)
C.v(NH3)=0.3mol/(L·min)
1.2 mol/(L.min)
0.1 mol/(L.min) 0.3 mol/(L.min) 0.2 mol/(L.min)
A
二、影响化学反应速率的因素
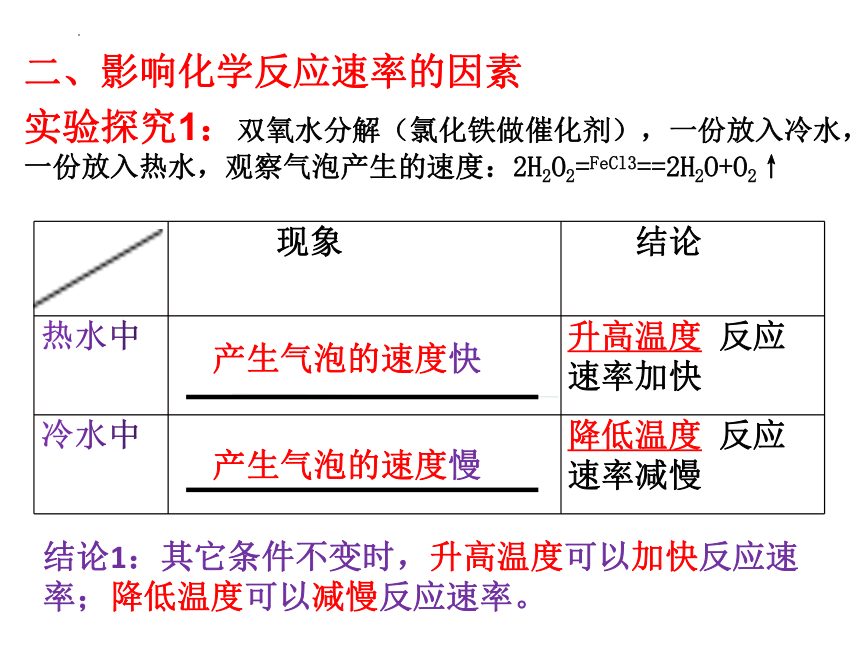
实验探究1:双氧水分解(氯化铁做催化剂),一份放入冷水,一份放入热水,观察气泡产生的速度:2H2O2=FeCl3==2H2O+O2↑
现象 结论
热水中 升高温度 反应速率加快
冷水中 降低温度 反应速率减慢
产生气泡的速度快
产生气泡的速度慢
结论1:其它条件不变时,升高温度可以加快反应速率;降低温度可以减慢反应速率。
实验探究2:浓度分别为0.1mol/L、1mol/L的盐酸与同浓度的碳酸钠溶液反应,观察反应的剧烈程度: Na2CO3+2HCl=2NaCl+H2O+CO2↑
现象 结论
0.1mol/L盐酸 反应速率慢
1mol/L盐酸 反应速率快
产生气泡的速度慢
产生气泡的速度快
反应物浓度小
反应物浓度大
结论1:其它条件不变时,增大反应物浓度,可以加快反应速率
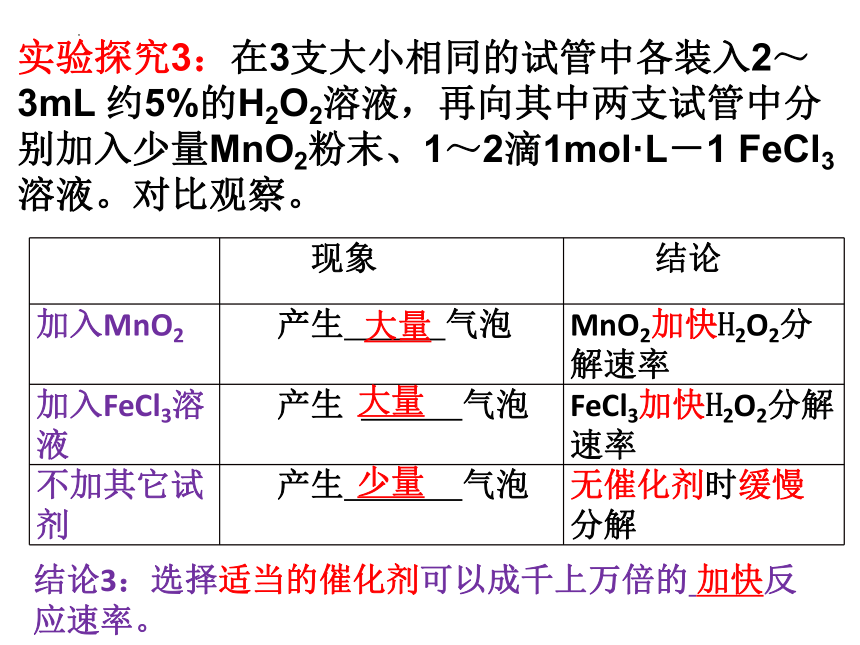
实验探究3:在3支大小相同的试管中各装入2~3mL 约5%的H2O2溶液,再向其中两支试管中分别加入少量MnO2粉末、1~2滴1mol·L-1 FeCl3溶液。对比观察。
现象 结论
加入MnO2 产生 气泡 MnO2加快H2O2分解速率
加入FeCl3溶液 产生 气泡 FeCl3加快H2O2分解速率
不加其它试剂 产生 气泡 无催化剂时缓慢分解
大量
大量
少量
结论3:选择适当的催化剂可以成千上万倍的 加快反应速率。
总结:
1.化学反应速率的计算公式
内因:
反应物自身的性质
外因:
浓度、温度、催化剂
除此之外,还有增大固体的表面积(如粉碎)、形成原电池、压缩气体反应的容器(增大气体浓度)等也能加快反应速率
4.影响化学反应速率的因素:
2.同一方程式中,反应速率与化学计量数之间的关系
3.比较用不同物质表示的反应速率的快慢
随堂测2:
1.下列措施肯定能使化学反应速率增大的是(C )
A.增大反应物的量 B.增大压强
C.升高温度 D.使用催化剂
2.下列条件一定能使反应速率加快的是( D )
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
3.反应在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每分钟变化正确的是( A )
A.NO:0.06 B.H2O:0.08
C.NH3:0.12 D.O2:0.10
4.在N2 + 3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 ,在此时间内用NH3表示的反应速率为0.30·S-1。则此一段时间是( B )
A.1秒 B.2秒 C.0.44秒D.1.33秒
5. 在2A + B = 3C + 4D的反应中, 下列表示该反应的化反速率最快的是( B )
A. V(A) = 0.5 mol/(L·s)
B. V(B) = 0.3 mol/(L·s)
C. V(C) = 0.8 mol/(L·s)
D. V(D) = 1 mol/(L·s)
6.某温度时,2L容器中X、Y、Z三种物质的
量随时间的变化如图所示。由图中数据分析,该
反应的化学方程式为 ;
反应开始至2min ,Z的平均反应速率为 :
3X+Y 2Z
0.05mol/(L.min)
第二课时:化学反应的限度
思考
在一定条件下,将1 mol N2和3 mol H2置于密闭容器中充分反应,能否得到2 mol NH3
不能。原因是N2和H2合成氨的反应属于可逆反应,反应物转化率达不到100%。
一、可逆反应
可逆反应:在同一条件下____________和
____________均能进行的化学反应,书写可
逆反应的化学方程式时不用“===”而用
“______”。可逆反应方程式中,反应不能
完全进行,每一种物质共同存在。
正反应方向
逆反应方向
二、化学反应的限度
1、定义:. 当一个 可逆 反应进行到正向反应
速率与逆向反应速率 相等 时,反应物和生成
物的浓度 ,达到 的一种状态。这就是这个反应所能达到的限度;此时这个状态就叫做 状态,简称化学平衡。
不再变化
表面静止
化学平衡
2.达到平衡状态时,反应物的转化率达到最大。
3.化学平衡状态是可逆反应在一定条件下所能
达到或完成的最大程度,即该反应进行的
4.化学平衡的建立
3H2 + N2 2NH3
正反应
逆反应
最大
不变
不变
不变
不变
增大
减小
增大
零
最大
零
减小
0~t:v正 v逆 未平衡
t 时刻: v正=v逆 0 平衡
5.化学平衡状态的特征
1)逆:化学平衡研究的对象是___________。
2)等:达到平衡状态时,正反应速率和逆反应速率__________,但___________零,即v正_______v逆________0。
3.动:是指化学平衡属于____________。达到平衡状态时,正、逆反应仍在_________,只是v正________v逆而已。
4.定:平衡时,各组分的浓度保持________,各组成成分的含量保持________。
5.变:当外界条件(如浓度、压强、温度等)变化时,则原平衡________,反应混合物中各组分的浓度就会___________,在新的条件下会____________。
可逆反应
相等
不等于
=
动态平衡
进行反应
=
一定
不变
改变
改变
建立新的平衡
6.化学平衡状态的判断
判断一个可逆反应在一定条件下是否达到限度或平衡状态:
1)看速率:v正=v逆 即平衡
两个要求:a.将各物质表示的速率除以各自的化学计量数后数值相等
(2)看浓度:平衡时,各物质的浓度保持不变,但不一定要相等,也不一定成比例
b.反应方向体现正和逆
延伸:平衡时,反应体系颜色、各物质的质量、百分含量都不变
三、化学反应条件的控制
1.控制反应条件的目的:
有害物质的产生
转化率
反应速率
反应速率
2.提高燃料的燃烧效率——以煤的燃烧为例
煤的状态:将煤粉碎以增大其与空气的 接触
空气用量:适当 过量 提高燃烧效率
炉(灶)膛材料:选择保温性能好的材料
烟道废气:用烟道废气中的热量加热水
提高热量利用率
随堂测:
1.一定温度下,可逆反应3X(g)+Y(g)?? 2Z(g)达到反应限度的标志是( C )
A.X、Y、Z的浓度相等
B.X的生成速率与Z的生成速率相等
C.单位时间内生成3n mol X,同时消耗n mol Y
D.X、Y、Z的分子个数比为3∶1∶2
2.可逆反应进行到一定程度时,反应物、生成物浓度均不再改变,这是因为( C )
A.反应停止了
B.某种反应物已完全反应
C.正反应速率和逆反应速率相等
D.反应物和生成物的物质的量相等
3.一定温度下,在容积不变的密闭容器中,可逆反应X(g)+3Y(g)? ?2Z(g)达到平衡的标志是( C )
A.气体总质量保持不变
B.X、Y、Z的浓度都相等
C.X、Y、Z的浓度不再发生变化
D.X、Y、Z的分子数之比为1∶3∶2
4.如图是可逆反应:X2+3Y2?? 2Z2,在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( A )
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应未达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
5.下列反应条件的控制中不恰当的是( D )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率,加入MnO2
D.为加快H2O2的分解速率,把反应容器放到冷水中冷却
6.下列各关系中能说明反应N2+3H2
2NH3已达到平衡状态的是( C )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
测定时刻/s浓度/(mol·L-1) t1 t2 t3 t4
c(A) 6 3 2 2
c(B) 5 3.5 3 3
c(C) 1 2.5 3 3
A.在t3 s时反应已经停止
B.t3~t4 s内正、逆反应速率不相等
C.在容器中发生的反应为2A+B?? C
D.在t3 s时,反应已达到平衡状态
7.在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1、t2、t3、t4 s时测得各物质的浓度数据如下表,则下列判断正确的是( D )
8.下列说法正确的是( B )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
C.将铜片放入稀硫酸中,无明显现象;若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
D.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
9.下列能说明恒温恒容密闭容器中的反应:P(g)+Q(g)?? R(g)+S(g)已达到平衡状态的是( C )
A.反应容器内压强不随时间变化
B.反应容器内气体的总物质的量不随时间变化
C.P和S的生成速率相等
D.容器内P、Q、R、S的物质的量浓度之比为1∶1∶1∶1
谢谢聆听
《化学反应的速率与限度》
第1课时 化学反应的速率
化学反应快慢不同
情境引入
HCl+NaOH=NaCl+H2O
千分之一秒即完成
H2+Cl2=2HCl
百分之一秒即完成
救心丹
几分钟见效
钢铁腐蚀
若干年
煤、石油等化石燃料的形成
几千万年以上
2.定义:化学反应速率用单位时间(如每秒,每分,每小时)内 的减小量或
的增加量来表示。
一、化学反应速率
3.表达式:v=
△C
t
△C=
△n
V
4.单位:mol/(L.min) 或 mol/(L.s)
1.意义:表示化学反应 的物理量
速度快慢
反应物浓度
生成物浓度
例:H2和N2反应生成NH3,5min内H2由6mol/L变成了2mol/L,则用H2表示的化学反应速率是多少?
V(H2)=
=
=
△C(H2)
t
(6-2)mol/L
5min
0.8mol/(L.min)
(1)化学反应速率是平均速率,同一反应用不同物质表示的化学反应速率数值可能不同,但意义相同,且必须注明物质。
(2)起始浓度与化学计量数比无关,但是
一定与化学计量数成比例。
注意事项
变化浓度
(3)同一反应中,各物质的反应速率之比等于化学计量数之比。例如 2A+3B = C+4D(A、B、C、D都不是固体或纯液体) ν(A):ν(B):ν(C):ν(D) =
(4)同一方程式中,比较用不同物质表示的化学反应速率的快慢,用每种物质表示的速率 除以各自的化学计量数 即可比较。
(5)固体和纯液体比如水,不能表示化学反应速率。只有溶液中的溶质 和 气体 可以表示速率。
2:3:1:4
随堂测1:
1.某反应的反应物浓度在5 min内由11 mol/L变成了1 mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为______________。
2.在一密闭容器里装有氮气和氢气。反应开始时,氮气的浓度为2mol/L,氢气的浓度为5mol/L, 2min时测得容器中氮气的浓度为1.8mol/L。2min内氮气、氢气和氨气的平均反应速率分别是__________、________、__________
3.在 N2+3H2
2NH3反应中,下列各表示该反应的
速度最快的是 ( )
A.v(N2)=0.2mol/(L·min) B.v(H2)=0.5mol/(L·min)
C.v(NH3)=0.3mol/(L·min)
1.2 mol/(L.min)
0.1 mol/(L.min) 0.3 mol/(L.min) 0.2 mol/(L.min)
A
二、影响化学反应速率的因素
实验探究1:双氧水分解(氯化铁做催化剂),一份放入冷水,一份放入热水,观察气泡产生的速度:2H2O2=FeCl3==2H2O+O2↑
现象 结论
热水中 升高温度 反应速率加快
冷水中 降低温度 反应速率减慢
产生气泡的速度快
产生气泡的速度慢
结论1:其它条件不变时,升高温度可以加快反应速率;降低温度可以减慢反应速率。
实验探究2:浓度分别为0.1mol/L、1mol/L的盐酸与同浓度的碳酸钠溶液反应,观察反应的剧烈程度: Na2CO3+2HCl=2NaCl+H2O+CO2↑
现象 结论
0.1mol/L盐酸 反应速率慢
1mol/L盐酸 反应速率快
产生气泡的速度慢
产生气泡的速度快
反应物浓度小
反应物浓度大
结论1:其它条件不变时,增大反应物浓度,可以加快反应速率
实验探究3:在3支大小相同的试管中各装入2~3mL 约5%的H2O2溶液,再向其中两支试管中分别加入少量MnO2粉末、1~2滴1mol·L-1 FeCl3溶液。对比观察。
现象 结论
加入MnO2 产生 气泡 MnO2加快H2O2分解速率
加入FeCl3溶液 产生 气泡 FeCl3加快H2O2分解速率
不加其它试剂 产生 气泡 无催化剂时缓慢分解
大量
大量
少量
结论3:选择适当的催化剂可以成千上万倍的 加快反应速率。
总结:
1.化学反应速率的计算公式
内因:
反应物自身的性质
外因:
浓度、温度、催化剂
除此之外,还有增大固体的表面积(如粉碎)、形成原电池、压缩气体反应的容器(增大气体浓度)等也能加快反应速率
4.影响化学反应速率的因素:
2.同一方程式中,反应速率与化学计量数之间的关系
3.比较用不同物质表示的反应速率的快慢
随堂测2:
1.下列措施肯定能使化学反应速率增大的是(C )
A.增大反应物的量 B.增大压强
C.升高温度 D.使用催化剂
2.下列条件一定能使反应速率加快的是( D )
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
3.反应在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每分钟变化正确的是( A )
A.NO:0.06 B.H2O:0.08
C.NH3:0.12 D.O2:0.10
4.在N2 + 3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 ,在此时间内用NH3表示的反应速率为0.30·S-1。则此一段时间是( B )
A.1秒 B.2秒 C.0.44秒D.1.33秒
5. 在2A + B = 3C + 4D的反应中, 下列表示该反应的化反速率最快的是( B )
A. V(A) = 0.5 mol/(L·s)
B. V(B) = 0.3 mol/(L·s)
C. V(C) = 0.8 mol/(L·s)
D. V(D) = 1 mol/(L·s)
6.某温度时,2L容器中X、Y、Z三种物质的
量随时间的变化如图所示。由图中数据分析,该
反应的化学方程式为 ;
反应开始至2min ,Z的平均反应速率为 :
3X+Y 2Z
0.05mol/(L.min)
第二课时:化学反应的限度
思考
在一定条件下,将1 mol N2和3 mol H2置于密闭容器中充分反应,能否得到2 mol NH3
不能。原因是N2和H2合成氨的反应属于可逆反应,反应物转化率达不到100%。
一、可逆反应
可逆反应:在同一条件下____________和
____________均能进行的化学反应,书写可
逆反应的化学方程式时不用“===”而用
“______”。可逆反应方程式中,反应不能
完全进行,每一种物质共同存在。
正反应方向
逆反应方向
二、化学反应的限度
1、定义:. 当一个 可逆 反应进行到正向反应
速率与逆向反应速率 相等 时,反应物和生成
物的浓度 ,达到 的一种状态。这就是这个反应所能达到的限度;此时这个状态就叫做 状态,简称化学平衡。
不再变化
表面静止
化学平衡
2.达到平衡状态时,反应物的转化率达到最大。
3.化学平衡状态是可逆反应在一定条件下所能
达到或完成的最大程度,即该反应进行的
4.化学平衡的建立
3H2 + N2 2NH3
正反应
逆反应
最大
不变
不变
不变
不变
增大
减小
增大
零
最大
零
减小
0~t:v正 v逆 未平衡
t 时刻: v正=v逆 0 平衡
5.化学平衡状态的特征
1)逆:化学平衡研究的对象是___________。
2)等:达到平衡状态时,正反应速率和逆反应速率__________,但___________零,即v正_______v逆________0。
3.动:是指化学平衡属于____________。达到平衡状态时,正、逆反应仍在_________,只是v正________v逆而已。
4.定:平衡时,各组分的浓度保持________,各组成成分的含量保持________。
5.变:当外界条件(如浓度、压强、温度等)变化时,则原平衡________,反应混合物中各组分的浓度就会___________,在新的条件下会____________。
可逆反应
相等
不等于
=
动态平衡
进行反应
=
一定
不变
改变
改变
建立新的平衡
6.化学平衡状态的判断
判断一个可逆反应在一定条件下是否达到限度或平衡状态:
1)看速率:v正=v逆 即平衡
两个要求:a.将各物质表示的速率除以各自的化学计量数后数值相等
(2)看浓度:平衡时,各物质的浓度保持不变,但不一定要相等,也不一定成比例
b.反应方向体现正和逆
延伸:平衡时,反应体系颜色、各物质的质量、百分含量都不变
三、化学反应条件的控制
1.控制反应条件的目的:
有害物质的产生
转化率
反应速率
反应速率
2.提高燃料的燃烧效率——以煤的燃烧为例
煤的状态:将煤粉碎以增大其与空气的 接触
空气用量:适当 过量 提高燃烧效率
炉(灶)膛材料:选择保温性能好的材料
烟道废气:用烟道废气中的热量加热水
提高热量利用率
随堂测:
1.一定温度下,可逆反应3X(g)+Y(g)?? 2Z(g)达到反应限度的标志是( C )
A.X、Y、Z的浓度相等
B.X的生成速率与Z的生成速率相等
C.单位时间内生成3n mol X,同时消耗n mol Y
D.X、Y、Z的分子个数比为3∶1∶2
2.可逆反应进行到一定程度时,反应物、生成物浓度均不再改变,这是因为( C )
A.反应停止了
B.某种反应物已完全反应
C.正反应速率和逆反应速率相等
D.反应物和生成物的物质的量相等
3.一定温度下,在容积不变的密闭容器中,可逆反应X(g)+3Y(g)? ?2Z(g)达到平衡的标志是( C )
A.气体总质量保持不变
B.X、Y、Z的浓度都相等
C.X、Y、Z的浓度不再发生变化
D.X、Y、Z的分子数之比为1∶3∶2
4.如图是可逆反应:X2+3Y2?? 2Z2,在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( A )
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应未达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
5.下列反应条件的控制中不恰当的是( D )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率,加入MnO2
D.为加快H2O2的分解速率,把反应容器放到冷水中冷却
6.下列各关系中能说明反应N2+3H2
2NH3已达到平衡状态的是( C )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)
测定时刻/s浓度/(mol·L-1) t1 t2 t3 t4
c(A) 6 3 2 2
c(B) 5 3.5 3 3
c(C) 1 2.5 3 3
A.在t3 s时反应已经停止
B.t3~t4 s内正、逆反应速率不相等
C.在容器中发生的反应为2A+B?? C
D.在t3 s时,反应已达到平衡状态
7.在一密闭容器中通入A、B、C三种气体,保持一定温度,在t1、t2、t3、t4 s时测得各物质的浓度数据如下表,则下列判断正确的是( D )
8.下列说法正确的是( B )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
C.将铜片放入稀硫酸中,无明显现象;若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
D.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
9.下列能说明恒温恒容密闭容器中的反应:P(g)+Q(g)?? R(g)+S(g)已达到平衡状态的是( C )
A.反应容器内压强不随时间变化
B.反应容器内气体的总物质的量不随时间变化
C.P和S的生成速率相等
D.容器内P、Q、R、S的物质的量浓度之比为1∶1∶1∶1
谢谢聆听
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
