元素守恒思想在化学计算中的应用
图片预览






文档简介
课件18张PPT。 元素守恒思想
在化学计算中的应用 质量守恒定律中的元素守恒思想是化学计算中运用最广泛的一种化学思想。这种守恒即指某元素尽管反应前后存在于不同的物质中,但其质量是相等的。解题时,关键是要善于分析利用反应物中哪种元素守恒来解题。元素守恒的应用1、根据元素守恒分析某物质的组成元素
2、根据元素守恒求某物质的化学式
3、根据元素守恒求反应物或生成物的质量根据元素守恒分析某物质的组成元素
例1:某物质在纯氧中充分燃烧,产生了二氧 化碳和水,判断该物质的组成元素。例2:某物质和二氧化碳反应只生成碳酸钠和氧气,则该物质中( )
A.只有氧元素
B.一定含有钠元素和氧元素
C.只有钠元素
D.一定含有钠元素,可能含有氧元素B例3:先从山茶油中提取76g柠檬醛,将其在氧气中完全燃烧,生成二氧化碳220g、水72g,则柠檬醛的组成中( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳、氧元素,可能含有氢元素根据元素守恒分析某物质的组成元素m(C)=220g× =60g m(H)=72g× =8g
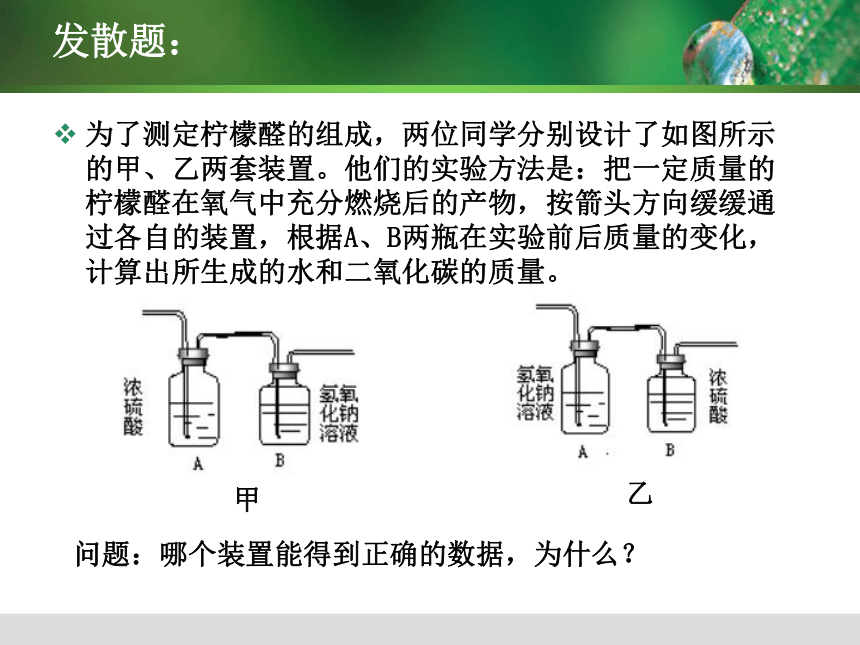
m(C)+m(H)=60g+8g=68g<76g 所以含有氧元素 B要点:化学反应前后,元素的种类和质量不变。发散题:为了测定柠檬醛的组成,两位同学分别设计了如图所示的甲、乙两套装置。他们的实验方法是:把一定质量的柠檬醛在氧气中充分燃烧后的产物,按箭头方向缓缓通过各自的装置,根据A、B两瓶在实验前后质量的变化,计算出所生成的水和二氧化碳的质量。 甲乙问题:哪个装置能得到正确的数据,为什么? 例4: 若一定质量的某化合物在空气中完全燃烧后,生成8.8g二氧化碳和5.4g水,则该化合物可能是( )
A.CH4 B.C2H6
C.C2H5OH D.CH3OH根据元素守恒求某物质的化学式BC 要点:各元素的实际质量之比等于相对质量之比。 例5:已知在不同的温度下,CO与铁的氧化物反应生成另一种铁的氧化物(或铁单质)和二氧化碳。先利用左图进行实验,反应过程中管内的固体质量随温度的变化曲线如右图。
试据图计算并推断A点固体的合理化学式。根据元素守恒求某物质的化学式【解析】设A点固体的化学式为FexOy
在2.32g FexOy中 m(Fe)=2.40g×70%=1.68g
m(O)=2.32g-1.68g=0.64g
根据铁元素与氧元素的实际质量之比等于两者的相对质量之比,故
56x 1.68g
16y 0.64g
x 3
y 4
所以A点固体是Fe3O4根据元素守恒求某物质的化学式== 例6:现有一样品,经分析含氢氧化钾、碳酸钾和水三种物质。向该样品中加入溶质质量分数为7.3%的稀盐酸100g,恰好完全反应得到中性溶液,蒸干该溶液得到固体的质量为( )
A.74.5g B.14.9g
C.10g D.7.45g根据元素守恒求反应物或生成物的质量要点:忽略反应的中间过程,关注变化前后已知物质和所求物质中不变的量,可简记为“不看中间只看两头”。 B KOH + HCl = KCl + H2O
K2CO3 + 2HCl = 2KCl +H2O +CO2 例7:有一种含CaCO3与CaO的混合物,测得其中钙元素的质量分数为50%,取该混合物16 g,经高温煅烧后,CaCO3完全分解,将剩余固体投入足量的水中,固体全部生成Ca(OH)2,则生成Ca(OH)2的质量为(? )
A、3.7 g????????? B、7.4 g ????????
C、14.8 g???????? D、22.2 g根据元素守恒求反应物或生成物的质量C 例8:将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为( )
A.28.0g B.44.8g
C.56.0g D.78.0g根据元素守恒求反应物或生成物的质量A 例9:为测定某NaOH溶液中溶质的质量分数,可将此NaOH溶液20g与20g稀H2SO4充分混合;再向其中滴加CuSO4溶液至恰好完全反应时,消耗CuSO4溶液64.3g,得到蓝色沉淀4.9g和溶质质量分数为10%的无色溶液,试依据以上实验数据计算NaOH溶液中溶质的质量分数。根据元素守恒求反应物或生成物的质量 锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为( )
A.0.15g B.0.20g
C.0.30g D.0.45gA练习 利用下图装置测定某含菱铁矿的矿石中FeCO3的质量分数(杂质不含铁元素且不发生任何变化),实验记录如下表:练习下列判断正确的是( )
A.一氧化碳还原氧化亚铁的反应属于置换反应
B.反应完后,玻璃管及其中物质总质量较反应前减少6g,此为参加反应的FeCO3中碳酸根的质量
C.矿石样品中含的FeCO3质量为11.6g
D.实验结束后盛有石灰水的试管总质量较反应前增重4.4gBC 一定质量的酒精在一定质量的氧气中燃烧生成CO、CO2、H2O,产物的总质量为13.8g,其中 H2O占5.4g。试计算酒精的质量,产物中CO的质量。练习[解析]根据氢元素守恒,酒精中含有的氢元素的质量等于水中含有的氢元素的质量,
设酒精的质量为X,
则:
X× =5.4g×
X=4.6g
根据碳元素守恒,酒精中的碳元素的质量等于一氧化碳和二氧化碳中碳元素的质量之和,设产物中CO的质量为y,
则CO2的质量为(13.8g-5.4g-y)
得:
4.6g× =y× +(13.8g-5.4g-y)×
y=0.7gThank You!
在化学计算中的应用 质量守恒定律中的元素守恒思想是化学计算中运用最广泛的一种化学思想。这种守恒即指某元素尽管反应前后存在于不同的物质中,但其质量是相等的。解题时,关键是要善于分析利用反应物中哪种元素守恒来解题。元素守恒的应用1、根据元素守恒分析某物质的组成元素
2、根据元素守恒求某物质的化学式
3、根据元素守恒求反应物或生成物的质量根据元素守恒分析某物质的组成元素
例1:某物质在纯氧中充分燃烧,产生了二氧 化碳和水,判断该物质的组成元素。例2:某物质和二氧化碳反应只生成碳酸钠和氧气,则该物质中( )
A.只有氧元素
B.一定含有钠元素和氧元素
C.只有钠元素
D.一定含有钠元素,可能含有氧元素B例3:先从山茶油中提取76g柠檬醛,将其在氧气中完全燃烧,生成二氧化碳220g、水72g,则柠檬醛的组成中( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳、氧元素,可能含有氢元素根据元素守恒分析某物质的组成元素m(C)=220g× =60g m(H)=72g× =8g
m(C)+m(H)=60g+8g=68g<76g 所以含有氧元素 B要点:化学反应前后,元素的种类和质量不变。发散题:为了测定柠檬醛的组成,两位同学分别设计了如图所示的甲、乙两套装置。他们的实验方法是:把一定质量的柠檬醛在氧气中充分燃烧后的产物,按箭头方向缓缓通过各自的装置,根据A、B两瓶在实验前后质量的变化,计算出所生成的水和二氧化碳的质量。 甲乙问题:哪个装置能得到正确的数据,为什么? 例4: 若一定质量的某化合物在空气中完全燃烧后,生成8.8g二氧化碳和5.4g水,则该化合物可能是( )
A.CH4 B.C2H6
C.C2H5OH D.CH3OH根据元素守恒求某物质的化学式BC 要点:各元素的实际质量之比等于相对质量之比。 例5:已知在不同的温度下,CO与铁的氧化物反应生成另一种铁的氧化物(或铁单质)和二氧化碳。先利用左图进行实验,反应过程中管内的固体质量随温度的变化曲线如右图。
试据图计算并推断A点固体的合理化学式。根据元素守恒求某物质的化学式【解析】设A点固体的化学式为FexOy
在2.32g FexOy中 m(Fe)=2.40g×70%=1.68g
m(O)=2.32g-1.68g=0.64g
根据铁元素与氧元素的实际质量之比等于两者的相对质量之比,故
56x 1.68g
16y 0.64g
x 3
y 4
所以A点固体是Fe3O4根据元素守恒求某物质的化学式== 例6:现有一样品,经分析含氢氧化钾、碳酸钾和水三种物质。向该样品中加入溶质质量分数为7.3%的稀盐酸100g,恰好完全反应得到中性溶液,蒸干该溶液得到固体的质量为( )
A.74.5g B.14.9g
C.10g D.7.45g根据元素守恒求反应物或生成物的质量要点:忽略反应的中间过程,关注变化前后已知物质和所求物质中不变的量,可简记为“不看中间只看两头”。 B KOH + HCl = KCl + H2O
K2CO3 + 2HCl = 2KCl +H2O +CO2 例7:有一种含CaCO3与CaO的混合物,测得其中钙元素的质量分数为50%,取该混合物16 g,经高温煅烧后,CaCO3完全分解,将剩余固体投入足量的水中,固体全部生成Ca(OH)2,则生成Ca(OH)2的质量为(? )
A、3.7 g????????? B、7.4 g ????????
C、14.8 g???????? D、22.2 g根据元素守恒求反应物或生成物的质量C 例8:将100g含CaCO3质量分数为80%的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为( )
A.28.0g B.44.8g
C.56.0g D.78.0g根据元素守恒求反应物或生成物的质量A 例9:为测定某NaOH溶液中溶质的质量分数,可将此NaOH溶液20g与20g稀H2SO4充分混合;再向其中滴加CuSO4溶液至恰好完全反应时,消耗CuSO4溶液64.3g,得到蓝色沉淀4.9g和溶质质量分数为10%的无色溶液,试依据以上实验数据计算NaOH溶液中溶质的质量分数。根据元素守恒求反应物或生成物的质量 锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为( )
A.0.15g B.0.20g
C.0.30g D.0.45gA练习 利用下图装置测定某含菱铁矿的矿石中FeCO3的质量分数(杂质不含铁元素且不发生任何变化),实验记录如下表:练习下列判断正确的是( )
A.一氧化碳还原氧化亚铁的反应属于置换反应
B.反应完后,玻璃管及其中物质总质量较反应前减少6g,此为参加反应的FeCO3中碳酸根的质量
C.矿石样品中含的FeCO3质量为11.6g
D.实验结束后盛有石灰水的试管总质量较反应前增重4.4gBC 一定质量的酒精在一定质量的氧气中燃烧生成CO、CO2、H2O,产物的总质量为13.8g,其中 H2O占5.4g。试计算酒精的质量,产物中CO的质量。练习[解析]根据氢元素守恒,酒精中含有的氢元素的质量等于水中含有的氢元素的质量,
设酒精的质量为X,
则:
X× =5.4g×
X=4.6g
根据碳元素守恒,酒精中的碳元素的质量等于一氧化碳和二氧化碳中碳元素的质量之和,设产物中CO的质量为y,
则CO2的质量为(13.8g-5.4g-y)
得:
4.6g× =y× +(13.8g-5.4g-y)×
y=0.7gThank You!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
