3.1.2 弱电解质的电离平衡课后强化习题(word版含答案)
文档属性
| 名称 | 3.1.2 弱电解质的电离平衡课后强化习题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 250.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-10 20:44:32 | ||
图片预览



文档简介
第三章第一节第二课时弱电解质的电离平衡课后强化习题
一、单选题(共16题)
1.醋酸的下列性质中,可以证明它是弱电解质的是( )
A.醋酸溶液能使紫色石蕊试液变红 B.0.1 mol/L 的醋酸溶液的 pH 约为 2
C.1 L 1 mol/L 的醋酸恰好与 1L 1 mol/L NaOH 溶液完全反应 D.醋酸溶液的导电性比盐酸的导电性弱
2.下列溶液的导电性最强的是( )
A.1 L 0.1溶液 B.0.1 L 0.1溶液
C.0.5 L 0.1溶液 D.2 L 0.1溶液
3.下列说法中正确的是( )
A.碳酸的电离方程式是H2CO32H++CO B.醋酸是弱电解质,液态时能导电
C.盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 D.0.1mol·L-1氨水中NH的浓度小于0.1mol·L-1
4.已知:H2R=H++HR-,HR-H++R2-,NA是阿伏加德罗常数的值。常温下,对pH=1的H2R溶液的有关说法错误的是( )
A.1 L该溶液中H+数目为0.1NA B.Na2R溶液中存在R2-、HR-、H2R等粒子
C.该溶液中c(H+)=c(OH-)+c(HR-)+2c(R2-)
D.常温下,加水稀释该溶液,HR-的电离程度增大
5.对于常温下pH=3的乙酸溶液,下列说法正确的是( )
A.通入HCl气体,乙酸的电离程度减小 B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH减小 D.加水稀释后,溶液中c(H+)和c(OH-)都减小
6.关于氨水和氢氧化钠两种溶液,下列说法不正确的是( )
A.相同温度下,pH相等的两溶液中:c()=c(Na+)
B.用同浓度的盐酸分别中和pH相等、体积相等的两溶液,氨水消耗的盐酸体积更多
C.同浓度同体积的两溶液,稀释相同的倍数后,氢氧化钠溶液的pH值比氨水大
D.25℃和40℃时,0.1 mol/L 的氨水的pH值不相等,而0.1 mol/L的氢氧化钠溶液的pH值相等
7.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的c(H+)是10-4 mol·L-1
B.升高温度,溶液的酸性减弱
C.此一元酸的电离平衡常数约为1×10-7
D.向一元酸HA的溶液中,通入HCl气体,HA的电离平衡向逆反应方向移动,但c(H+)增大
8.25 ℃时,的盐酸和醋酸溶液各分别加水稀释,溶液导电能力随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.曲线Ⅰ代表盐酸的稀释过程
B.a点溶液中的比b点溶液中的大
C.b点溶液中和氢氧化钠的能力强于a点溶液
D.将a、b两点所示溶液加热至30 ℃,的值变小
9.已知:100%硫酸吸收可生成焦硫酸(分子式为或);硫酸水溶液中发生如下电离:,
。
结合以上信息,下列说法不正确的是( )
A.焦硫酸具有强氧化性 B.水溶液显中性
C.98%的可以表示为: D.焦硫酸与水反应方程式:
10.已知HClO Ka=3.0×10-8,H2CO3 Ka1=4.1×10-7 Ka2=5.6×10-11试判断下列反应的离子方程式书写正确的是( )
A.硫酸铝溶液中加过量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O
B.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO
C.惰性电极电解MgCl2水溶液Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑
D.澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO=CaCO3↓+H2O
11.常温下,对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法错误的是( )
A.盐酸中的c(H+)更大 B.盐酸中由水电离出的c(H+)更大
C.与Zn反应时,起始时刻盐酸的反应速率更大
D.分别与足量的锌粒充分反应,产生H2的物质的量相同
12.下列叙述中,不能说明氢氰酸(HCN)是弱电解质的是( )
A.常温下,0.1mol/L的氢氰酸溶液的pH>1 B.KCN溶液呈碱性
C.相同条件下,等物质的量浓度的氢氰酸溶液的导电能力比盐酸的弱 D.氢氰酸能与碳酸钠溶液反应
13.25 ℃时,的盐酸和醋酸溶液各分别加水稀释,溶液导电能力随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.曲线Ⅰ代表盐酸的稀释过程
B.a点溶液中的比b点溶液中的大
C.b点溶液中和氢氧化钠的能力强于a点溶液
D.将a、b两点所示溶液加热至30 ℃,的值变小
14.下列有关电解质溶液的说法正确的是( )
A.向Na2CO3溶液中通入HCl,减小
B.向0.1mol·L-1的K2C2O4溶液中加入少量水,减小
C.向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性,=1
D.向0.1mol·L-1的CH3COONa溶液中加入少量NaCl溶液,增大
15.下列“类比”结果正确的是( )
A.的溶解度比的大,则的溶解度也比的大
B.、是酸性氧化物,则也是酸性氧化物
C.pH=1的盐酸稀释100倍后pH=3,则pH=6的稀释100倍后pH=8
D.将丙三醇加入新制中溶液呈绛蓝色,则将葡萄糖溶液加入新制中溶液也呈绛蓝色
16.下列离子方程式与所述事实相符的是( )
A.已知电离平衡常数:,向溶液中通入少量:
B.氢氧化铁溶于氢碘酸(强酸):
C.将nmolCl2通入含有nmolFeBr2的溶液中:2Br-+Cl2=Br2+2Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=+3Cl-+H2O+H+
二、综合题(共4题)
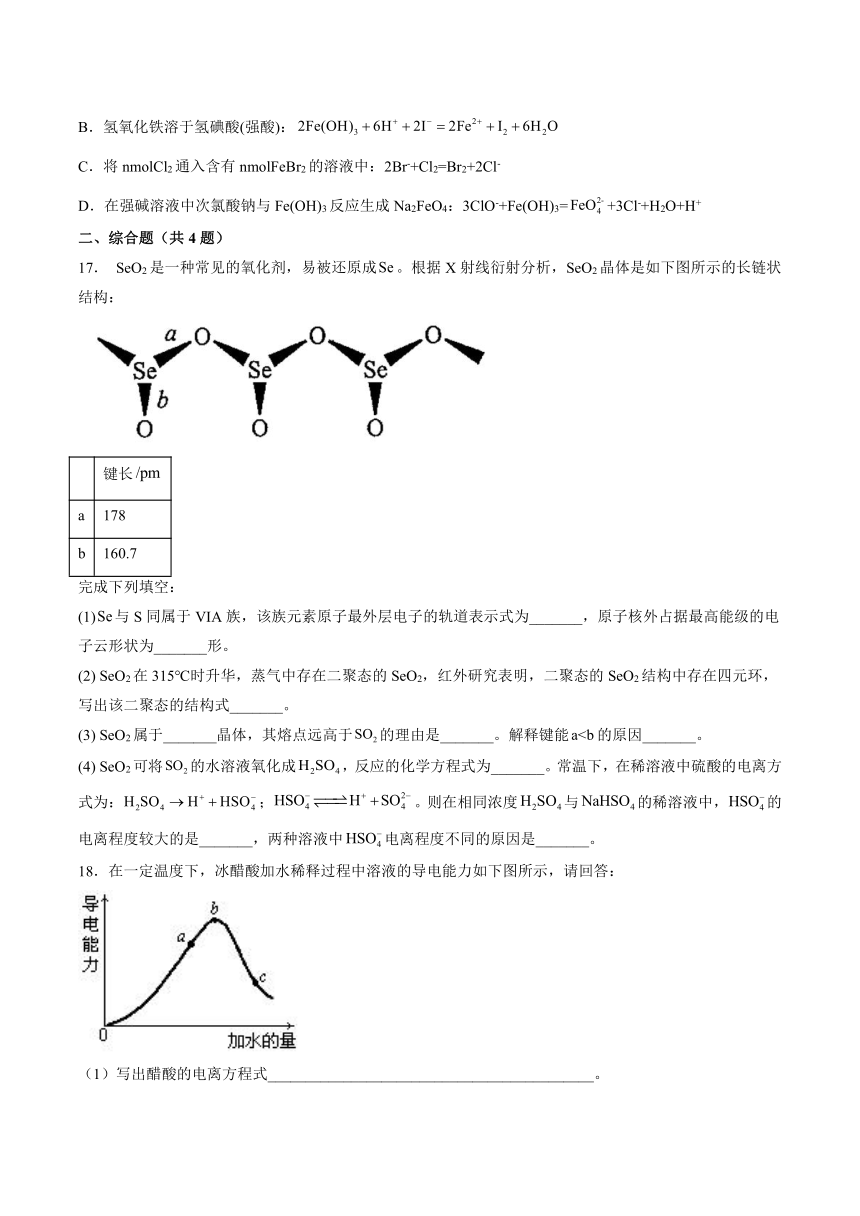
17. SeO2是一种常见的氧化剂,易被还原成。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
键长
a 178
b 160.7
完成下列填空:
(1)与S同属于VIA族,该族元素原子最外层电子的轨道表示式为_______,原子核外占据最高能级的电子云形状为_______形。
(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式_______。
(3) SeO2属于_______晶体,其熔点远高于的理由是_______。解释键能的原因_______。
(4) SeO2可将的水溶液氧化成,反应的化学方程式为_______。常温下,在稀溶液中硫酸的电离方式为:;。则在相同浓度与的稀溶液中,的电离程度较大的是_______,两种溶液中电离程度不同的原因是_______。
18.在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
(1)写出醋酸的电离方程式___________________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是_________。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”)
19.硒(34Se)与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥(主要成分是Se,含有CuSe、Ag2Se等杂质)为原料,提炼硒的流程如下:
请回答下列问题:
(1)硒原子的次外层电子数_______,与硒同周期相邻元素是________(填元素名称)。
(2)已知A是Na2SeO3,可用于治疗克山病,则A的化学名称为______;C是Na2Se,则Na2Se的电子式为_______。
(3)上述流程图中的括号内“( )”,按操作先后顺序依次填写的内容是_____、_____。
(4)写出高温下用焦炭还原B的化学方程式___________________。
(5)溶液C中析出硒的离子方程式____________________。
(6)向Na2SeO3溶液中滴加稍过量的乙酸,其离子方程式为__________________。已知:Ka1(H2SeO3)=2.7×10-3、Ka2(H2SeO3)=2.5×10-8、Ka(CH3COOH)=1.8×10-5。
(7)粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
蒸馏操作中控制的最佳温度是________(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
20.I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。
(1)如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式____________。
(2)H2O2可看作二元弱酸,写出它在水中第一步电离的方程式__________________。
II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式: _____________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为______________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
(3)若A为淡黄色粉末,则A的电子式为____________________。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为__________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为________________________________,E是__________(填化学式)。
参考答案
1.B
2.B
3.D
4.B
5.A
6.D
7.B
8.B
9.B
10.C
11.B
12.D
13.B
14.C
15.D
16. B
17.(1) 哑铃或纺锤体 (2)
(3) 分子 SeO2和SO2均为分子晶体,SeO2的相对分子质量比SO2的大,故SeO2的分子间作用力比SO2的大 a键为Se-O单键,b键为Se=O双键,双键的键能大于单键的键能
(4)SeO2+2SO2+2H2O=2H2SO4+Se 的稀溶液 H2SO4溶液中一级电离产生的H+,抑制了的电离
18.(1)CH3COOHCH3COO-+H+ (2) c<a<b (3) c (4) 小于
19.(1)18 砷、溴
(2) 亚硒酸钠
(3) 粉碎 过滤
(4)Na2SeO4 +4CNa2Se +4CO↑
(5) 2Se2- +O2 +2CO2=2Se↓+2CO32- (或2Se2- +O2 +4CO2 +2H2O=2Se↓+4HCO3-)
(6)SeO32-+CH3COOH=HSeO3- +CH3COO-
(7) C
20.I.(1)H2+O2H2O2 (2)H2O2H++HO2-
II.(1) OH-+HSO3-=SO32-+H2O (2) bd
(3) ab
(4) 3NO2+H2O=2HNO3+NO Fe(NO3)2
一、单选题(共16题)
1.醋酸的下列性质中,可以证明它是弱电解质的是( )
A.醋酸溶液能使紫色石蕊试液变红 B.0.1 mol/L 的醋酸溶液的 pH 约为 2
C.1 L 1 mol/L 的醋酸恰好与 1L 1 mol/L NaOH 溶液完全反应 D.醋酸溶液的导电性比盐酸的导电性弱
2.下列溶液的导电性最强的是( )
A.1 L 0.1溶液 B.0.1 L 0.1溶液
C.0.5 L 0.1溶液 D.2 L 0.1溶液
3.下列说法中正确的是( )
A.碳酸的电离方程式是H2CO32H++CO B.醋酸是弱电解质,液态时能导电
C.盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 D.0.1mol·L-1氨水中NH的浓度小于0.1mol·L-1
4.已知:H2R=H++HR-,HR-H++R2-,NA是阿伏加德罗常数的值。常温下,对pH=1的H2R溶液的有关说法错误的是( )
A.1 L该溶液中H+数目为0.1NA B.Na2R溶液中存在R2-、HR-、H2R等粒子
C.该溶液中c(H+)=c(OH-)+c(HR-)+2c(R2-)
D.常温下,加水稀释该溶液,HR-的电离程度增大
5.对于常温下pH=3的乙酸溶液,下列说法正确的是( )
A.通入HCl气体,乙酸的电离程度减小 B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH减小 D.加水稀释后,溶液中c(H+)和c(OH-)都减小
6.关于氨水和氢氧化钠两种溶液,下列说法不正确的是( )
A.相同温度下,pH相等的两溶液中:c()=c(Na+)
B.用同浓度的盐酸分别中和pH相等、体积相等的两溶液,氨水消耗的盐酸体积更多
C.同浓度同体积的两溶液,稀释相同的倍数后,氢氧化钠溶液的pH值比氨水大
D.25℃和40℃时,0.1 mol/L 的氨水的pH值不相等,而0.1 mol/L的氢氧化钠溶液的pH值相等
7.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的c(H+)是10-4 mol·L-1
B.升高温度,溶液的酸性减弱
C.此一元酸的电离平衡常数约为1×10-7
D.向一元酸HA的溶液中,通入HCl气体,HA的电离平衡向逆反应方向移动,但c(H+)增大
8.25 ℃时,的盐酸和醋酸溶液各分别加水稀释,溶液导电能力随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.曲线Ⅰ代表盐酸的稀释过程
B.a点溶液中的比b点溶液中的大
C.b点溶液中和氢氧化钠的能力强于a点溶液
D.将a、b两点所示溶液加热至30 ℃,的值变小
9.已知:100%硫酸吸收可生成焦硫酸(分子式为或);硫酸水溶液中发生如下电离:,
。
结合以上信息,下列说法不正确的是( )
A.焦硫酸具有强氧化性 B.水溶液显中性
C.98%的可以表示为: D.焦硫酸与水反应方程式:
10.已知HClO Ka=3.0×10-8,H2CO3 Ka1=4.1×10-7 Ka2=5.6×10-11试判断下列反应的离子方程式书写正确的是( )
A.硫酸铝溶液中加过量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O
B.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO
C.惰性电极电解MgCl2水溶液Mg2++2Cl-+2H2OMg(OH)2↓+H2↑+Cl2↑
D.澄清石灰水与足量小苏打溶液混合:Ca2++OH-+HCO=CaCO3↓+H2O
11.常温下,对于相同物质的量浓度、相同体积的盐酸和醋酸,下列几种说法错误的是( )
A.盐酸中的c(H+)更大 B.盐酸中由水电离出的c(H+)更大
C.与Zn反应时,起始时刻盐酸的反应速率更大
D.分别与足量的锌粒充分反应,产生H2的物质的量相同
12.下列叙述中,不能说明氢氰酸(HCN)是弱电解质的是( )
A.常温下,0.1mol/L的氢氰酸溶液的pH>1 B.KCN溶液呈碱性
C.相同条件下,等物质的量浓度的氢氰酸溶液的导电能力比盐酸的弱 D.氢氰酸能与碳酸钠溶液反应
13.25 ℃时,的盐酸和醋酸溶液各分别加水稀释,溶液导电能力随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.曲线Ⅰ代表盐酸的稀释过程
B.a点溶液中的比b点溶液中的大
C.b点溶液中和氢氧化钠的能力强于a点溶液
D.将a、b两点所示溶液加热至30 ℃,的值变小
14.下列有关电解质溶液的说法正确的是( )
A.向Na2CO3溶液中通入HCl,减小
B.向0.1mol·L-1的K2C2O4溶液中加入少量水,减小
C.向0.1mol·L-1的HF溶液中滴加NaOH溶液至中性,=1
D.向0.1mol·L-1的CH3COONa溶液中加入少量NaCl溶液,增大
15.下列“类比”结果正确的是( )
A.的溶解度比的大,则的溶解度也比的大
B.、是酸性氧化物,则也是酸性氧化物
C.pH=1的盐酸稀释100倍后pH=3,则pH=6的稀释100倍后pH=8
D.将丙三醇加入新制中溶液呈绛蓝色,则将葡萄糖溶液加入新制中溶液也呈绛蓝色
16.下列离子方程式与所述事实相符的是( )
A.已知电离平衡常数:,向溶液中通入少量:
B.氢氧化铁溶于氢碘酸(强酸):
C.将nmolCl2通入含有nmolFeBr2的溶液中:2Br-+Cl2=Br2+2Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=+3Cl-+H2O+H+
二、综合题(共4题)
17. SeO2是一种常见的氧化剂,易被还原成。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
键长
a 178
b 160.7
完成下列填空:
(1)与S同属于VIA族,该族元素原子最外层电子的轨道表示式为_______,原子核外占据最高能级的电子云形状为_______形。
(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式_______。
(3) SeO2属于_______晶体,其熔点远高于的理由是_______。解释键能的原因_______。
(4) SeO2可将的水溶液氧化成,反应的化学方程式为_______。常温下,在稀溶液中硫酸的电离方式为:;。则在相同浓度与的稀溶液中,的电离程度较大的是_______,两种溶液中电离程度不同的原因是_______。
18.在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
(1)写出醋酸的电离方程式___________________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是_________。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”)
19.硒(34Se)与氧同主族,硒元素及其化合物与人体健康、工业生产密切相关。某科研小组以阳极泥(主要成分是Se,含有CuSe、Ag2Se等杂质)为原料,提炼硒的流程如下:
请回答下列问题:
(1)硒原子的次外层电子数_______,与硒同周期相邻元素是________(填元素名称)。
(2)已知A是Na2SeO3,可用于治疗克山病,则A的化学名称为______;C是Na2Se,则Na2Se的电子式为_______。
(3)上述流程图中的括号内“( )”,按操作先后顺序依次填写的内容是_____、_____。
(4)写出高温下用焦炭还原B的化学方程式___________________。
(5)溶液C中析出硒的离子方程式____________________。
(6)向Na2SeO3溶液中滴加稍过量的乙酸,其离子方程式为__________________。已知:Ka1(H2SeO3)=2.7×10-3、Ka2(H2SeO3)=2.5×10-8、Ka(CH3COOH)=1.8×10-5。
(7)粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
蒸馏操作中控制的最佳温度是________(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
20.I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。
(1)如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式____________。
(2)H2O2可看作二元弱酸,写出它在水中第一步电离的方程式__________________。
II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式: _____________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为______________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
(3)若A为淡黄色粉末,则A的电子式为____________________。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为__________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为________________________________,E是__________(填化学式)。
参考答案
1.B
2.B
3.D
4.B
5.A
6.D
7.B
8.B
9.B
10.C
11.B
12.D
13.B
14.C
15.D
16. B
17.(1) 哑铃或纺锤体 (2)
(3) 分子 SeO2和SO2均为分子晶体,SeO2的相对分子质量比SO2的大,故SeO2的分子间作用力比SO2的大 a键为Se-O单键,b键为Se=O双键,双键的键能大于单键的键能
(4)SeO2+2SO2+2H2O=2H2SO4+Se 的稀溶液 H2SO4溶液中一级电离产生的H+,抑制了的电离
18.(1)CH3COOHCH3COO-+H+ (2) c<a<b (3) c (4) 小于
19.(1)18 砷、溴
(2) 亚硒酸钠
(3) 粉碎 过滤
(4)Na2SeO4 +4CNa2Se +4CO↑
(5) 2Se2- +O2 +2CO2=2Se↓+2CO32- (或2Se2- +O2 +4CO2 +2H2O=2Se↓+4HCO3-)
(6)SeO32-+CH3COOH=HSeO3- +CH3COO-
(7) C
20.I.(1)H2+O2H2O2 (2)H2O2H++HO2-
II.(1) OH-+HSO3-=SO32-+H2O (2) bd
(3) ab
(4) 3NO2+H2O=2HNO3+NO Fe(NO3)2
