3.1.3 电离平衡常数课后强化习题(word版含答案)
文档属性
| 名称 | 3.1.3 电离平衡常数课后强化习题(word版含答案) |

|
|
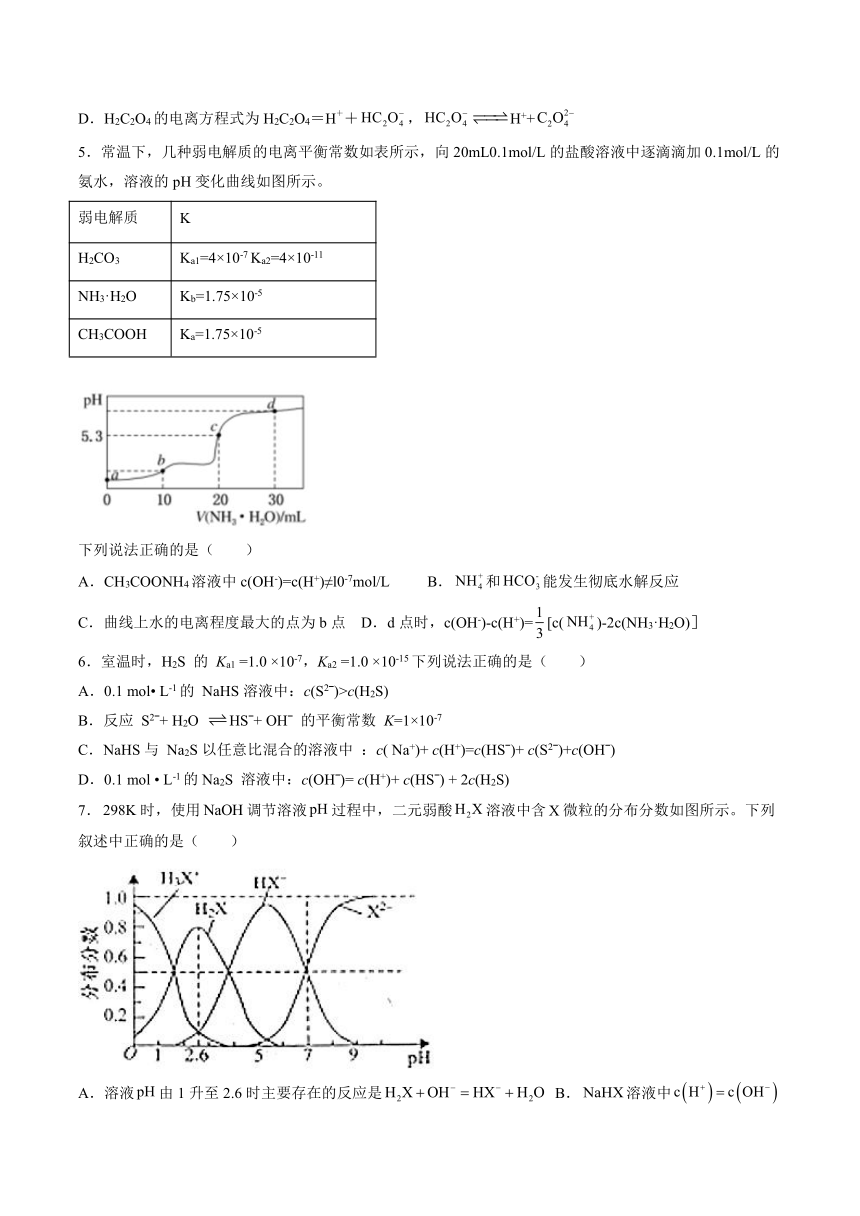
| 格式 | docx | ||
| 文件大小 | 346.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-10 20:48:05 | ||
图片预览



文档简介
第三章第一节第三课时电离平衡常数课后强化习题
一、单选题(共16题)
1.下列方法中,不能使醋酸溶液中 CH3COOH CH3COO- +H+ 电离程度增大的是( )
A.升高温度 B.加水稀释
C.加入少量醋酸钠固体 D.加入少量氢氧化钠固体
2.常温下在下列条件时,可能大量共存的微粒组是( )
化学式 电离常数(25℃)
CH3COOH K1=1.7×10-5
HClO K1=3.0×10-8
H2CO3 K1=4.3×10-7K2=5.6×10-11
A.如表提供的数据下:HClO、HCO、ClO-、CO
B.pH=3的溶液中:CO、Na+、SO、AlO
C.能与Al反应生成H2的溶液:NH、Ca2+、NO、I-
D.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO、S2O
3.氢氰酸()是一种弱酸,在水溶液中存在电离平衡: ,常温下电离常数为。下列说法正确的是( )
A.溶液的 B.增大溶液浓度,其电离程度减小
C.升高溶液温度,平衡逆向移动 D.加入少量溶液,会使增大
4.25℃时,向20 mL 0.2 mol·L 1 H2C2O4溶液中逐滴加入0.2 mol·L 1 NaOH溶液。溶液中H2C2O4、、的物质的量分数变化如图所示。下列有关说法正确的是( )
A.a点对应的溶液中c(Na+)+c(H+)=c(OH-)+3c()
B.由图中数据可计算得曲线H2C2O4与曲线交点的pH=2.6
C.加入20 mL NaOH溶液时,溶液中c(Na+)>c()>c(H2C2O4)>c()
D.H2C2O4的电离方程式为H2C2O4=H++,H++
5.常温下,几种弱电解质的电离平衡常数如表所示,向20mL0.1mol/L的盐酸溶液中逐滴滴加0.1mol/L的氨水,溶液的pH变化曲线如图所示。
弱电解质 K
H2CO3 Ka1=4×10-7 Ka2=4×10-11
NH3·H2O Kb=1.75×10-5
CH3COOH Ka=1.75×10-5
下列说法正确的是( )
A.CH3COONH4溶液中c(OH-)=c(H+)≠l0-7mol/L B.和能发生彻底水解反应
C.曲线上水的电离程度最大的点为b点 D.d点时,c(OH-)-c(H+)=[c()-2c(NH3·H2O)]
6.室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是( )
A.0.1 mol L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
7.时,使用调节溶液过程中,二元弱酸溶液中含微粒的分布分数如图所示。下列叙述中正确的是( )
A.溶液由1升至2.6时主要存在的反应是 B.溶液中
C. D.溶液呈中性时,
8.常温下,在醋酸溶液中加入一定量的醋酸钠固体,下列说法错误的是( )
A.c(OH-)减小 B.醋酸的电离程度减小
C.溶液的pH增大 D.c(Ac-)增大
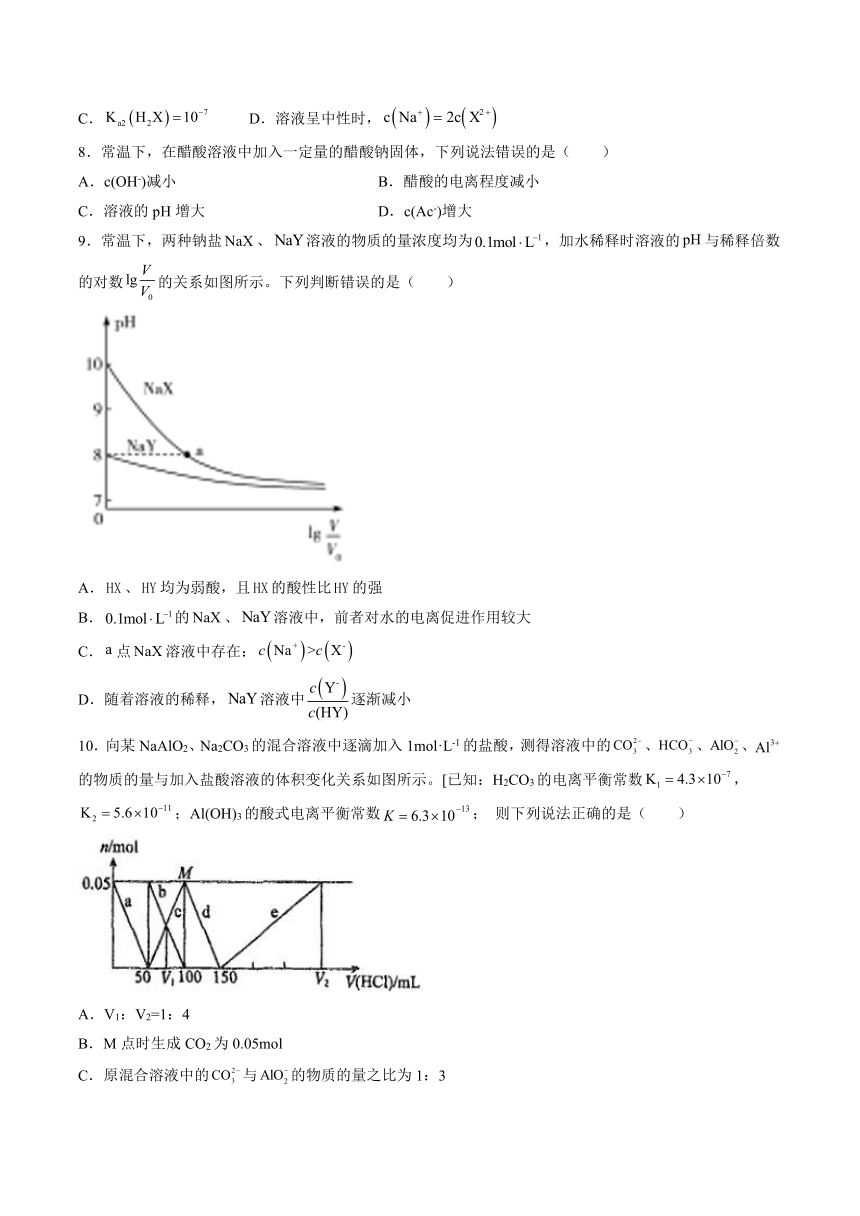
9.常温下,两种钠盐、溶液的物质的量浓度均为,加水稀释时溶液的与稀释倍数的对数的关系如图所示。下列判断错误的是( )
A.、均为弱酸,且的酸性比的强
B.的、溶液中,前者对水的电离促进作用较大
C.点溶液中存在:
D.随着溶液的稀释,溶液中逐渐减小
10.向某NaAlO2、Na2CO3的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的、、、的物质的量与加入盐酸溶液的体积变化关系如图所示。[已知:H2CO3的电离平衡常数,;Al(OH)3的酸式电离平衡常数; 则下列说法正确的是( )
A.V1:V2=1:4
B.M点时生成CO2为0.05mol
C.原混合溶液中的与的物质的量之比为1:3
D.a曲线表示的离子方程式为
11.下列反应的离子方程式正确的是( )
A.向稀溶液中加入稀盐酸:
B.向、的溶液中加入溶液:
C.向溶液中加入过量的溶液:
D.向溶液中通入少量:
12.已知电离平衡常数大小:H2CO3>HClO>HCO,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,Fe3+、Cl-、Ba2+、Br-、I-能在溶液中大量共存
B.向含有0. 4 mol FeI2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2I- +3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:C1O-+CO2+H2O=HClO+HCO
D.向FeBr2溶液中滴加少量氯水,再加入CCl4振荡,静置,有机层呈橙色
13.某浓度的二元弱酸H2B溶液在不同pH下,测得Pc(M)变化如图所示,(已知: Pc(M)=-1gc(M),M代指H2B或HB-或B2-),下列说法正确的是( )
A.曲线II表示Pc(HB-)与pH关系
B.pH=5时,c(HB- )C.由图像数据可以计算出的值
D.在pH增大的过程中,c(H2B)、c(HB-)、 c(B2-)三者浓度和先减小后增大
14.锂金属电池的电解液在很大程度上制约着锂电池的发展,某种商业化锂电池的电解质的结构如图所示。已知短周期主族元素X、Y、Z、M和W的原子序数依次增大,且0.1mol/LXW的水溶液呈酸性且,W元素在周期表中非金属性最强,Y元素最外层有3个电子,M元素一般无正价。下列说法正确的是( )
A.最高价含氧酸的酸性: B.氢化物的沸点:
C.W的单质可与M的氢化物发生置换反应 D.分子中各原子最外层都达到8电子稳定结构
15.常温下,有体积相同的四种溶液:①pH=2的CH3COOH溶液;②pH=2的盐酸;③0.01mol/L的醋酸溶液;④0.01mol/L的盐酸。下列说法正确的是( )
A.把四种溶液稀释到相同pH,所需水的体积:①>②=④=③
B.四种溶液中和氢氧化钠的能力:①=②=③=④
C.与镁条反应的起始速率的大小关系为:①>②=④>③
D.与镁条反应生成相同体积的氢气所需的时间为:①<②=④<③
16.最新研究表明,在多孔炭材料,上搭载活性组分催化氧化脱硫效果明显优于传统方法,其反应机理如图所示,此时在水中浓度为0.34g/100mL。下列有关说法正确的是( )
A.温度过高不利于脱硫的效果 B.活性炭作用是降低反应物的总能量
C.该反应的总反应是吸热过程 D.该温度下,的
二、综合题(共4题)
17.在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸(用a、b、c填空):
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__。
(2)若三者pH相同时,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是___。
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是__。
(4)在25℃下,将amol/L的醋酸与0.01mol/L的NaOH溶液等体积混合后溶液的pH=7,用含a的代数式表示25℃时CH3COOH的电离常数Ka=__。
(5)设计一个实验证明醋酸是弱电解质:
操作:__;
现象:__;
结论:醋酸是弱电解质。
18.I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:(单位省略)
醋酸 碳酸 氢氰酸
Ka=1.7×10-5 Ka1=4.2×10-7 Ka2=5.6×10-11 Ka=6.2×10-10
(1)写出碳酸的第一步电离方程式_________。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为(填序号)__________。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为__________。
(4)将浓度为0.02 mol/L的HCN与0.01 mol/LINaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是________。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)
c.c(HCN)+c(CN-)=0.01 mol/L
(5)25℃时,浓度均为0.01 mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为________(填序号)。
II.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学0.1000 mol/L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用________装KMnO4溶液
②滴定到达终点的现象是___________。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 第二次 第三次 第四次
体积(mL) 17.10 18.10 17.00 16.90
则试样中过氧化氢的浓度为________mol/L-1。
19.已知 25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7、Ka2=5.6×10-11 Ka=3.0×10-8
(1)表中三种酸酸性最强的是__________。
(2)常温下,0.1 mol L1 CH3COOH 溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
A.c(H+) B. C. D.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。
(4)25℃时,将a mol L1 醋酸与b mol L1 氢氧化钠等体积混合,反应后溶液恰好显中性,这时钠离子浓度与醋酸根离子浓度相等,用 a、b 表示醋酸的电离平衡常数为__________。
20.(1)25℃时,HF的Ka=6.4×10-4,则此温度下0.1mol·L-1 HF溶液的c(H+)为_____mol·L-1。
(2)25℃时,a mol·L-1 CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=___。
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++, H++SeO,K2=1.0×10-2(25℃)。
①向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为____。
②已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为____。
(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。现在该温度下将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是____________。
(5)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下反应不能自发进行的是____(填字母)。
a.HCOOH+NaCN=HCOONa+HCN b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3 d.2HCOOH+=2HCOO-+H2O+CO2↑
参考答案
1.C
2.D
3.B
4.A
5.D
6.D
7.C
8.A
9.A
10.A
11. D
12. C
13. C
14. C
15. D
16. A
17.(1)b>a>c (2) c>a=b (3) a=b>c
(4) (5) 测0.1mol/L醋酸溶液的pH pH>1
18.(1)H2CO3H++
(2) ②>①>③
(3) CN- +CO2+H2O=+HCN
(4) ac
(5) ③>②>①
(6)酸式滴定管 当滴加最后一滴溶液时,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内不褪色 0.1700
19.(1)CH3COOH (2) BC
(3) ClO- +CO2+H2O==HClO+ (4)
20.(1)0.008
(2)
(3) H++NH3·H2O=+H2O +=+H2O+CO2↑
(4) 因Ka(CH3COOH)(5) b
一、单选题(共16题)
1.下列方法中,不能使醋酸溶液中 CH3COOH CH3COO- +H+ 电离程度增大的是( )
A.升高温度 B.加水稀释
C.加入少量醋酸钠固体 D.加入少量氢氧化钠固体
2.常温下在下列条件时,可能大量共存的微粒组是( )
化学式 电离常数(25℃)
CH3COOH K1=1.7×10-5
HClO K1=3.0×10-8
H2CO3 K1=4.3×10-7K2=5.6×10-11
A.如表提供的数据下:HClO、HCO、ClO-、CO
B.pH=3的溶液中:CO、Na+、SO、AlO
C.能与Al反应生成H2的溶液:NH、Ca2+、NO、I-
D.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO、S2O
3.氢氰酸()是一种弱酸,在水溶液中存在电离平衡: ,常温下电离常数为。下列说法正确的是( )
A.溶液的 B.增大溶液浓度,其电离程度减小
C.升高溶液温度,平衡逆向移动 D.加入少量溶液,会使增大
4.25℃时,向20 mL 0.2 mol·L 1 H2C2O4溶液中逐滴加入0.2 mol·L 1 NaOH溶液。溶液中H2C2O4、、的物质的量分数变化如图所示。下列有关说法正确的是( )
A.a点对应的溶液中c(Na+)+c(H+)=c(OH-)+3c()
B.由图中数据可计算得曲线H2C2O4与曲线交点的pH=2.6
C.加入20 mL NaOH溶液时,溶液中c(Na+)>c()>c(H2C2O4)>c()
D.H2C2O4的电离方程式为H2C2O4=H++,H++
5.常温下,几种弱电解质的电离平衡常数如表所示,向20mL0.1mol/L的盐酸溶液中逐滴滴加0.1mol/L的氨水,溶液的pH变化曲线如图所示。
弱电解质 K
H2CO3 Ka1=4×10-7 Ka2=4×10-11
NH3·H2O Kb=1.75×10-5
CH3COOH Ka=1.75×10-5
下列说法正确的是( )
A.CH3COONH4溶液中c(OH-)=c(H+)≠l0-7mol/L B.和能发生彻底水解反应
C.曲线上水的电离程度最大的点为b点 D.d点时,c(OH-)-c(H+)=[c()-2c(NH3·H2O)]
6.室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是( )
A.0.1 mol L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
7.时,使用调节溶液过程中,二元弱酸溶液中含微粒的分布分数如图所示。下列叙述中正确的是( )
A.溶液由1升至2.6时主要存在的反应是 B.溶液中
C. D.溶液呈中性时,
8.常温下,在醋酸溶液中加入一定量的醋酸钠固体,下列说法错误的是( )
A.c(OH-)减小 B.醋酸的电离程度减小
C.溶液的pH增大 D.c(Ac-)增大
9.常温下,两种钠盐、溶液的物质的量浓度均为,加水稀释时溶液的与稀释倍数的对数的关系如图所示。下列判断错误的是( )
A.、均为弱酸,且的酸性比的强
B.的、溶液中,前者对水的电离促进作用较大
C.点溶液中存在:
D.随着溶液的稀释,溶液中逐渐减小
10.向某NaAlO2、Na2CO3的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的、、、的物质的量与加入盐酸溶液的体积变化关系如图所示。[已知:H2CO3的电离平衡常数,;Al(OH)3的酸式电离平衡常数; 则下列说法正确的是( )
A.V1:V2=1:4
B.M点时生成CO2为0.05mol
C.原混合溶液中的与的物质的量之比为1:3
D.a曲线表示的离子方程式为
11.下列反应的离子方程式正确的是( )
A.向稀溶液中加入稀盐酸:
B.向、的溶液中加入溶液:
C.向溶液中加入过量的溶液:
D.向溶液中通入少量:
12.已知电离平衡常数大小:H2CO3>HClO>HCO,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,Fe3+、Cl-、Ba2+、Br-、I-能在溶液中大量共存
B.向含有0. 4 mol FeI2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2I- +3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:C1O-+CO2+H2O=HClO+HCO
D.向FeBr2溶液中滴加少量氯水,再加入CCl4振荡,静置,有机层呈橙色
13.某浓度的二元弱酸H2B溶液在不同pH下,测得Pc(M)变化如图所示,(已知: Pc(M)=-1gc(M),M代指H2B或HB-或B2-),下列说法正确的是( )
A.曲线II表示Pc(HB-)与pH关系
B.pH=5时,c(HB- )
D.在pH增大的过程中,c(H2B)、c(HB-)、 c(B2-)三者浓度和先减小后增大
14.锂金属电池的电解液在很大程度上制约着锂电池的发展,某种商业化锂电池的电解质的结构如图所示。已知短周期主族元素X、Y、Z、M和W的原子序数依次增大,且0.1mol/LXW的水溶液呈酸性且,W元素在周期表中非金属性最强,Y元素最外层有3个电子,M元素一般无正价。下列说法正确的是( )
A.最高价含氧酸的酸性: B.氢化物的沸点:
C.W的单质可与M的氢化物发生置换反应 D.分子中各原子最外层都达到8电子稳定结构
15.常温下,有体积相同的四种溶液:①pH=2的CH3COOH溶液;②pH=2的盐酸;③0.01mol/L的醋酸溶液;④0.01mol/L的盐酸。下列说法正确的是( )
A.把四种溶液稀释到相同pH,所需水的体积:①>②=④=③
B.四种溶液中和氢氧化钠的能力:①=②=③=④
C.与镁条反应的起始速率的大小关系为:①>②=④>③
D.与镁条反应生成相同体积的氢气所需的时间为:①<②=④<③
16.最新研究表明,在多孔炭材料,上搭载活性组分催化氧化脱硫效果明显优于传统方法,其反应机理如图所示,此时在水中浓度为0.34g/100mL。下列有关说法正确的是( )
A.温度过高不利于脱硫的效果 B.活性炭作用是降低反应物的总能量
C.该反应的总反应是吸热过程 D.该温度下,的
二、综合题(共4题)
17.在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸(用a、b、c填空):
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__。
(2)若三者pH相同时,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是___。
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是__。
(4)在25℃下,将amol/L的醋酸与0.01mol/L的NaOH溶液等体积混合后溶液的pH=7,用含a的代数式表示25℃时CH3COOH的电离常数Ka=__。
(5)设计一个实验证明醋酸是弱电解质:
操作:__;
现象:__;
结论:醋酸是弱电解质。
18.I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:(单位省略)
醋酸 碳酸 氢氰酸
Ka=1.7×10-5 Ka1=4.2×10-7 Ka2=5.6×10-11 Ka=6.2×10-10
(1)写出碳酸的第一步电离方程式_________。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为(填序号)__________。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为__________。
(4)将浓度为0.02 mol/L的HCN与0.01 mol/LINaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是________。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)
c.c(HCN)+c(CN-)=0.01 mol/L
(5)25℃时,浓度均为0.01 mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为________(填序号)。
II.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学0.1000 mol/L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用________装KMnO4溶液
②滴定到达终点的现象是___________。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 第二次 第三次 第四次
体积(mL) 17.10 18.10 17.00 16.90
则试样中过氧化氢的浓度为________mol/L-1。
19.已知 25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7、Ka2=5.6×10-11 Ka=3.0×10-8
(1)表中三种酸酸性最强的是__________。
(2)常温下,0.1 mol L1 CH3COOH 溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
A.c(H+) B. C. D.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。
(4)25℃时,将a mol L1 醋酸与b mol L1 氢氧化钠等体积混合,反应后溶液恰好显中性,这时钠离子浓度与醋酸根离子浓度相等,用 a、b 表示醋酸的电离平衡常数为__________。
20.(1)25℃时,HF的Ka=6.4×10-4,则此温度下0.1mol·L-1 HF溶液的c(H+)为_____mol·L-1。
(2)25℃时,a mol·L-1 CH3COOH溶液的pH=b,用含a和b的代数式表示CH3COOH的电离平衡常数Ka=___。
(3)硒酸(H2SeO4)在水溶液中的电离如下:H2SeO4=H++, H++SeO,K2=1.0×10-2(25℃)。
①向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为____。
②已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,则KHCO3和KHSeO4两溶液混合反应的离子方程式为____。
(4)已知25℃时,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。现在该温度下将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是____________。
(5)已知25℃时,几种弱酸的电离平衡常数如下:HCOOH:Ka=1.77×10-4,HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,则以下反应不能自发进行的是____(填字母)。
a.HCOOH+NaCN=HCOONa+HCN b.NaHCO3+NaCN=Na2CO3+HCN
c.NaCN+H2O+CO2=HCN+NaHCO3 d.2HCOOH+=2HCOO-+H2O+CO2↑
参考答案
1.C
2.D
3.B
4.A
5.D
6.D
7.C
8.A
9.A
10.A
11. D
12. C
13. C
14. C
15. D
16. A
17.(1)b>a>c (2) c>a=b (3) a=b>c
(4) (5) 测0.1mol/L醋酸溶液的pH pH>1
18.(1)H2CO3H++
(2) ②>①>③
(3) CN- +CO2+H2O=+HCN
(4) ac
(5) ③>②>①
(6)酸式滴定管 当滴加最后一滴溶液时,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内不褪色 0.1700
19.(1)CH3COOH (2) BC
(3) ClO- +CO2+H2O==HClO+ (4)
20.(1)0.008
(2)
(3) H++NH3·H2O=+H2O +=+H2O+CO2↑
(4) 因Ka(CH3COOH)
