3.4.1 难溶电解质的沉淀溶解平衡课后强化习题(word版含答案)
文档属性
| 名称 | 3.4.1 难溶电解质的沉淀溶解平衡课后强化习题(word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 522.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-10 20:58:16 | ||
图片预览



文档简介
第三章第四节第一课时难溶电解质的沉淀溶解平衡课后强化习题
一、单选题(共16题)
1.我省盛产矿盐(主要成分是NaCl,还含有等其他可溶性杂质的离子)。下列有关说法正确的是( )
A.有矿盐生成食盐,除去最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
2.工业上可通过如下流程回收铅蓄电池中的铅,下列有关说法不正确的是( )
A.PbSO4 在水中存在溶解平衡:
B.生成PbCO3的离子方程式为:
C.pH:滤液 < 饱和 Na2CO3 溶液
D.滤液中不存在Pb2+
3.t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时,AgCl的Ksp=4.0×10-10,下列说法正确的是( )
A.a、b、c、d、e五点对应的溶液Ksp(AgBr)不同
B.b点对应的溶液有沉淀生成,溶液由b点到达e点
C.将a点对应的溶液蒸发至饱和,溶液由a点到达d点
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由c点到达b点
4.某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.c点对应的Ksp等于a点对应的Ksp B.加入AgNO3,可以使溶液由c点变到d点
C.d点没有AgCl沉淀生成 D.加入少量水,平衡右移,Cl-浓度减小
5.已知pAg+= lgc(Ag+),pX = lgc(X )。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.Ksp(AgBr)=1.0×10-14 mol2·L-2
B.向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
C.一定温度下,AgCl固体分别在下列溶液①10mL0.01mol·L-1KCl溶液 ②10mL蒸馏水③40mL0.03mol·L-1HCl溶液中的溶解度由大到小的排列顺序是②>①>③
D.常温下,AgCl在纯水中的Ksp比在AgNO3溶液中的Ksp大
6.有关AgCl的沉淀溶解平衡的说法正确的是( )
A.达到沉淀溶解平衡时,AgCl的生成和溶解不再继续进行
B.升高温度,AgCl的溶解度增大
C.AgCl难溶于水,溶液中没有和
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
7.下列图示与对应的叙述相符合的是( )
A.图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B.图乙表示NO2在恒容密闭容器中发生反应:2NO2(g) N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<0
C.图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D.图丁表示分别稀释10 mL pH均为12的NaOH和NH3 H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
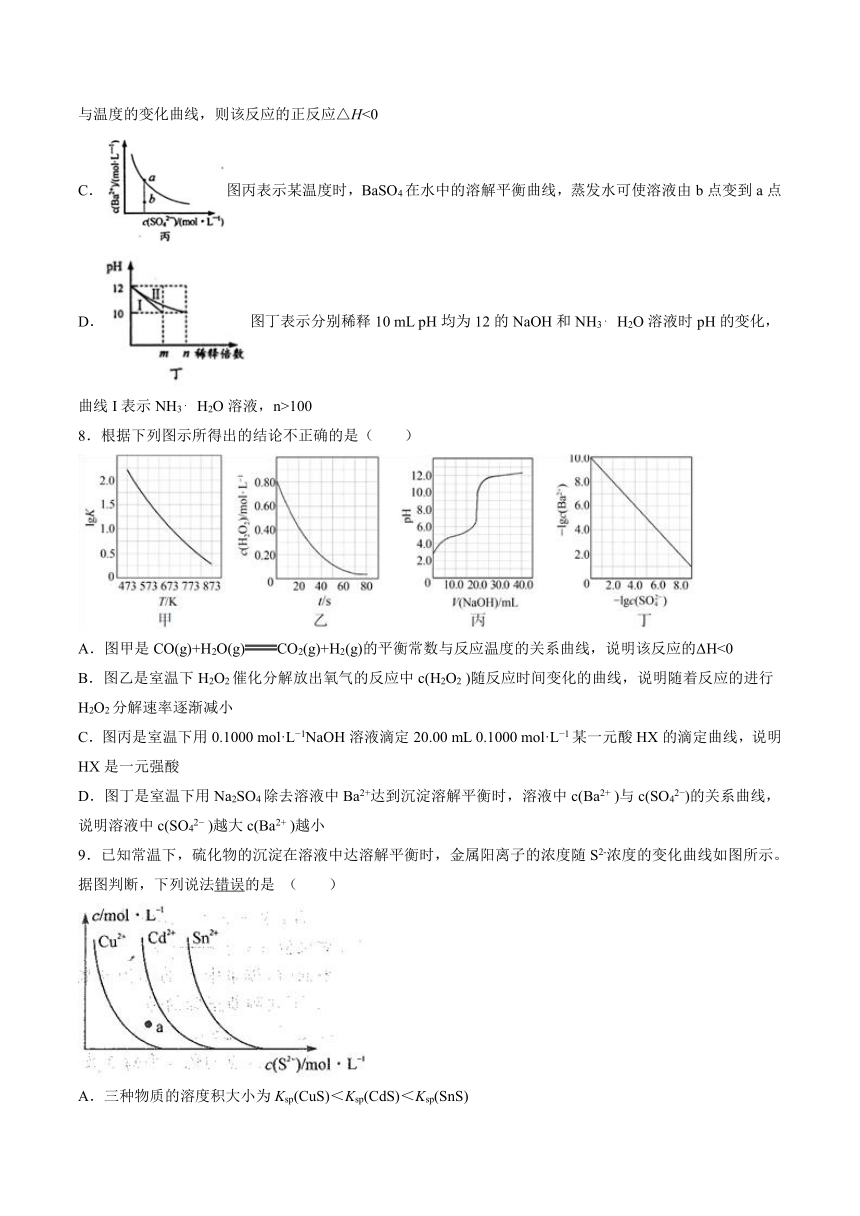
8.根据下列图示所得出的结论不正确的是( )
A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L 1NaOH溶液滴定20.00 mL 0.1000 mol·L 1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42 )的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
9.已知常温下,硫化物的沉淀在溶液中达溶解平衡时,金属阳离子的浓度随S2-浓度的变化曲线如图所示。据图判断,下列说法错误的是 ( )
A.三种物质的溶度积大小为Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS悬浊液中加入少量CuSO4固体,c(Sn2+)会减少
C.a点无CdS沉淀产生
D.向含等物质的量浓度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
10.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
A.加入BaCl2可以使溶液由c点变到a点 B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液 D.该温度下,Ksp(BaSO4)=1.0×10-24
11.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.Ksp(MnCO3)的数量级为10-11
B.MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C.向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D.a点表示的溶液中,c(Ca2+)>c(CO32-)
12.25 ℃时,向0.10 mol·L-1 H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)的关系如图(忽略溶液体积的变化、H2S的挥发)。已知H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,CdS的Ksp=3.6×10-29,一般认为溶液中离子浓度不大于1.0×10-5 mol·L-1时即沉淀完全。下列说法正确的是( )
A.pH=13时,溶液中的溶质为Na2S B.pH=5时,向H2S溶液中通入了少量的HCl
C.pH=7时,溶液中c(H2S)≈0.043 mol·L-1 D.pH=1时,c(S2-)太小,故不能处理含Cd2+的污水
13.某温度下硫酸钡与水组成的混合物中加入少量硫酸钠固体,下列说法错误的是( )
A.BaSO4的电离程度减小 B.BaSO4溶解的量减小
C.c(Ba2+)与c(SO)的乘积不变 D.溶液的导电能力增强
14.大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq) 2HCO (aq),下列说法不正确的是( )
A.T1>T2
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO浓度降低
C.当大气中CO2浓度确定时,海水温度越高,CO 浓度越低
D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
15.某温度下,向体积均为20.00 mL、浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液中分别滴加0.1 mol·L-1的AgNO3溶液,滴定过程中的pX(pX=-lgX,X=Cl-、CrO)与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )
A.a=1 B.曲线I表示NaCl溶液
C.Ksp(Ag2CrO4)=1.0×10-2b D.M约为2c-1.47
16.根据下列图示,相应叙述正确的是( )
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液导电性变化,a点pH值大于b点
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙是稀释相同体积、相同pH的HNO2和CH3COOH稀溶液时,溶液的pH随加水体积的变化,所含溶质的物质的量浓度x点小于y点
D.图丁中,曲线B对应温度下,将0.02mol·L-1Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=12
二、综合题(共4题)
17.工业废水中常含有一定量的和,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法。
该法的工艺流程为:Cr3+ Cr(OH)3↓
其中第①步存在平衡2(黄色)+2H+ (橙色)+H2O。
(1)若平衡体系的pH=2,该溶液显_____色。
(2)能说明第①步反应达平衡状态的是_____(填序号)。
A.和的浓度相同 B.2v()=v() C.溶液的颜色不变
(3)第②步中,还原1mol离子,需要_____mol的FeSO4 7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+) c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
方法2:电解法。
该法用Fe做电极电解含的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为_____(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有_____。
18.实验室由铁泥(主要成分为铁的氧化物,还含有少量和CaO等)制备软磁性材料。其主要实验流程如下:
(1)酸浸:用一定浓度的溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有_______(写出一种方法),酸浸后的滤渣的主要成分是_______、_______。
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使完全转化为。“还原”过程中发生的主要反应的离子方程式为_______﹔检验完全被还原的实验方案为_______。
(3)除杂:向“还原”后的滤液中加入溶液,使转化为沉淀除去。若溶液的酸性较强,将会导致沉淀不完全,其原因是_______(从平衡移动的角度分析,,)。
(4)沉铁:将提纯后的溶液与氨水—混合溶液反应,生成沉淀。生成沉淀的离子方程式为_______。
19.某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH 见下表:
离子 开始沉淀时的pH 完全沉淀时的pH
Fe2+ 7.6 9.7
Fe3+ 2.7 3.7
Al3+ 3.8 4.7
Mn2+ 8.3 9.8
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
20.偏钒酸铵(NH4VO3)在陶瓷工业广泛用做釉料。工业上以钒矿(含有+3、+4、+5价的钒,主要杂质为钾、镁的铝硅酸盐,以及SiO2、Fe3O4等)为原料,制备偏钒酸铵。工艺流程如下:
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀pH 1.9 7.0 3.0 8.1
完全沉淀pH 3.2 9.0 4.7 10.1
回答下列问题:
(1)为加快“酸浸氧化”可采取的措施__________(一条即可)。
(2)“酸浸氧化”中,VO+和VO2+被氧化成,同时还有Fe2+离子被氧化。Fe2+离子被氧化的离子方程式为_________。每1mol VO+被氧化对应消耗MnO2________克。
(3)“中和沉淀”中,钒水解并沉淀为,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,转化为钒酸盐溶解。滤渣③的主要成分是__________。
(5)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。
参考答案
1.D
2.D
3.C
4.A
5.D
6.B
7.B
8.C
9.B
10.A
11.C
12.C
13.A
14.C
15.C
16.C
17.(1) 橙 (2) C (3) 6 (4) 5 (5) Fe-2e-=Fe2+,提供还原剂Fe2+ (6) Fe(OH)3
18.(1) 适当升高酸浸温度或适当增大硫酸的浓度或将铁泥粉碎等
(2)
用试管取少量还原后的溶液,向其中滴加几滴KSCN溶液,若溶液不变为血红色,则完全被还原
(3) 溶液中存在,若溶液酸性较强,浓度较大,导致溶液中浓度减小,上述平衡正向移动,浓度增大,即沉淀不完全
(4) 或
19.(1)SO2 (2) 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3) 4.7~8.3 (4) 过滤 冷却结晶 (5) 0.958
20.(1) 升高温度或者搅拌
(2) 87g
(3) Mn2+ Fe3+、Al3+
(4) Fe(OH)3
(5) 同离子效应,可促进NH4VO3晶体尽可能完全析出
一、单选题(共16题)
1.我省盛产矿盐(主要成分是NaCl,还含有等其他可溶性杂质的离子)。下列有关说法正确的是( )
A.有矿盐生成食盐,除去最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
2.工业上可通过如下流程回收铅蓄电池中的铅,下列有关说法不正确的是( )
A.PbSO4 在水中存在溶解平衡:
B.生成PbCO3的离子方程式为:
C.pH:滤液 < 饱和 Na2CO3 溶液
D.滤液中不存在Pb2+
3.t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时,AgCl的Ksp=4.0×10-10,下列说法正确的是( )
A.a、b、c、d、e五点对应的溶液Ksp(AgBr)不同
B.b点对应的溶液有沉淀生成,溶液由b点到达e点
C.将a点对应的溶液蒸发至饱和,溶液由a点到达d点
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由c点到达b点
4.某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.c点对应的Ksp等于a点对应的Ksp B.加入AgNO3,可以使溶液由c点变到d点
C.d点没有AgCl沉淀生成 D.加入少量水,平衡右移,Cl-浓度减小
5.已知pAg+= lgc(Ag+),pX = lgc(X )。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.Ksp(AgBr)=1.0×10-14 mol2·L-2
B.向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
C.一定温度下,AgCl固体分别在下列溶液①10mL0.01mol·L-1KCl溶液 ②10mL蒸馏水③40mL0.03mol·L-1HCl溶液中的溶解度由大到小的排列顺序是②>①>③
D.常温下,AgCl在纯水中的Ksp比在AgNO3溶液中的Ksp大
6.有关AgCl的沉淀溶解平衡的说法正确的是( )
A.达到沉淀溶解平衡时,AgCl的生成和溶解不再继续进行
B.升高温度,AgCl的溶解度增大
C.AgCl难溶于水,溶液中没有和
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
7.下列图示与对应的叙述相符合的是( )
A.图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B.图乙表示NO2在恒容密闭容器中发生反应:2NO2(g) N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<0
C.图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D.图丁表示分别稀释10 mL pH均为12的NaOH和NH3 H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
8.根据下列图示所得出的结论不正确的是( )
A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L 1NaOH溶液滴定20.00 mL 0.1000 mol·L 1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42 )的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
9.已知常温下,硫化物的沉淀在溶液中达溶解平衡时,金属阳离子的浓度随S2-浓度的变化曲线如图所示。据图判断,下列说法错误的是 ( )
A.三种物质的溶度积大小为Ksp(CuS)<Ksp(CdS)<Ksp(SnS)
B.向SnS悬浊液中加入少量CuSO4固体,c(Sn2+)会减少
C.a点无CdS沉淀产生
D.向含等物质的量浓度的Cu2+、Sn2-的混合液中,滴加Na2S溶液,先析出CuS沉淀
10.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
A.加入BaCl2可以使溶液由c点变到a点 B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液 D.该温度下,Ksp(BaSO4)=1.0×10-24
11.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.Ksp(MnCO3)的数量级为10-11
B.MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C.向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D.a点表示的溶液中,c(Ca2+)>c(CO32-)
12.25 ℃时,向0.10 mol·L-1 H2S溶液中通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)的关系如图(忽略溶液体积的变化、H2S的挥发)。已知H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,CdS的Ksp=3.6×10-29,一般认为溶液中离子浓度不大于1.0×10-5 mol·L-1时即沉淀完全。下列说法正确的是( )
A.pH=13时,溶液中的溶质为Na2S B.pH=5时,向H2S溶液中通入了少量的HCl
C.pH=7时,溶液中c(H2S)≈0.043 mol·L-1 D.pH=1时,c(S2-)太小,故不能处理含Cd2+的污水
13.某温度下硫酸钡与水组成的混合物中加入少量硫酸钠固体,下列说法错误的是( )
A.BaSO4的电离程度减小 B.BaSO4溶解的量减小
C.c(Ba2+)与c(SO)的乘积不变 D.溶液的导电能力增强
14.大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO (aq)+H2O(aq) 2HCO (aq),下列说法不正确的是( )
A.T1>T2
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO浓度降低
C.当大气中CO2浓度确定时,海水温度越高,CO 浓度越低
D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
15.某温度下,向体积均为20.00 mL、浓度均为0.1 mol·L-1的NaCl、Na2CrO4溶液中分别滴加0.1 mol·L-1的AgNO3溶液,滴定过程中的pX(pX=-lgX,X=Cl-、CrO)与滴加AgNO3溶液体积关系如图所示(lg3=0.47)。下列说法错误的是( )
A.a=1 B.曲线I表示NaCl溶液
C.Ksp(Ag2CrO4)=1.0×10-2b D.M约为2c-1.47
16.根据下列图示,相应叙述正确的是( )
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液导电性变化,a点pH值大于b点
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙是稀释相同体积、相同pH的HNO2和CH3COOH稀溶液时,溶液的pH随加水体积的变化,所含溶质的物质的量浓度x点小于y点
D.图丁中,曲线B对应温度下,将0.02mol·L-1Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=12
二、综合题(共4题)
17.工业废水中常含有一定量的和,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法。
该法的工艺流程为:Cr3+ Cr(OH)3↓
其中第①步存在平衡2(黄色)+2H+ (橙色)+H2O。
(1)若平衡体系的pH=2,该溶液显_____色。
(2)能说明第①步反应达平衡状态的是_____(填序号)。
A.和的浓度相同 B.2v()=v() C.溶液的颜色不变
(3)第②步中,还原1mol离子,需要_____mol的FeSO4 7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+) c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
方法2:电解法。
该法用Fe做电极电解含的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为_____(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有_____。
18.实验室由铁泥(主要成分为铁的氧化物,还含有少量和CaO等)制备软磁性材料。其主要实验流程如下:
(1)酸浸:用一定浓度的溶液浸取铁泥中的铁元素。若其他条件不变,实验中能加快铁元素浸出速率的措施有_______(写出一种方法),酸浸后的滤渣的主要成分是_______、_______。
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使完全转化为。“还原”过程中发生的主要反应的离子方程式为_______﹔检验完全被还原的实验方案为_______。
(3)除杂:向“还原”后的滤液中加入溶液,使转化为沉淀除去。若溶液的酸性较强,将会导致沉淀不完全,其原因是_______(从平衡移动的角度分析,,)。
(4)沉铁:将提纯后的溶液与氨水—混合溶液反应,生成沉淀。生成沉淀的离子方程式为_______。
19.某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH 见下表:
离子 开始沉淀时的pH 完全沉淀时的pH
Fe2+ 7.6 9.7
Fe3+ 2.7 3.7
Al3+ 3.8 4.7
Mn2+ 8.3 9.8
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
20.偏钒酸铵(NH4VO3)在陶瓷工业广泛用做釉料。工业上以钒矿(含有+3、+4、+5价的钒,主要杂质为钾、镁的铝硅酸盐,以及SiO2、Fe3O4等)为原料,制备偏钒酸铵。工艺流程如下:
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Fe3+ Fe2+ Al3+ Mn2+
开始沉淀pH 1.9 7.0 3.0 8.1
完全沉淀pH 3.2 9.0 4.7 10.1
回答下列问题:
(1)为加快“酸浸氧化”可采取的措施__________(一条即可)。
(2)“酸浸氧化”中,VO+和VO2+被氧化成,同时还有Fe2+离子被氧化。Fe2+离子被氧化的离子方程式为_________。每1mol VO+被氧化对应消耗MnO2________克。
(3)“中和沉淀”中,钒水解并沉淀为,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,转化为钒酸盐溶解。滤渣③的主要成分是__________。
(5)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。
参考答案
1.D
2.D
3.C
4.A
5.D
6.B
7.B
8.C
9.B
10.A
11.C
12.C
13.A
14.C
15.C
16.C
17.(1) 橙 (2) C (3) 6 (4) 5 (5) Fe-2e-=Fe2+,提供还原剂Fe2+ (6) Fe(OH)3
18.(1) 适当升高酸浸温度或适当增大硫酸的浓度或将铁泥粉碎等
(2)
用试管取少量还原后的溶液,向其中滴加几滴KSCN溶液,若溶液不变为血红色,则完全被还原
(3) 溶液中存在,若溶液酸性较强,浓度较大,导致溶液中浓度减小,上述平衡正向移动,浓度增大,即沉淀不完全
(4) 或
19.(1)SO2 (2) 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3) 4.7~8.3 (4) 过滤 冷却结晶 (5) 0.958
20.(1) 升高温度或者搅拌
(2) 87g
(3) Mn2+ Fe3+、Al3+
(4) Fe(OH)3
(5) 同离子效应,可促进NH4VO3晶体尽可能完全析出
