3.4.2 沉淀的生成课后强化习题(word版含答案)
文档属性
| 名称 | 3.4.2 沉淀的生成课后强化习题(word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 551.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-10 00:00:00 | ||
图片预览




文档简介
第三章第四节第二课时沉淀的生成课后强化习题
一、单选题(共18题)
1.下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知的,则所有含有固体MgCO3的溶液中,都有,且
C.可通过比较和的Ksp的大小比较它们的溶解性
D.25 ℃时,故新生成的 AgCl可转化为AgI
2.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
3.有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度不变 D.向AgCl沉淀中加入NaCl固体,AgCl的沉淀溶解平衡不移动
4.下列说法不正确的是( )
A.泡沫灭火器的使用是利用了盐类水解的原理
B.沈括《梦溪笔谈》记载:“石穴中水,所滴者皆为钟乳”,此过程涉及沉淀溶解平衡
C.葛洪所记 “青蒿一握,以水二升渍,绞取汁”,所述对青蒿素的提取属于化学变化
D.《本草经集注》记载的区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,利用了焰色反应
5.已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14, 三种盐的沉淀溶解平衡曲线如图所示,pM= -lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )
A.a线是CaSO4沉定溶解平衡曲线
B.T℃时,向10mL 水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
C.d点表示CaCO3的饱和溶液。且c(Ca2+)D.T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
6.硫化镉(CdS)是一种难溶于水的黄色颜料,其溶解为吸热过程,在水中的沉淀溶解平衡曲线如图。下列说法错误的是( )
A.图中T1B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)=Ksp(p)
C.温度降低时,q点的饱和溶液会有固体析出
D.向P点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动
7.要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 PbSO4 PbCO3 PbS
溶解度/g 1.03×10-4 1.81×10-7 1.84×10-14
由上述数据可知,选用的沉淀剂最好为( )
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
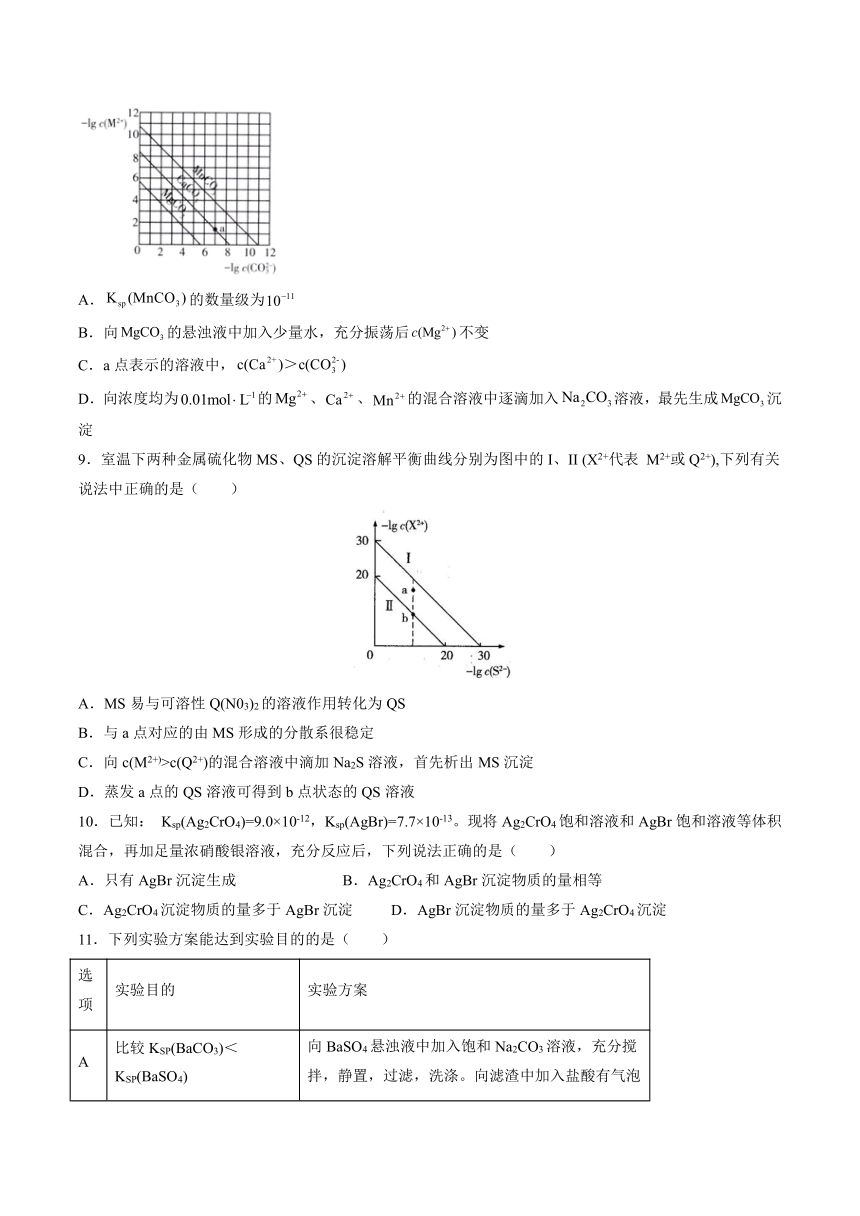
8.一定温度下,三种碳酸盐(M:、、)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.的数量级为
B.向的悬浊液中加入少量水,充分振荡后不变
C.a点表示的溶液中,
D.向浓度均为的、、的混合溶液中逐滴加入溶液,最先生成沉淀
9.室温下两种金属硫化物MS、QS的沉淀溶解平衡曲线分别为图中的I、II (X2+代表 M2+或Q2+),下列有关说法中正确的是( )
A.MS易与可溶性Q(N03)2的溶液作用转化为QS
B.与a点对应的由MS形成的分散系很稳定
C.向c(M2+)>c(Q2+)的混合溶液中滴加Na2S溶液,首先析出MS沉淀
D.蒸发a点的QS溶液可得到b点状态的QS溶液
10.已知: Ksp(Ag2CrO4)=9.0×10-12,Ksp(AgBr)=7.7×10-13。现将Ag2CrO4饱和溶液和AgBr饱和溶液等体积混合,再加足量浓硝酸银溶液,充分反应后,下列说法正确的是( )
A.只有AgBr沉淀生成 B.Ag2CrO4和AgBr沉淀物质的量相等
C.Ag2CrO4沉淀物质的量多于AgBr沉淀 D.AgBr沉淀物质的量多于Ag2CrO4沉淀
11.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 比较KSP(BaCO3)<KSP(BaSO4) 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生
B 配制480mL0.2mol·L-1CuSO4溶液 将24gCuSO4·5H2O溶于蒸馏水配成500mL溶液
C 比较非金属性强弱:C1>C 向一定浓度的NaHCO3溶液中滴加稀盐酸,将产生的气体通入澄清石灰水
D 验证Na2SO3是否变质 向NaSO3溶液中滴入足量盐酸至不再产生气体,然后滴入BaCl2溶液
A.A B.B C.C D.D
12.室温时,下列各溶液的叙述中正确的是( )
A.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B.向 0.1mol/L NaHSO3 溶液中通入 NH3 至 pH=7 的溶液:c(Na+)>c(SO32-)>c(NH4+)
C.0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b
D.CO2通入KOH溶液,当由水电离的 c(H+)=10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-)
13.某酸性化工废水中含有Ag+、Pb2+等重金属离子。有关数据如下:
在废水排放之前,用沉淀法除去这两种离子,应该加入的试剂是( )
A.氢氧化钠 B.硫化钠 C.碘化钾 D.氢氧化钙
14.下列有关说法正确的是( )
A.反应室温下不能自发进行,则该反应的
B.配制硫酸亚铁溶液时,需将先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
C.溶液加蒸馏水稀释,的水解程度增大,溶液的pH减小
D.在硫酸钡悬浊液中加入足量饱和溶液处理,向所得沉淀中加入盐酸有气体产生,说明
15.常温下,Fe(OH)3、Cu(OH)2分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示,下列说法正确的是( )
A.在pH=4的两种饱和溶液中,c(Cu2+)∶c(Fe3+)=1010-a∶1
B.向含有c(Fe3+)=c(Cu2+)的混合溶液中加入NaOH溶液时首先析出蓝色沉淀
C.W点时Fe(OH)3、Cu(OH)2形成的分散系均不稳定
D.向Fe(OH)3饱和溶液中加入适量水时,溶液状态可由点Y转化为点X
16.下表是3种物质的溶解度,下列说法中正确的是( )
物质
溶解度 74 84
A.已知的 ,则所有含有固体的溶液中,都有,且
B.除去粗盐中含有的杂质,最佳除杂试剂为溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有和的硬水,发生的离子反应方程式为
17.时,用 沉淀、两种金属阳离子,所需最低浓度的对数值与的关系如图所示.下列说法不正确的是( )
A. 溶液中:
B.时,约为
C.向100 mL 、浓度均为 的混合溶液中逐滴加入 的 溶液,先沉淀
D.向浓度为 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出
二、综合题(共4题)
19.已知:在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。
②向滤液中通入Cl2,搅拌。
③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。
④把③所得滤液浓缩。
(1)①中加热并搅拌的目的是_____________________________。
(2)②中发生反应的离子方程式是_________________________。
(3)③中的物质A可能是__________________;调整的PH范围是_______________;
过滤后滤渣的成分是__________________。
(4)③中发生反应的离子方程式是_________________________。
(5)①③中如何用pH试纸测定溶液的pH值:_________________________。
20.已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:(aq)+Ca(OH)2(s)CaWO4(s)+2OH-(aq)
(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。
①计算T1时,Ksp(CaWO4)=________。
②T1________T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表:
温度/℃ 25 50 90 100
K 79.96 208.06 222.88 258.05
①该反应平衡常数K的表达式为________。
②该反应的ΔH________0(“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后的沉淀率为60%,此时的平衡浓度为________mol·L-1,实验测得的平衡常数为________(保留小数点后两位)。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是________。
21.含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
已知:CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积常数如下表所示。
物质 CaSO4 CaCrO4 BaCrO4 BaSO4
溶度积 9.1×10-6 2.30×10-2 1.17×10-10 1.08×10-10
(1)用离子方程式表示K2Cr2O7溶液中同时存在K2CrO4的原因(将离子方程式补充完整):
+__________=+__________。____________
(2)向滤液1中加入BaCl2·2H2O的目的,是使从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:__________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由:__________。
③研究温度对沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下的沉淀率,如下图所示。
已知:BaCrO4(s) Ba2+(aq)+ ΔH>0
的沉淀效率随温度变化的原因是__________。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图所示。结合化学平衡移动原理,解释使用0.450mol/L的硫酸时,重铬酸的回收率明显高于使用0.225mol/L的硫酸的原因:__________。
②回收重铬酸的原理如图所示。当硫酸浓度高于0.450mol/L时,重铬酸的回收率没有明显变化,其原因是__________。
(4)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与__________有关。
22.随原子序数的递增,九种短周期元素用字母表示原子半径的相对大小、最高正价或最低负价的变化如图所示.
请回答下列问题;
、d、e、f四种元素的简单离子中,半径最大的离子是 ______ 填离子符号
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
含f元素的两种离子在溶液中不能大量共存的原因是 ______ 用离子方程式表示
关于图乙所示转化关系代表卤素,下列说法错误的是 ______ 。
A.
B.
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 氟单质与水反应制氧气
,f的最高价氧化物的水化物的,使含的离子的溶液开始产生沉淀的pH为 ______ 。
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
参考答案
1.D
2.C
3.A
4.C
5.C
6.D
7.A
8.D
9.C
10.C
11.D
12.B
13.B
14.C
15.A
16.C
17.A
18.D
19.(1) 加快反应速率,是反应充分 (2) 2Fe2++Cl2=2Fe3++2Cl-
(3) CuO 4-5 Fe(OH)3
(4) CuO+2H+=Cu2++H2O
(5) 取一小块pH试纸,放在玻璃片上,用玻璃棒蘸取待测液,点在pH试纸中央,待变色后与标准比色卡相比。
20.(1) 1×10-10 < (2) K= > 0.2 6.05
(3) 加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高的沉淀率。
21.(1) 1 H2O 2 2 H+
(2) 沉淀;调节溶液pH,使转化为而沉淀
BaCrO4比CaCrO4更难溶,可以使沉淀更完全 温度升高,沉淀速率加快
(3) c(H2SO4)增大,则c()增大,与Ba2+生成沉淀,促进BaCrO4(s)Ba2+(aq)+(aq)ΔH>0平衡右移,c()增大;同时,c(H+)也增大,共同促进+H2O+2H+平衡左移,有利于生成更多的H2Cr2O7
BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其难于接触H2SO4,阻碍重铬酸生成
(4) 受到溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等影响
22.(1) (2)
(3) (4) C
(5) D (6) 3
(7)
一、单选题(共18题)
1.下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知的,则所有含有固体MgCO3的溶液中,都有,且
C.可通过比较和的Ksp的大小比较它们的溶解性
D.25 ℃时,故新生成的 AgCl可转化为AgI
2.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
3.有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度不变 D.向AgCl沉淀中加入NaCl固体,AgCl的沉淀溶解平衡不移动
4.下列说法不正确的是( )
A.泡沫灭火器的使用是利用了盐类水解的原理
B.沈括《梦溪笔谈》记载:“石穴中水,所滴者皆为钟乳”,此过程涉及沉淀溶解平衡
C.葛洪所记 “青蒿一握,以水二升渍,绞取汁”,所述对青蒿素的提取属于化学变化
D.《本草经集注》记载的区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,利用了焰色反应
5.已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14, 三种盐的沉淀溶解平衡曲线如图所示,pM= -lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是( )
A.a线是CaSO4沉定溶解平衡曲线
B.T℃时,向10mL 水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
C.d点表示CaCO3的饱和溶液。且c(Ca2+)
6.硫化镉(CdS)是一种难溶于水的黄色颜料,其溶解为吸热过程,在水中的沉淀溶解平衡曲线如图。下列说法错误的是( )
A.图中T1
C.温度降低时,q点的饱和溶液会有固体析出
D.向P点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动
7.要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 PbSO4 PbCO3 PbS
溶解度/g 1.03×10-4 1.81×10-7 1.84×10-14
由上述数据可知,选用的沉淀剂最好为( )
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
8.一定温度下,三种碳酸盐(M:、、)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.的数量级为
B.向的悬浊液中加入少量水,充分振荡后不变
C.a点表示的溶液中,
D.向浓度均为的、、的混合溶液中逐滴加入溶液,最先生成沉淀
9.室温下两种金属硫化物MS、QS的沉淀溶解平衡曲线分别为图中的I、II (X2+代表 M2+或Q2+),下列有关说法中正确的是( )
A.MS易与可溶性Q(N03)2的溶液作用转化为QS
B.与a点对应的由MS形成的分散系很稳定
C.向c(M2+)>c(Q2+)的混合溶液中滴加Na2S溶液,首先析出MS沉淀
D.蒸发a点的QS溶液可得到b点状态的QS溶液
10.已知: Ksp(Ag2CrO4)=9.0×10-12,Ksp(AgBr)=7.7×10-13。现将Ag2CrO4饱和溶液和AgBr饱和溶液等体积混合,再加足量浓硝酸银溶液,充分反应后,下列说法正确的是( )
A.只有AgBr沉淀生成 B.Ag2CrO4和AgBr沉淀物质的量相等
C.Ag2CrO4沉淀物质的量多于AgBr沉淀 D.AgBr沉淀物质的量多于Ag2CrO4沉淀
11.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 比较KSP(BaCO3)<KSP(BaSO4) 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生
B 配制480mL0.2mol·L-1CuSO4溶液 将24gCuSO4·5H2O溶于蒸馏水配成500mL溶液
C 比较非金属性强弱:C1>C 向一定浓度的NaHCO3溶液中滴加稀盐酸,将产生的气体通入澄清石灰水
D 验证Na2SO3是否变质 向NaSO3溶液中滴入足量盐酸至不再产生气体,然后滴入BaCl2溶液
A.A B.B C.C D.D
12.室温时,下列各溶液的叙述中正确的是( )
A.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B.向 0.1mol/L NaHSO3 溶液中通入 NH3 至 pH=7 的溶液:c(Na+)>c(SO32-)>c(NH4+)
C.0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b
D.CO2通入KOH溶液,当由水电离的 c(H+)=10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-)
13.某酸性化工废水中含有Ag+、Pb2+等重金属离子。有关数据如下:
在废水排放之前,用沉淀法除去这两种离子,应该加入的试剂是( )
A.氢氧化钠 B.硫化钠 C.碘化钾 D.氢氧化钙
14.下列有关说法正确的是( )
A.反应室温下不能自发进行,则该反应的
B.配制硫酸亚铁溶液时,需将先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
C.溶液加蒸馏水稀释,的水解程度增大,溶液的pH减小
D.在硫酸钡悬浊液中加入足量饱和溶液处理,向所得沉淀中加入盐酸有气体产生,说明
15.常温下,Fe(OH)3、Cu(OH)2分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示,下列说法正确的是( )
A.在pH=4的两种饱和溶液中,c(Cu2+)∶c(Fe3+)=1010-a∶1
B.向含有c(Fe3+)=c(Cu2+)的混合溶液中加入NaOH溶液时首先析出蓝色沉淀
C.W点时Fe(OH)3、Cu(OH)2形成的分散系均不稳定
D.向Fe(OH)3饱和溶液中加入适量水时,溶液状态可由点Y转化为点X
16.下表是3种物质的溶解度,下列说法中正确的是( )
物质
溶解度 74 84
A.已知的 ,则所有含有固体的溶液中,都有,且
B.除去粗盐中含有的杂质,最佳除杂试剂为溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有和的硬水,发生的离子反应方程式为
17.时,用 沉淀、两种金属阳离子,所需最低浓度的对数值与的关系如图所示.下列说法不正确的是( )
A. 溶液中:
B.时,约为
C.向100 mL 、浓度均为 的混合溶液中逐滴加入 的 溶液,先沉淀
D.向浓度为 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出
二、综合题(共4题)
19.已知:在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。
②向滤液中通入Cl2,搅拌。
③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。
④把③所得滤液浓缩。
(1)①中加热并搅拌的目的是_____________________________。
(2)②中发生反应的离子方程式是_________________________。
(3)③中的物质A可能是__________________;调整的PH范围是_______________;
过滤后滤渣的成分是__________________。
(4)③中发生反应的离子方程式是_________________________。
(5)①③中如何用pH试纸测定溶液的pH值:_________________________。
20.已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:(aq)+Ca(OH)2(s)CaWO4(s)+2OH-(aq)
(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。
①计算T1时,Ksp(CaWO4)=________。
②T1________T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表:
温度/℃ 25 50 90 100
K 79.96 208.06 222.88 258.05
①该反应平衡常数K的表达式为________。
②该反应的ΔH________0(“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后的沉淀率为60%,此时的平衡浓度为________mol·L-1,实验测得的平衡常数为________(保留小数点后两位)。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是________。
21.含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
已知:CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积常数如下表所示。
物质 CaSO4 CaCrO4 BaCrO4 BaSO4
溶度积 9.1×10-6 2.30×10-2 1.17×10-10 1.08×10-10
(1)用离子方程式表示K2Cr2O7溶液中同时存在K2CrO4的原因(将离子方程式补充完整):
+__________=+__________。____________
(2)向滤液1中加入BaCl2·2H2O的目的,是使从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:__________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由:__________。
③研究温度对沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下的沉淀率,如下图所示。
已知:BaCrO4(s) Ba2+(aq)+ ΔH>0
的沉淀效率随温度变化的原因是__________。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图所示。结合化学平衡移动原理,解释使用0.450mol/L的硫酸时,重铬酸的回收率明显高于使用0.225mol/L的硫酸的原因:__________。
②回收重铬酸的原理如图所示。当硫酸浓度高于0.450mol/L时,重铬酸的回收率没有明显变化,其原因是__________。
(4)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与__________有关。
22.随原子序数的递增,九种短周期元素用字母表示原子半径的相对大小、最高正价或最低负价的变化如图所示.
请回答下列问题;
、d、e、f四种元素的简单离子中,半径最大的离子是 ______ 填离子符号
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
含f元素的两种离子在溶液中不能大量共存的原因是 ______ 用离子方程式表示
关于图乙所示转化关系代表卤素,下列说法错误的是 ______ 。
A.
B.
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 氟单质与水反应制氧气
,f的最高价氧化物的水化物的,使含的离子的溶液开始产生沉淀的pH为 ______ 。
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
参考答案
1.D
2.C
3.A
4.C
5.C
6.D
7.A
8.D
9.C
10.C
11.D
12.B
13.B
14.C
15.A
16.C
17.A
18.D
19.(1) 加快反应速率,是反应充分 (2) 2Fe2++Cl2=2Fe3++2Cl-
(3) CuO 4-5 Fe(OH)3
(4) CuO+2H+=Cu2++H2O
(5) 取一小块pH试纸,放在玻璃片上,用玻璃棒蘸取待测液,点在pH试纸中央,待变色后与标准比色卡相比。
20.(1) 1×10-10 < (2) K= > 0.2 6.05
(3) 加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高的沉淀率。
21.(1) 1 H2O 2 2 H+
(2) 沉淀;调节溶液pH,使转化为而沉淀
BaCrO4比CaCrO4更难溶,可以使沉淀更完全 温度升高,沉淀速率加快
(3) c(H2SO4)增大,则c()增大,与Ba2+生成沉淀,促进BaCrO4(s)Ba2+(aq)+(aq)ΔH>0平衡右移,c()增大;同时,c(H+)也增大,共同促进+H2O+2H+平衡左移,有利于生成更多的H2Cr2O7
BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使其难于接触H2SO4,阻碍重铬酸生成
(4) 受到溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等影响
22.(1) (2)
(3) (4) C
(5) D (6) 3
(7)
