3.4.4 沉淀的转化课后强化习题(word版含答案)
文档属性
| 名称 | 3.4.4 沉淀的转化课后强化习题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 289.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-10 21:08:09 | ||
图片预览




文档简介
第三章第四节第四课时沉淀的转化课后强化习题
一、单选题(共16题)
1.对下列实验现象或操作解释错误的是( )
现象或操作 解释
A 向盛有溶液的试管中加入几滴酸化的硫酸亚铁溶液,溶液变成棕黄色,一段时间后溶液中出现气泡。 被氧化成,催化分解产生
B 向两支盛有溶液的试管中,分别滴加淀粉溶液和溶液(均不与反应),前者溶液变蓝,后者有黄色沉淀。 溶液中存在平衡:
C 在一块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置,溶液边缘出现红色。 铁片上发生吸氧腐蚀
D 向含有和的悬浊液中滴加溶液,生成黑色沉淀。
A.A B.B C.C D.D
2.轻质碳酸钙广泛用于橡胶、塑料、油漆等行业。以石灰石(主要成分CaCO3,含有少量SiO2、MgO等)为原料制备轻质碳酸钙的一种流程如图所示。下列说法错误的是( )
A.“煅烧”时生成 CaSiO3的化学方程式为
B.“溶浸”生成的气体可用于“调pH”
C.相同温度下,Ksp[Mg(OH)2]>Ksp[Ca(OH)2]
D.“转化”时通入CO2过多会降低产品产率
3.下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 实验操作 实验目的或结论
A 向某黄色溶液中加入淀粉KI溶液,溶液变蓝 该溶液中含有Br2
B 将混有Ca(OH)2杂质的Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀 除去Mg(OH)2样品中的Ca(OH)2杂质
C 向盛有1mL0.1mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成再滴加 0.1mol/L NaI溶液,产生黄色沉淀。 常温下,Ksp(AgCl)>Ksp(AgI)
D 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 HSO3-结合H+的能力比SO32-的强
A.A B.B C.C D.D
4.下列实验中,实验现象与结论均匹配的是( )
选项 实验操作 实验现象 结论
A 取5 mL 0.1mol·L-1 KI溶液于试管中,加入1 mL 0.1 mol·L-1FeCl3溶液,充分反应后萃取分液,向水层滴KSCN溶液 溶液变血红色 KI与FeCl3的反应有一定限度
B 向酸性KMnO4溶液中滴加H2O2溶液 紫色褪去并产生气泡 H2O2具有氧化性
C 取等浓度等体积的Na2S、NaCl溶液于试管中,分别滴入几滴酚酞 Na2S溶液变红、NaCl溶液无色 非金属性:Cl>S
D 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl2溶液 先产生白色沉淀,后生成红褐色沉淀 证明KspMg(OH)2]>Ksp[Fe(OH)3]
A.A B.B C.C D.D
5.下列关于难溶电解质溶液说法正确的是( )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol·L-1盐酸、③0.1mol·L-1氯化镁溶液、④0.1mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:AgCl+S2-=Ag2S↓+Cl-
D.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
6.20℃时其些物质的溶解度数据如下表所示:
物质 CaCO3 CaSO4 Mg(OH)2 MgCO3
溶解度/(g/100g水) 1.4×10-3 0.21 9×10-4 1.1×10-2
下列说法不正确的是( )
A.碳酸镁悬冲液中在在沉淀溶解平衡:MgCO3(s)Mg2+(ag)+ (aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向盛有1 mL 0.1 mol/L的NaOH溶液的试管中滴加1~2滴(1 mL约20滴)2 mol/LMgCl2溶液,再滴加几滴0.1 mol/L的FeCl3溶液,先有白色沉淀生成,后沉淀又转化为红褐色,说明此温度下:Ksp[Fe(OH) 3]<Ksp[Mg(OH)2]
D.向2 mL饱和 MgCl2溶液中先后滴加0.1 mol/L的Na2CO3、NaOH溶液各2滴(1 mL约20滴),产生的白色沉淀为Mg(OH)2和MgCO3
7.根据下列实验操作和现象所得到的结论正确的是( )
选项 操作和现象 结论
A 室温下,物质的量浓度相同的Na2CO3溶液和NaCN溶液,Na2CO3溶液的pH大于NaCN溶液 酸性:HCN>H2CO3
B 用KI的浓溶液浸泡AgCl沉淀,有黄色沉淀生成 Ksp(AgCl)>Ksp(AgI)
C 室温下,将pH相同的HA与HB的稀溶液分别加水稀释相同的倍数,所得溶液的pH:pH(HA)>pH(HB) 酸性:HA>HB
D 将0.1mol·L-1 FeCl3溶液与0.2mol·L-1 KI溶液等体积混合,振荡,再加入2mL CCl4,振荡,静置后下层为紫红色 I-和Fe3+反应有一定的限度
A.A B.B C.C D.D
8.化学是以实验为基础的学科,有关下列实验操作中,现象、结论合理的是( )
选项 实验操作 现象 结论
A 用结净干燥的玻璃棒蘸取浓硫酸点在干燥的pH试纸上 试纸变黑 体现浓硫酸的吸水性
B 将乙醇和浓硫酸混合溶液加热至170℃,将产生的气体通人溴水中 溴水褪色 有乙烯生成
C 某无色溶液滴加盐酸,产生无色气体通入澄清石灰水中 石灰水先变浑浊后变澄清 无色溶液中一定含有CO
D 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/L ZnSO4溶液,再滴2滴0.1mol/L CuSO4溶液 先生成白色沉淀,后生成黑色沉淀 Ksp(ZnS)与Ksp(CuS)大小无法判定
A.A B.B C.C D.D
9.25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
B.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
C.BaSO4和BaCO3共存的悬浊液中,
D.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
A.采用加热方法消毒的目的是使蛋白质变性而杀灭细菌
B.石油分馏可得到石油气、汽油、煤油、柴油等
C.“海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化
D.已知 所以工业上用制取时,用MnS除去溶液中含有的离子
11.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结 论
A 向20mL0.2mol·L-1硝酸银溶液中滴加5滴0.2mol·L-1氯化钠溶液出现白色沉淀,再在浊液中滴加几滴0.2mol·L-1碘化钾溶液出现黄色沉淀 不能证明碘化银比氯化银难溶
B 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH 酸性:HA>H2CO3
C 将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红 熔融物中不含有正三价铁
D 向2支均盛有2mL1.0mol·L-1KOH溶液的试管中分别加入2滴浓度均为0.1mol·L-1的AlCl3和MgCl2溶液,一支试管出现白色沉淀,另一支无明显现象 Ksp[Al(OH)3]>Ksp[Mg(OH)2]
A.A B.B C.C D.D
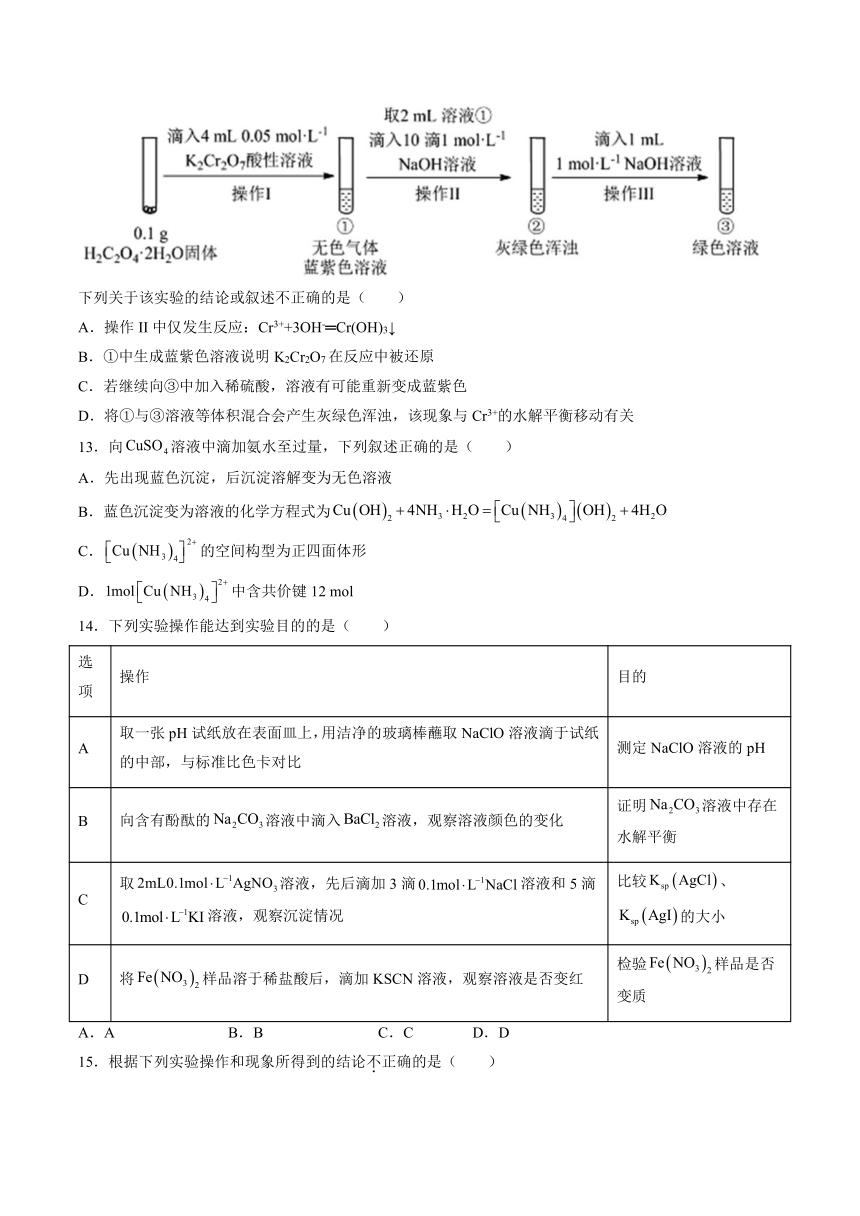
12.实验小组进行如下实验:已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是( )
A.操作II中仅发生反应:Cr3++3OH-═Cr(OH)3↓
B.①中生成蓝紫色溶液说明K2Cr2O7在反应中被还原
C.若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
D.将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
13.向溶液中滴加氨水至过量,下列叙述正确的是( )
A.先出现蓝色沉淀,后沉淀溶解变为无色溶液
B.蓝色沉淀变为溶液的化学方程式为
C.的空间构型为正四面体形
D.中含共价键12 mol
14.下列实验操作能达到实验目的的是( )
选项 操作 目的
A 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 测定NaClO溶液的pH
B 向含有酚酞的溶液中滴入溶液,观察溶液颜色的变化 证明溶液中存在水解平衡
C 取溶液,先后滴加3滴溶液和5滴溶液,观察沉淀情况 比较、的大小
D 将样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 检验样品是否变质
A.A B.B C.C D.D
15.根据下列实验操作和现象所得到的结论不正确的是( )
选项 实验操作和现象 实验结论
A 向AgNO3溶液中加入过量的0.1mol L-1的NaCl溶液,产生白色沉淀。再滴加几滴NaBr溶液,出现浅黄色沉淀 Ksp(AgBr)B 向a、b两试管中均加入4mL0.01mol L-1KMnO4溶液和2mL0.01mol L-1H2C2O4溶液。再向a试管内加入少量MnSO4固体,a中溶液褪色较快 MnSO4可能是KMnO4和H2C2O4溶反应的催化剂
C 向饱和NaHCO3溶液中滴加饱和CaCl2溶液,先有白色沉淀产生,后放出无色气泡 Ca2+与CO结合促进HCO的电离,溶液中H+浓度增大,与HCO反应产生CO2
D 向滴加有酚酞的氨水中加入蒸馏水,溶液的红色变浅 溶液中c(H+)、c(OH-)浓度均减小
A.A B.B C.C D.D
16.通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是( )
A.滴定选用的指示剂为甲基橙 B.本次实验测得Cl元素的质量分数为%
C.硝基苯的作用为防止沉淀被氧化 D.若取消步骤Ⅲ,测定结果偏大
二、综合题(共4题)
17.硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)Na2S溶液中,水的电离程度会______(填“增大”“减小”或“不变”);微热该溶液,pH会_____(填“增大”“减小”或“不变”)。
(2)Na2S溶液中各离子浓度由大到小的顺序为:_____________________________。
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:_____Na2S+_____Na2SO3+_____H2SO4→_____Na2SO4+_____S+_____H2O
(4)配平上述化学方程式,标出电子转移的方向和数目__________。反应中被氧化的元素是____________。
(5)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:________________________________________________________________________。
18.(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________(填下面的选项),加入该氧化剂时,温度不能太高,原因是_________。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________(FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×10 38,Ksp[Cu(OH)2]=3.0×10 20,通常认为残留在溶液中的离子浓度小于1×10 5mol L 1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol L 1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________。
19.硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
离子 Pb2- Ca2+ Fe3+ Mn2+
处理前浓度/(mg·L-1) 0.100 29.8 0.12 0.087
处理后浓度/(mg·L-1) 0.004 22.6 0.04 0.053
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
20.以银精矿(主要成分为Ag2S)为原料采用“预氧化湿法提银”工艺流程如下:
(1) N2H4中氮原子的杂化方式为___,N原子核外有____种不同的运动状态的电子。
(2)“分离转化”时,加入KClO3的目的是___;若不加KClO3,直接加氯化物,依据反应Ag2S+2Cl- 2AgCl+S2-,____(填“能、不能”)实现其较完全转化,并说明理由:___(已知:Ksp(Ag2S)=1.6×10-49,Ksp(AgCl)=2.0×10-10)。为提高Ag2S的转化率可采取的措施是_____(列举2条)。
(3)“浸银”时,发生反应的离子方程式为____。
(4)“还原”时,2[Ag(SO3)2]3-+N2H4+2OH-=2Ag↓+4SO+N2↑+H2↑+2H2O,该反应中每有1mol N-H断裂时,该反应转移电子的物质的量为____mol。
参考答案
1.D
2.C
3.B
4.A
5.D
6.C
7.B
8.D
9.B
10.C
11.A
12.A
13.B
14.B
15.D
16.B
17.(1) 增大 增大
(2) c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(3) (4) -2价的硫元素
(5) 难溶的 FeS 加入水中存在着溶解平衡: FeSFe2++S2-, S2-与 Cu2+结合生成 CuS 沉淀, S2-浓度减小,平衡向右移动, FeS 沉淀逐渐转化为CuS 沉淀。
18.(1) B H2O2受热时会分解 ABD 否 (2) 3.3~4
(3) Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq)
19.(1)PbS+2Fe3++2Cl-= PbCl2+2Fe2++S 抑制Fe3+、Pb2+的水解
(2) 用冰水浴使反应PbCl2(s)+2Cl-(aq)PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出
(3) 盐酸和氯化铁
(4) Pb(OH) 3 +OH = Pb(OH) 42
加入试剂,Pb2+的浓度转化率为(0.1 0.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.12 0.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好
20.(1) sp3 7
(2) 将Ag2S转化为AgCl和S 不能 该反应的平衡常数极小(K=4×10-30),几乎不能转化
适当延长浸取时间;减小银精矿粒直径;适当升高浸出时的温度等
(3) AgCl+2 SO=[Ag(SO3)2]3-+Cl-
(4) 1
一、单选题(共16题)
1.对下列实验现象或操作解释错误的是( )
现象或操作 解释
A 向盛有溶液的试管中加入几滴酸化的硫酸亚铁溶液,溶液变成棕黄色,一段时间后溶液中出现气泡。 被氧化成,催化分解产生
B 向两支盛有溶液的试管中,分别滴加淀粉溶液和溶液(均不与反应),前者溶液变蓝,后者有黄色沉淀。 溶液中存在平衡:
C 在一块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置,溶液边缘出现红色。 铁片上发生吸氧腐蚀
D 向含有和的悬浊液中滴加溶液,生成黑色沉淀。
A.A B.B C.C D.D
2.轻质碳酸钙广泛用于橡胶、塑料、油漆等行业。以石灰石(主要成分CaCO3,含有少量SiO2、MgO等)为原料制备轻质碳酸钙的一种流程如图所示。下列说法错误的是( )
A.“煅烧”时生成 CaSiO3的化学方程式为
B.“溶浸”生成的气体可用于“调pH”
C.相同温度下,Ksp[Mg(OH)2]>Ksp[Ca(OH)2]
D.“转化”时通入CO2过多会降低产品产率
3.下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 实验操作 实验目的或结论
A 向某黄色溶液中加入淀粉KI溶液,溶液变蓝 该溶液中含有Br2
B 将混有Ca(OH)2杂质的Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀 除去Mg(OH)2样品中的Ca(OH)2杂质
C 向盛有1mL0.1mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成再滴加 0.1mol/L NaI溶液,产生黄色沉淀。 常温下,Ksp(AgCl)>Ksp(AgI)
D 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 HSO3-结合H+的能力比SO32-的强
A.A B.B C.C D.D
4.下列实验中,实验现象与结论均匹配的是( )
选项 实验操作 实验现象 结论
A 取5 mL 0.1mol·L-1 KI溶液于试管中,加入1 mL 0.1 mol·L-1FeCl3溶液,充分反应后萃取分液,向水层滴KSCN溶液 溶液变血红色 KI与FeCl3的反应有一定限度
B 向酸性KMnO4溶液中滴加H2O2溶液 紫色褪去并产生气泡 H2O2具有氧化性
C 取等浓度等体积的Na2S、NaCl溶液于试管中,分别滴入几滴酚酞 Na2S溶液变红、NaCl溶液无色 非金属性:Cl>S
D 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl2溶液 先产生白色沉淀,后生成红褐色沉淀 证明KspMg(OH)2]>Ksp[Fe(OH)3]
A.A B.B C.C D.D
5.下列关于难溶电解质溶液说法正确的是( )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol·L-1盐酸、③0.1mol·L-1氯化镁溶液、④0.1mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:AgCl+S2-=Ag2S↓+Cl-
D.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
6.20℃时其些物质的溶解度数据如下表所示:
物质 CaCO3 CaSO4 Mg(OH)2 MgCO3
溶解度/(g/100g水) 1.4×10-3 0.21 9×10-4 1.1×10-2
下列说法不正确的是( )
A.碳酸镁悬冲液中在在沉淀溶解平衡:MgCO3(s)Mg2+(ag)+ (aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向盛有1 mL 0.1 mol/L的NaOH溶液的试管中滴加1~2滴(1 mL约20滴)2 mol/LMgCl2溶液,再滴加几滴0.1 mol/L的FeCl3溶液,先有白色沉淀生成,后沉淀又转化为红褐色,说明此温度下:Ksp[Fe(OH) 3]<Ksp[Mg(OH)2]
D.向2 mL饱和 MgCl2溶液中先后滴加0.1 mol/L的Na2CO3、NaOH溶液各2滴(1 mL约20滴),产生的白色沉淀为Mg(OH)2和MgCO3
7.根据下列实验操作和现象所得到的结论正确的是( )
选项 操作和现象 结论
A 室温下,物质的量浓度相同的Na2CO3溶液和NaCN溶液,Na2CO3溶液的pH大于NaCN溶液 酸性:HCN>H2CO3
B 用KI的浓溶液浸泡AgCl沉淀,有黄色沉淀生成 Ksp(AgCl)>Ksp(AgI)
C 室温下,将pH相同的HA与HB的稀溶液分别加水稀释相同的倍数,所得溶液的pH:pH(HA)>pH(HB) 酸性:HA>HB
D 将0.1mol·L-1 FeCl3溶液与0.2mol·L-1 KI溶液等体积混合,振荡,再加入2mL CCl4,振荡,静置后下层为紫红色 I-和Fe3+反应有一定的限度
A.A B.B C.C D.D
8.化学是以实验为基础的学科,有关下列实验操作中,现象、结论合理的是( )
选项 实验操作 现象 结论
A 用结净干燥的玻璃棒蘸取浓硫酸点在干燥的pH试纸上 试纸变黑 体现浓硫酸的吸水性
B 将乙醇和浓硫酸混合溶液加热至170℃,将产生的气体通人溴水中 溴水褪色 有乙烯生成
C 某无色溶液滴加盐酸,产生无色气体通入澄清石灰水中 石灰水先变浑浊后变澄清 无色溶液中一定含有CO
D 向2mL0.1mol/LNa2S溶液中滴2滴0.1mol/L ZnSO4溶液,再滴2滴0.1mol/L CuSO4溶液 先生成白色沉淀,后生成黑色沉淀 Ksp(ZnS)与Ksp(CuS)大小无法判定
A.A B.B C.C D.D
9.25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
B.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
C.BaSO4和BaCO3共存的悬浊液中,
D.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
A.采用加热方法消毒的目的是使蛋白质变性而杀灭细菌
B.石油分馏可得到石油气、汽油、煤油、柴油等
C.“海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化
D.已知 所以工业上用制取时,用MnS除去溶液中含有的离子
11.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结 论
A 向20mL0.2mol·L-1硝酸银溶液中滴加5滴0.2mol·L-1氯化钠溶液出现白色沉淀,再在浊液中滴加几滴0.2mol·L-1碘化钾溶液出现黄色沉淀 不能证明碘化银比氯化银难溶
B 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH 酸性:HA>H2CO3
C 将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红 熔融物中不含有正三价铁
D 向2支均盛有2mL1.0mol·L-1KOH溶液的试管中分别加入2滴浓度均为0.1mol·L-1的AlCl3和MgCl2溶液,一支试管出现白色沉淀,另一支无明显现象 Ksp[Al(OH)3]>Ksp[Mg(OH)2]
A.A B.B C.C D.D
12.实验小组进行如下实验:已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是( )
A.操作II中仅发生反应:Cr3++3OH-═Cr(OH)3↓
B.①中生成蓝紫色溶液说明K2Cr2O7在反应中被还原
C.若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
D.将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
13.向溶液中滴加氨水至过量,下列叙述正确的是( )
A.先出现蓝色沉淀,后沉淀溶解变为无色溶液
B.蓝色沉淀变为溶液的化学方程式为
C.的空间构型为正四面体形
D.中含共价键12 mol
14.下列实验操作能达到实验目的的是( )
选项 操作 目的
A 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 测定NaClO溶液的pH
B 向含有酚酞的溶液中滴入溶液,观察溶液颜色的变化 证明溶液中存在水解平衡
C 取溶液,先后滴加3滴溶液和5滴溶液,观察沉淀情况 比较、的大小
D 将样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 检验样品是否变质
A.A B.B C.C D.D
15.根据下列实验操作和现象所得到的结论不正确的是( )
选项 实验操作和现象 实验结论
A 向AgNO3溶液中加入过量的0.1mol L-1的NaCl溶液,产生白色沉淀。再滴加几滴NaBr溶液,出现浅黄色沉淀 Ksp(AgBr)
C 向饱和NaHCO3溶液中滴加饱和CaCl2溶液,先有白色沉淀产生,后放出无色气泡 Ca2+与CO结合促进HCO的电离,溶液中H+浓度增大,与HCO反应产生CO2
D 向滴加有酚酞的氨水中加入蒸馏水,溶液的红色变浅 溶液中c(H+)、c(OH-)浓度均减小
A.A B.B C.C D.D
16.通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是( )
A.滴定选用的指示剂为甲基橙 B.本次实验测得Cl元素的质量分数为%
C.硝基苯的作用为防止沉淀被氧化 D.若取消步骤Ⅲ,测定结果偏大
二、综合题(共4题)
17.硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)Na2S溶液中,水的电离程度会______(填“增大”“减小”或“不变”);微热该溶液,pH会_____(填“增大”“减小”或“不变”)。
(2)Na2S溶液中各离子浓度由大到小的顺序为:_____________________________。
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:_____Na2S+_____Na2SO3+_____H2SO4→_____Na2SO4+_____S+_____H2O
(4)配平上述化学方程式,标出电子转移的方向和数目__________。反应中被氧化的元素是____________。
(5)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:________________________________________________________________________。
18.(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________(填下面的选项),加入该氧化剂时,温度不能太高,原因是_________。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________(FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×10 38,Ksp[Cu(OH)2]=3.0×10 20,通常认为残留在溶液中的离子浓度小于1×10 5mol L 1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol L 1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________。
19.硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
离子 Pb2- Ca2+ Fe3+ Mn2+
处理前浓度/(mg·L-1) 0.100 29.8 0.12 0.087
处理后浓度/(mg·L-1) 0.004 22.6 0.04 0.053
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
20.以银精矿(主要成分为Ag2S)为原料采用“预氧化湿法提银”工艺流程如下:
(1) N2H4中氮原子的杂化方式为___,N原子核外有____种不同的运动状态的电子。
(2)“分离转化”时,加入KClO3的目的是___;若不加KClO3,直接加氯化物,依据反应Ag2S+2Cl- 2AgCl+S2-,____(填“能、不能”)实现其较完全转化,并说明理由:___(已知:Ksp(Ag2S)=1.6×10-49,Ksp(AgCl)=2.0×10-10)。为提高Ag2S的转化率可采取的措施是_____(列举2条)。
(3)“浸银”时,发生反应的离子方程式为____。
(4)“还原”时,2[Ag(SO3)2]3-+N2H4+2OH-=2Ag↓+4SO+N2↑+H2↑+2H2O,该反应中每有1mol N-H断裂时,该反应转移电子的物质的量为____mol。
参考答案
1.D
2.C
3.B
4.A
5.D
6.C
7.B
8.D
9.B
10.C
11.A
12.A
13.B
14.B
15.D
16.B
17.(1) 增大 增大
(2) c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(3) (4) -2价的硫元素
(5) 难溶的 FeS 加入水中存在着溶解平衡: FeSFe2++S2-, S2-与 Cu2+结合生成 CuS 沉淀, S2-浓度减小,平衡向右移动, FeS 沉淀逐渐转化为CuS 沉淀。
18.(1) B H2O2受热时会分解 ABD 否 (2) 3.3~4
(3) Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq)
19.(1)PbS+2Fe3++2Cl-= PbCl2+2Fe2++S 抑制Fe3+、Pb2+的水解
(2) 用冰水浴使反应PbCl2(s)+2Cl-(aq)PbCl42-(aq)逆向移动,使PbCl42-不断转化为PbCl2晶体而析出
(3) 盐酸和氯化铁
(4) Pb(OH) 3 +OH = Pb(OH) 42
加入试剂,Pb2+的浓度转化率为(0.1 0.004)÷0.1×100%=96%,Fe3+的浓度转化率为(0.12 0.04)÷0.12×100%=67%,所以去除Pb2+比Fe3+效果好
20.(1) sp3 7
(2) 将Ag2S转化为AgCl和S 不能 该反应的平衡常数极小(K=4×10-30),几乎不能转化
适当延长浸取时间;减小银精矿粒直径;适当升高浸出时的温度等
(3) AgCl+2 SO=[Ag(SO3)2]3-+Cl-
(4) 1
