物质的量课件
图片预览





文档简介
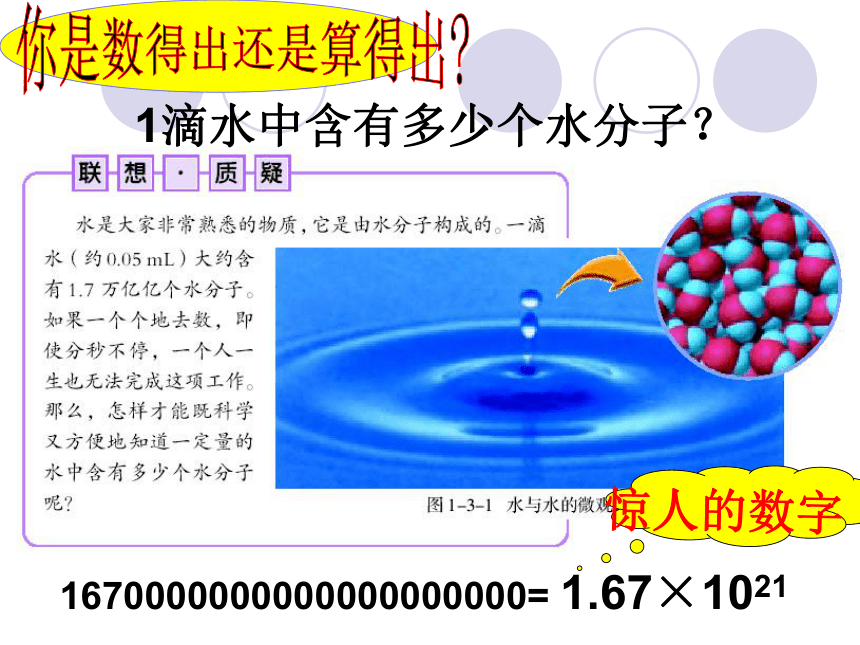
课件41张PPT。第一节 物质的量及其单位第三章 物质的量小二:我一口气能喝下6000万亿亿个水分子,有多厉害!小三:我一口气能喝36克水,我才厉害!说说谁喝的水多问题1:一个个的水分子看得见吗?数得出吗?问题2:通过什么办法能比较谁喝的水多?1滴水中含有多少个水分子?1670000000000000000000= 1.67×1021你是数得出还是算得出?惊人的数字宏 观
(质量等)微 观
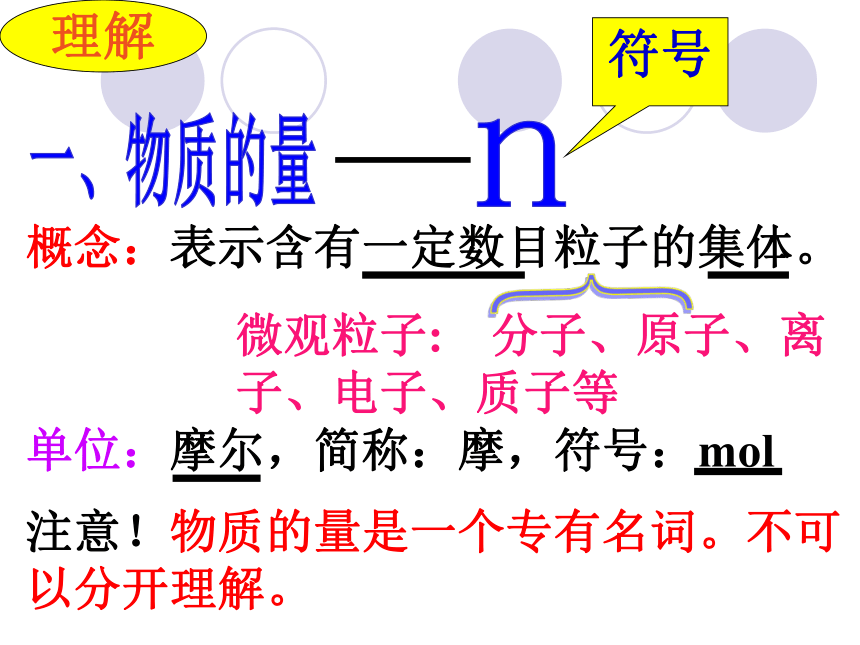
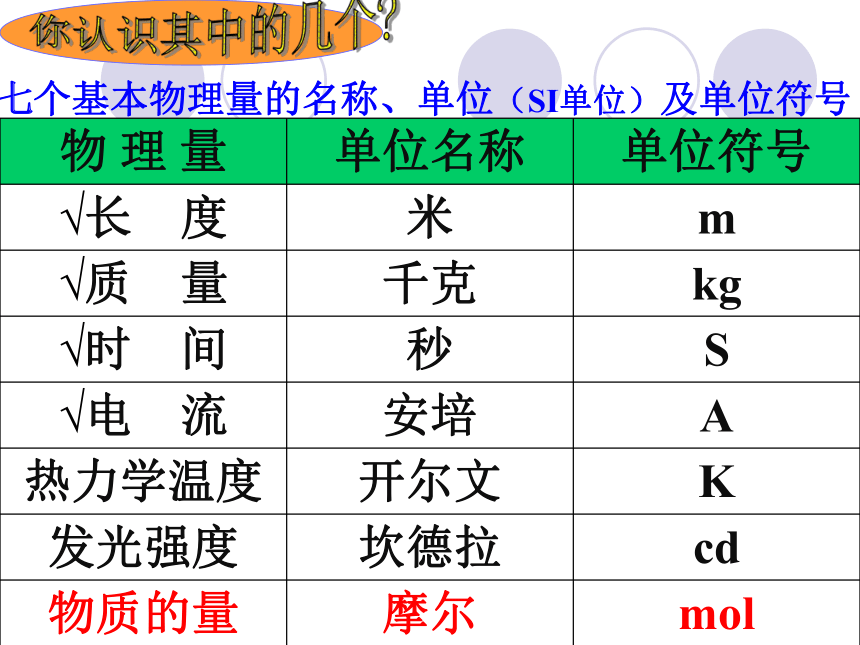
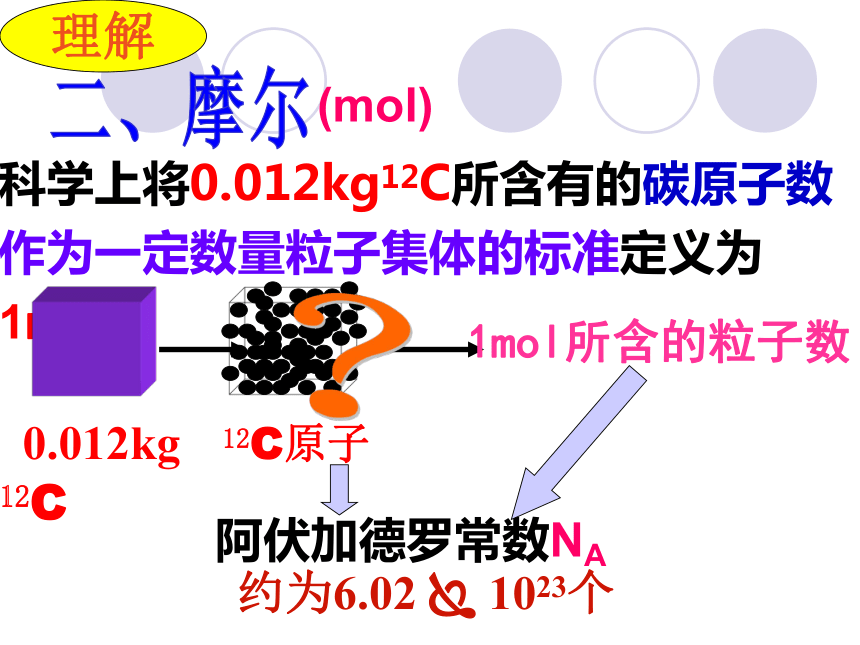
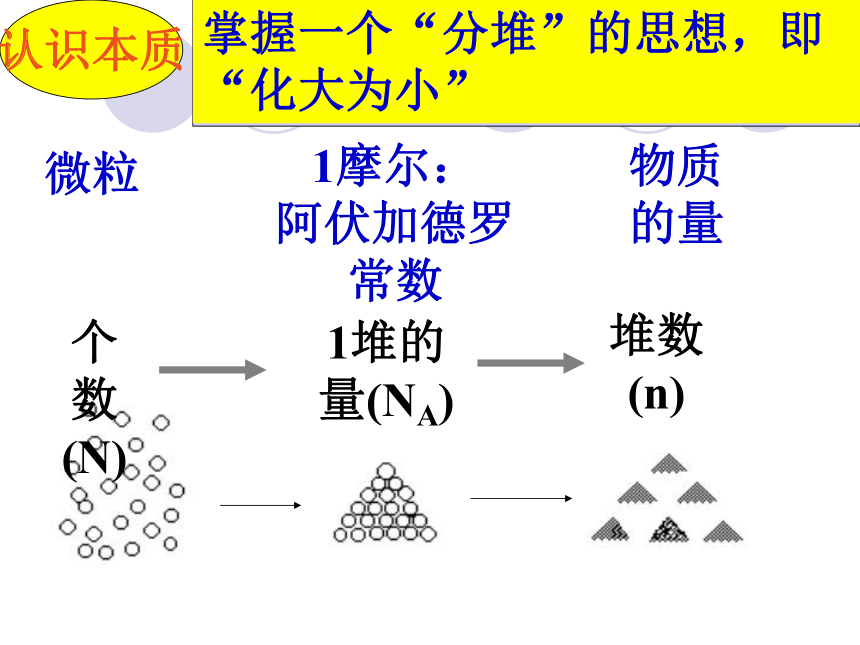
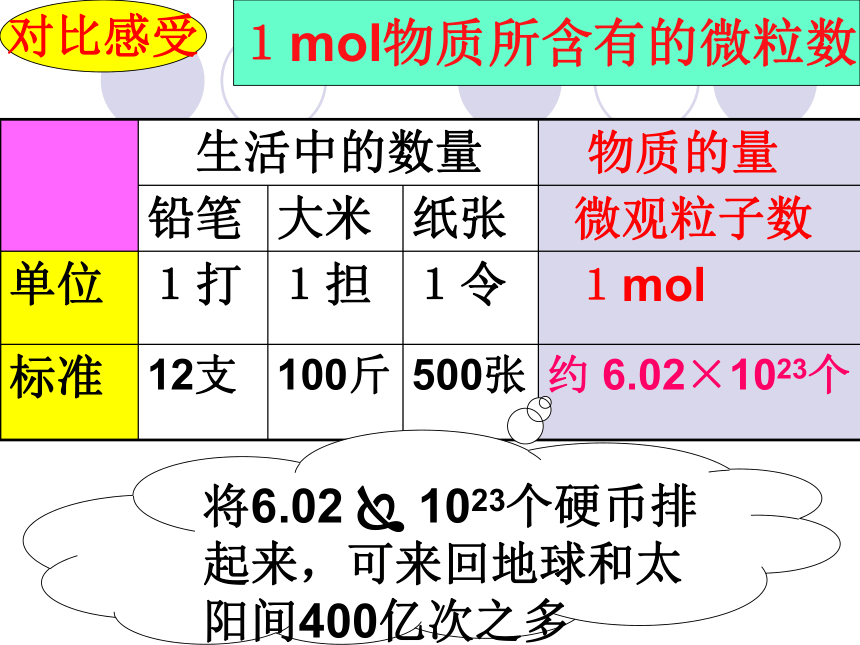
(粒子数)物质的量解决问题要靠它一个新的物理量概念:表示含有一定数目粒子的集体。单位:摩尔,简称:摩,符号:mol一、物质的量n理解{微观粒子: 分子、原子、离子、电子、质子等符号注意!物质的量是一个专有名词。不可以分开理解。七个基本物理量的名称、单位(SI单位)及单位符号你认识其中的几个?二、摩尔(mol)理解科学上将0.012kg12C所含有的碳原子数作为一定数量粒子集体的标准定义为1mol? 约为6.02 ? 1023个阿伏加德罗常数NA 1mol所含的粒子数认识本质掌握一个“分堆”的思想,即“化大为小” 意大利化学家。生于一个律师家庭。1792年进都灵大学法律系学习,取得法学博士学位。1800年弃法从理,1820年被选为都灵科学院院士。他在化学上的重大贡献是建立分子学说。为了纪念阿伏加德罗的伟大功绩,将0.012kg12C中所含的C原子数目称为阿伏加德罗常数。它是自然科学中的基本常数之一。 阿伏加德罗对比感受1mol物质所含有的微粒数将6.02 ? 1023个硬币排起来,可来回地球和太阳间400亿次之多
强化1mol物质所含粒子数= 阿伏加德罗常数(NA)=12克12C中所含碳原子数 约为6.02 ? 1023个1mol物质所含有的微粒数1molC中含有 个C.1molH2O中含有 个H2O.NA或约6.02× 1023NA或约6.02× 10231mol任何微粒都含有 个微粒数。NA或约6.02× 1023第一副:1molC的形象(意在准确建立摩尔的形象)建立1mol物质的形象(加和性)(可以用分数
或小数表示)使用物质的量和摩尔时的注意事项特别重要!⑴适用范围:微观粒子(如分子、原子、离子等)或它们的特定组合。不能用于宏观物体。如1mol小米( × )因为不是微观粒子⑵使用准则:必须指明微粒的种类(分子、原子、离子等);并规定用该粒子的符号(化学式),不使用中文名称。如1mol氢( × )因为必须指明是那一种粒子;1molH、1molH2、 1molH+练习11mol大米
1 摩尔氧
1 摩尔氧原子
2mol H2
0.5 摩尔二氧化碳分子未指明微粒种类,是氧原子、氧分子还是氧离子 ?表示为1mol O0.5mol CO2 1、判断下列说法或表示是否正确不是微观粒子2.说出下列符合的意义
(1)2H (2)2molH
(3)2molH+ (4)2molH2
3.用符号表示
(1)2摩尔水分子 (2)5摩尔硫酸根离子1(1)两个氢原子(2)两摩尔氢原子;
(3)两摩尔氢离子(4)两摩尔氢分子
2(1)2molH2O;(2)5molSO42- n(物质的量)N(粒子总数)1mol HNA个H2mol H2×NA个H…………n mol Hn×NA个HNnNA=×探究公式物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系。
(单位:mol)归纳公式N=n×NA例如:
N(CO2)=n(CO2) ×NA(单位:个)(单位:个/mol)微粒数之比等于物质的量之比H2O 11 mol2HO211 mol2 mol微粒个数物质的量应用一1 molH2O中有?molH和?molO讨论扩大6.02×1023 2×6.02×1023 6.02×1023 结论推导物质的量与微粒数之间的关系n1/n2=N1/N2方程式中系数比等于它们的物质的量之比应用二讨论结论化学方程式:2CO + O2 = 2CO2中系数比的意义。 2CO + O2 ==== 2CO2
质 量 比:
分子个数比:
物质的量比: 2 : 1 : 2
(2 NA) : (NA) : ( 2NA)2mol : 1mol : 2mol56 : 32 : 88推导物质的量与方程式系数之间的关系学会如CO2,看成1mol CO2中含1molC和2 mol O。
如:
Mg + 2HCl = MgCl2 + H21mol 2mol 1mol 1mol用物质的量看物质组成的观点和看待化学反应中的计量关系的观点1. 1molH2SO4中含有 molH、——— molS 、
———— molO。3. 2mol H2O中含 个H、____个O。4. 0.5mol NaOH中含 个Na + 。0.5NA5 . 2NA个H2是 mol H2 。22. 1.5molFe2(SO4)3中含 molFe3+,
molSO42-。
34.54NA2NA2146、3.01×1023个H+相当于 mol H+0.5练习2第二节 摩尔质量交流研讨1mol物质的质量到底是多少?已知1mol 12C 质量是? ??????12g那么1molO的质量为多少克?分析数据结论1mol任何粒子或物质的质量以克为单位,在数值上都与该粒子相对原子质量或相对分子质量相等。1mol物质的质量到底是多少?对比感受1mol物质的质量(1) 1molCu 质量是? ???
(2) 1molN2质量是???? ???
(3) 1molCO2质量是??? ????
(4) 1molCl-质量是???? ???
(5) 1molNa+质量是????? ??
(6) 1molNaCl质量是______________ 63.5g 28g 44g 35.5g 23g 58.5g 练习3一、摩尔质量单位物质的量(1mol)的物质所具有的质量。或者说,质量与物质的量之比。概念:M单位:g/mol (g.mol-1)或kg/mol(kg.mol-1)!以g/mol为单位时,等于相对分子(或原子)质量理解符号数值:例:M(H2O)= 18 g / mol1、下列说法中正确的是
A、Na的摩尔质量为 23g
B、Na的摩尔质量为 23g/mol
C、Na的摩尔质量为 23
D、Na的摩尔质量为 0.023kg/mol练习42、下列说法中正确的是
A、1mol O的质量是16g/mol
B、CO2的摩尔质量是44g/mol
C、Na+的摩尔质量是23g/mol
D、 氢的摩尔质量是2g/mol物质的量(n)、物质的质量(m)、摩尔质量(M)之间的关系。
(单位:mol)归纳公式m=n×M(单位:g)(单位:g/mol)例如:
m(CO2)=M(CO2)×n(CO2)(1)个数:阿伏加德罗常数即NA个(约6.02×1023个)
(2)对象:微粒
(分子、原子、离子等)(1)数值上等于相对分子(或原子)质量
(2)摩尔质量:
单位:g/mol一.基本概念1.物质的量2.摩尔(mol)复习小结注意:使用上面概念时要用化学式指明粒子的种类1mol二.同种物质的质量、物质的量和微粒数之间的换算。“钥匙”: M---摩尔质量
NA---阿伏加德罗常数三.不同种物质的质量、物质的量和微粒之间的换算。
微粒数之比 == 物质的量之比四.有关化学方程式的计算。
1.化学方程式系数比 == 物质的量之比 == 微粒数之比
2.只要上下单位一致,左右关系对应,则可列比例式计算二、关于物质的量的计算1、对于同种物质,要抓住二个公式进行物质的量、质量、微粒数三者之间的换算;
2、对于不同种物质,要抓住微粒数之比==物质的量之比;
3、解题过程要规范,注意正确使用符号和单位。 (1)、运用物质的量进行计算时,必须指明微粒的种类;(2)、运算过程中必须带单位运算,最后作答.1、在0.5molO2中含有的O2的分子数目是多少?
解:O2的分子数为N = n × NA = 0.5 mol × 6.02 ×1023个/mol = 3.01 × 1023个 答:O2的分子数为3.01 × 1023个例题讲解2、在0.5molO2中含有的O的原子数目是多少?
解:O2的O原子数为N = n (O2) ×2 × NA = 0.5 mol ×2× 6.02 ×1023个/mol = 6.02 × 1023个 答:O2的O原子数为6.02 × 1023个3、 24.5gH2SO4的物质的量是多少?
解:H2SO4的摩尔质量是98g.mol-1
n(H2SO4)= —————
= ———————
= 0.25mol
答:24.5gH2SO4的物质的量是0.25molm(H2SO4)M(H2SO4)24.5g98g.mol-14、求0.3molH2O的质量,其中O原子数?解:m(H2O)=n(H2O)M(H2O)×=0.3mol18g·mol-1×=5.4gN(O)=n(O)NA×=0.3mol6.02 ×1023mol-1×=1.806 ×1023=n(H2O)NA×答:(略)判断下列说法是否正确,并说明理由。
(1)1mol氧 (2)0.25molCO2。 (3)摩尔是7个基本物理量之一。 (4)1mol是6.02×1023个任何
微粒集合体。 (5)0.5molH2含有3.01×1023个H原子。 (6)3molNH3中含有3molN原子,
9molH原子。××××√√自我检测作业:1、课本P174第三章习题:一、二、三(写在课本上)
四、1-4 (写在作业本上)
2、收集生活中各种溶液的标签
预习:课本P33~37
作业与预习谢 谢!
(质量等)微 观
(粒子数)物质的量解决问题要靠它一个新的物理量概念:表示含有一定数目粒子的集体。单位:摩尔,简称:摩,符号:mol一、物质的量n理解{微观粒子: 分子、原子、离子、电子、质子等符号注意!物质的量是一个专有名词。不可以分开理解。七个基本物理量的名称、单位(SI单位)及单位符号你认识其中的几个?二、摩尔(mol)理解科学上将0.012kg12C所含有的碳原子数作为一定数量粒子集体的标准定义为1mol? 约为6.02 ? 1023个阿伏加德罗常数NA 1mol所含的粒子数认识本质掌握一个“分堆”的思想,即“化大为小” 意大利化学家。生于一个律师家庭。1792年进都灵大学法律系学习,取得法学博士学位。1800年弃法从理,1820年被选为都灵科学院院士。他在化学上的重大贡献是建立分子学说。为了纪念阿伏加德罗的伟大功绩,将0.012kg12C中所含的C原子数目称为阿伏加德罗常数。它是自然科学中的基本常数之一。 阿伏加德罗对比感受1mol物质所含有的微粒数将6.02 ? 1023个硬币排起来,可来回地球和太阳间400亿次之多
强化1mol物质所含粒子数= 阿伏加德罗常数(NA)=12克12C中所含碳原子数 约为6.02 ? 1023个1mol物质所含有的微粒数1molC中含有 个C.1molH2O中含有 个H2O.NA或约6.02× 1023NA或约6.02× 10231mol任何微粒都含有 个微粒数。NA或约6.02× 1023第一副:1molC的形象(意在准确建立摩尔的形象)建立1mol物质的形象(加和性)(可以用分数
或小数表示)使用物质的量和摩尔时的注意事项特别重要!⑴适用范围:微观粒子(如分子、原子、离子等)或它们的特定组合。不能用于宏观物体。如1mol小米( × )因为不是微观粒子⑵使用准则:必须指明微粒的种类(分子、原子、离子等);并规定用该粒子的符号(化学式),不使用中文名称。如1mol氢( × )因为必须指明是那一种粒子;1molH、1molH2、 1molH+练习11mol大米
1 摩尔氧
1 摩尔氧原子
2mol H2
0.5 摩尔二氧化碳分子未指明微粒种类,是氧原子、氧分子还是氧离子 ?表示为1mol O0.5mol CO2 1、判断下列说法或表示是否正确不是微观粒子2.说出下列符合的意义
(1)2H (2)2molH
(3)2molH+ (4)2molH2
3.用符号表示
(1)2摩尔水分子 (2)5摩尔硫酸根离子1(1)两个氢原子(2)两摩尔氢原子;
(3)两摩尔氢离子(4)两摩尔氢分子
2(1)2molH2O;(2)5molSO42- n(物质的量)N(粒子总数)1mol HNA个H2mol H2×NA个H…………n mol Hn×NA个HNnNA=×探究公式物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系。
(单位:mol)归纳公式N=n×NA例如:
N(CO2)=n(CO2) ×NA(单位:个)(单位:个/mol)微粒数之比等于物质的量之比H2O 11 mol2HO211 mol2 mol微粒个数物质的量应用一1 molH2O中有?molH和?molO讨论扩大6.02×1023 2×6.02×1023 6.02×1023 结论推导物质的量与微粒数之间的关系n1/n2=N1/N2方程式中系数比等于它们的物质的量之比应用二讨论结论化学方程式:2CO + O2 = 2CO2中系数比的意义。 2CO + O2 ==== 2CO2
质 量 比:
分子个数比:
物质的量比: 2 : 1 : 2
(2 NA) : (NA) : ( 2NA)2mol : 1mol : 2mol56 : 32 : 88推导物质的量与方程式系数之间的关系学会如CO2,看成1mol CO2中含1molC和2 mol O。
如:
Mg + 2HCl = MgCl2 + H21mol 2mol 1mol 1mol用物质的量看物质组成的观点和看待化学反应中的计量关系的观点1. 1molH2SO4中含有 molH、——— molS 、
———— molO。3. 2mol H2O中含 个H、____个O。4. 0.5mol NaOH中含 个Na + 。0.5NA5 . 2NA个H2是 mol H2 。22. 1.5molFe2(SO4)3中含 molFe3+,
molSO42-。
34.54NA2NA2146、3.01×1023个H+相当于 mol H+0.5练习2第二节 摩尔质量交流研讨1mol物质的质量到底是多少?已知1mol 12C 质量是? ??????12g那么1molO的质量为多少克?分析数据结论1mol任何粒子或物质的质量以克为单位,在数值上都与该粒子相对原子质量或相对分子质量相等。1mol物质的质量到底是多少?对比感受1mol物质的质量(1) 1molCu 质量是? ???
(2) 1molN2质量是???? ???
(3) 1molCO2质量是??? ????
(4) 1molCl-质量是???? ???
(5) 1molNa+质量是????? ??
(6) 1molNaCl质量是______________ 63.5g 28g 44g 35.5g 23g 58.5g 练习3一、摩尔质量单位物质的量(1mol)的物质所具有的质量。或者说,质量与物质的量之比。概念:M单位:g/mol (g.mol-1)或kg/mol(kg.mol-1)!以g/mol为单位时,等于相对分子(或原子)质量理解符号数值:例:M(H2O)= 18 g / mol1、下列说法中正确的是
A、Na的摩尔质量为 23g
B、Na的摩尔质量为 23g/mol
C、Na的摩尔质量为 23
D、Na的摩尔质量为 0.023kg/mol练习42、下列说法中正确的是
A、1mol O的质量是16g/mol
B、CO2的摩尔质量是44g/mol
C、Na+的摩尔质量是23g/mol
D、 氢的摩尔质量是2g/mol物质的量(n)、物质的质量(m)、摩尔质量(M)之间的关系。
(单位:mol)归纳公式m=n×M(单位:g)(单位:g/mol)例如:
m(CO2)=M(CO2)×n(CO2)(1)个数:阿伏加德罗常数即NA个(约6.02×1023个)
(2)对象:微粒
(分子、原子、离子等)(1)数值上等于相对分子(或原子)质量
(2)摩尔质量:
单位:g/mol一.基本概念1.物质的量2.摩尔(mol)复习小结注意:使用上面概念时要用化学式指明粒子的种类1mol二.同种物质的质量、物质的量和微粒数之间的换算。“钥匙”: M---摩尔质量
NA---阿伏加德罗常数三.不同种物质的质量、物质的量和微粒之间的换算。
微粒数之比 == 物质的量之比四.有关化学方程式的计算。
1.化学方程式系数比 == 物质的量之比 == 微粒数之比
2.只要上下单位一致,左右关系对应,则可列比例式计算二、关于物质的量的计算1、对于同种物质,要抓住二个公式进行物质的量、质量、微粒数三者之间的换算;
2、对于不同种物质,要抓住微粒数之比==物质的量之比;
3、解题过程要规范,注意正确使用符号和单位。 (1)、运用物质的量进行计算时,必须指明微粒的种类;(2)、运算过程中必须带单位运算,最后作答.1、在0.5molO2中含有的O2的分子数目是多少?
解:O2的分子数为N = n × NA = 0.5 mol × 6.02 ×1023个/mol = 3.01 × 1023个 答:O2的分子数为3.01 × 1023个例题讲解2、在0.5molO2中含有的O的原子数目是多少?
解:O2的O原子数为N = n (O2) ×2 × NA = 0.5 mol ×2× 6.02 ×1023个/mol = 6.02 × 1023个 答:O2的O原子数为6.02 × 1023个3、 24.5gH2SO4的物质的量是多少?
解:H2SO4的摩尔质量是98g.mol-1
n(H2SO4)= —————
= ———————
= 0.25mol
答:24.5gH2SO4的物质的量是0.25molm(H2SO4)M(H2SO4)24.5g98g.mol-14、求0.3molH2O的质量,其中O原子数?解:m(H2O)=n(H2O)M(H2O)×=0.3mol18g·mol-1×=5.4gN(O)=n(O)NA×=0.3mol6.02 ×1023mol-1×=1.806 ×1023=n(H2O)NA×答:(略)判断下列说法是否正确,并说明理由。
(1)1mol氧 (2)0.25molCO2。 (3)摩尔是7个基本物理量之一。 (4)1mol是6.02×1023个任何
微粒集合体。 (5)0.5molH2含有3.01×1023个H原子。 (6)3molNH3中含有3molN原子,
9molH原子。××××√√自我检测作业:1、课本P174第三章习题:一、二、三(写在课本上)
四、1-4 (写在作业本上)
2、收集生活中各种溶液的标签
预习:课本P33~37
作业与预习谢 谢!
