专题7 微专题—氨气的喷泉实验原理及应用-讲义(知识梳理+训练)【新教材】2020-2021学年高一化学(苏教版(2019)必修二)
文档属性
| 名称 | 专题7 微专题—氨气的喷泉实验原理及应用-讲义(知识梳理+训练)【新教材】2020-2021学年高一化学(苏教版(2019)必修二) |

|
|
| 格式 | docx | ||
| 文件大小 | 255.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-11 00:00:00 | ||
图片预览

文档简介
专题七微专题——氨气的喷泉实验原理及应用学案及训练
知识梳理
喷泉是一种常见的现象,其产生原因是存在压强差,常见装置有以下三种。
1.喷泉实验原理
(1)如图甲(或乙)烧瓶内的气体极易溶于水(或易与溶液中的溶质发生化学反应),从而使烧瓶内气压迅速降低,在大气压作用下,烧杯中的液体迅速向上流动,从而形成喷泉。
气体 HCl NH3 CO2、Cl2、SO2、H2S NO2与O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水
(2)如图丙锥形瓶内发生化学反应,产生气体,从而使锥形瓶内压强迅速增大,促使锥形瓶内液体迅速向上流动,形成喷泉。
2.氨气的喷泉实验成功的关键
(1)装置的气密性良好。
(2)圆底烧瓶要保持干燥。
(3)圆底烧瓶内要充满气体。
(4)烧杯内装入足量的水,以防止因水量不足而造成喷泉停止或不发生。
3.喷泉实验的有关计算
(1)实验完成后,溶液充满烧瓶,溶质的物质的量与气体的物质的量相同(由体积换算确定)。
标准状况下若烧瓶体积为V L,则有V(aq)=V L,
nB=
cB=== mol·L-1。
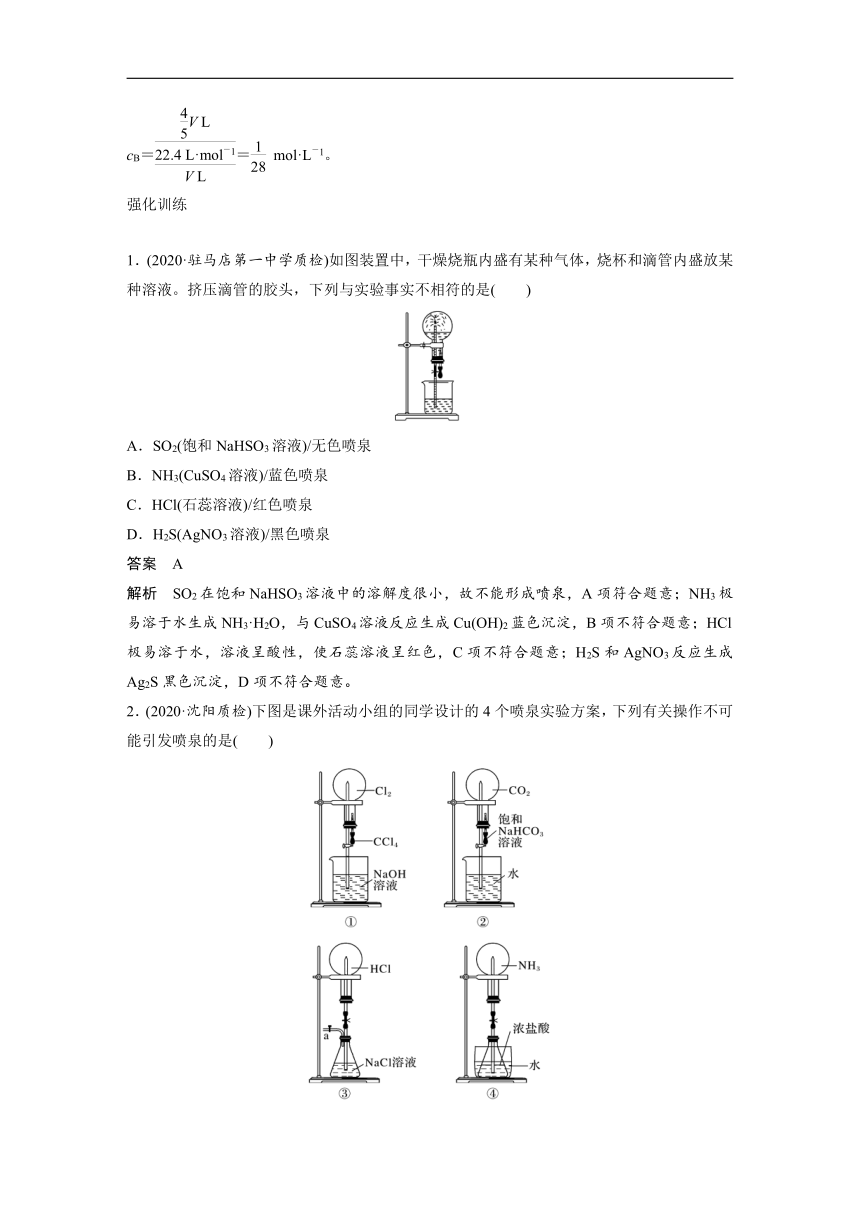
(2)若溶质由部分气体转化而成,则依实际情况判断。如体积为V L的NO2与O2的混合气体按4∶1混合后做喷泉实验,发生的反应为4NO2+O2+2H2O===4HNO3,则有V(aq)= V L,nB=×,
cB== mol·L-1。
强化训练
1.(2020·驻马店第一中学质检)如图装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )
A.SO2(饱和NaHSO3溶液)/无色喷泉
B.NH3(CuSO4溶液)/蓝色喷泉
C.HCl(石蕊溶液)/红色喷泉
D.H2S(AgNO3溶液)/黑色喷泉
答案 A
解析 SO2在饱和NaHSO3溶液中的溶解度很小,故不能形成喷泉,A项符合题意;NH3极易溶于水生成NH3·H2O,与CuSO4溶液反应生成Cu(OH)2蓝色沉淀,B项不符合题意;HCl极易溶于水,溶液呈酸性,使石蕊溶液呈红色,C项不符合题意;H2S和AgNO3反应生成Ag2S黑色沉淀,D项不符合题意。
2.(2020·沈阳质检)下图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,然后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
答案 B
解析 Cl2易溶于CCl4且易和NaOH溶液反应,烧瓶内压强减小,形成喷泉,A项不符合题意;CO2在饱和NaHCO3溶液中溶解度很小,不能形成喷泉,B符合题意;从a处鼓入空气,打开止水夹,HCl和NaCl溶液接触,因为HCl极易溶于水,导致烧瓶内压强降低,可形成喷泉,C项不符合题意;加入生石灰,生石灰和水反应放出大量的热,导致锥形瓶内气压升高,打开止水夹,浓盐酸被压入烧瓶和NH3接触,NH3极易溶于水且和盐酸发生反应,可形成喷泉,D项不符合题意。
3.(2019·江西赣州中学高一期末)某学生积极思考产生喷泉的其他方法,并设计了如图所示的装置。
(1)在如图所示的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________(填字母)。
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.Mg与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是_________________________________________________
________________________________________________________________________。
(2)在图示锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是________(填字母)。
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是____________________________________________________
________________________________________________________________________。
答案 (1)CD Mg和稀H2SO4反应产生H2,NH4HCO3和稀盐酸反应产生CO2,锥形瓶内气体压强增大,把液体压入烧瓶,形成喷泉 (2)A 浓硫酸溶于水放出大量的热,使锥形瓶中的酒精汽化,锥形瓶中气体压强增大,把酒精压入烧瓶中形成喷泉
解析 根据装置特点,要形成喷泉,必须使锥形瓶气体压强增大,打开止水夹,将锥形瓶内液体压入烧瓶。
4.(2020·哈尔滨德强学校检测)利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅰ中产生“红色喷泉”,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是______。
(2)若要烧瓶Ⅱ中产生“蓝色喷泉”,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______________________________________________。
(3)若关闭b活塞,打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是__________。
(4)若要在该装置中产生“红蓝双色喷泉”现象,其操作方法是_________________________。
答案 (1)打开a、b活塞,再用热毛巾捂热烧瓶Ⅰ
(2)先打开b、c活塞,再挤压胶头滴管
(3)烧瓶Ⅱ中导管口处产生白烟
(4)先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
解析 (1)要使烧瓶Ⅰ中形成“红色喷泉”,烧瓶Ⅱ中不形成喷泉,应打开a、b活塞,用热毛巾捂热烧瓶,使HCl和石蕊溶液接触,从而形成喷泉。
(2)要使烧瓶Ⅱ中形成“蓝色喷泉”,烧瓶Ⅰ中不形成喷泉,应打开b、c活塞,挤压胶头滴管,使水进入烧瓶Ⅱ,NH3极易溶于水,从而形成喷泉。
(3)只打开a、c活塞,挤压胶头滴管使水进入烧瓶Ⅱ,NH3极易溶于水,导致烧瓶Ⅱ中气压降低,将HCl“吸入”烧瓶Ⅱ与NH3反应,故在烧瓶Ⅱ导管口处会产生白烟。
(4)打开a、c活塞,挤压胶头滴管,NH3易溶于水,且和HCl反应掉部分,导致烧瓶Ⅰ和烧瓶Ⅱ中压强都减小,再打开b活塞,石蕊溶液进入烧瓶Ⅰ形成红色喷泉,进入烧瓶Ⅱ形成蓝色喷泉。
5.(2020·苍南县嘉禾中学月考)如下图为化学教学中所用的喷泉实验装置。
某同学用烧瓶盛不同的气体进行喷泉实验,请帮助分析实验后烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。
(1)若用HCl气体,则c(HCl)=____________________________________________________。
(2)若用NO2气体,则c(HNO3)=____________________________________________________。
(3)若用n(NO2)∶n(O2)=4∶1的混合气体,则c(HNO3)=_______________________。
答案 (1) mol·L-1
(2) mol·L-1
(3) mol·L-1
解析 设烧瓶的容积为V L,则烧瓶内气体的物质的量都为 mol。
(1)HCl气体形成喷泉后,溶液充满烧瓶,则溶液体积为V L,则c(HCl)== mol·L-1。
(2)NO2气体形成喷泉后,溶质为HNO3,据化学方程式
3NO2+H2O===2HNO3+NO可得形成喷泉后溶液体积为V L,
HNO3的物质的量为× mol,
则c(HNO3)== mol·L-1。
(3)因n(NO2)∶n(O2)=4∶1,n(NO2)=× mol,混合气体溶于水,溶液充满烧瓶,溶液体积为V L,据化学方程式
4NO2+O2+2H2O===4HNO3
× mol × mol
故c(HNO3)==× mol·L-1= mol·L-1。
知识梳理
喷泉是一种常见的现象,其产生原因是存在压强差,常见装置有以下三种。
1.喷泉实验原理
(1)如图甲(或乙)烧瓶内的气体极易溶于水(或易与溶液中的溶质发生化学反应),从而使烧瓶内气压迅速降低,在大气压作用下,烧杯中的液体迅速向上流动,从而形成喷泉。
气体 HCl NH3 CO2、Cl2、SO2、H2S NO2与O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水
(2)如图丙锥形瓶内发生化学反应,产生气体,从而使锥形瓶内压强迅速增大,促使锥形瓶内液体迅速向上流动,形成喷泉。
2.氨气的喷泉实验成功的关键
(1)装置的气密性良好。
(2)圆底烧瓶要保持干燥。
(3)圆底烧瓶内要充满气体。
(4)烧杯内装入足量的水,以防止因水量不足而造成喷泉停止或不发生。
3.喷泉实验的有关计算
(1)实验完成后,溶液充满烧瓶,溶质的物质的量与气体的物质的量相同(由体积换算确定)。
标准状况下若烧瓶体积为V L,则有V(aq)=V L,
nB=
cB=== mol·L-1。
(2)若溶质由部分气体转化而成,则依实际情况判断。如体积为V L的NO2与O2的混合气体按4∶1混合后做喷泉实验,发生的反应为4NO2+O2+2H2O===4HNO3,则有V(aq)= V L,nB=×,
cB== mol·L-1。
强化训练
1.(2020·驻马店第一中学质检)如图装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )
A.SO2(饱和NaHSO3溶液)/无色喷泉
B.NH3(CuSO4溶液)/蓝色喷泉
C.HCl(石蕊溶液)/红色喷泉
D.H2S(AgNO3溶液)/黑色喷泉
答案 A
解析 SO2在饱和NaHSO3溶液中的溶解度很小,故不能形成喷泉,A项符合题意;NH3极易溶于水生成NH3·H2O,与CuSO4溶液反应生成Cu(OH)2蓝色沉淀,B项不符合题意;HCl极易溶于水,溶液呈酸性,使石蕊溶液呈红色,C项不符合题意;H2S和AgNO3反应生成Ag2S黑色沉淀,D项不符合题意。
2.(2020·沈阳质检)下图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,然后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
答案 B
解析 Cl2易溶于CCl4且易和NaOH溶液反应,烧瓶内压强减小,形成喷泉,A项不符合题意;CO2在饱和NaHCO3溶液中溶解度很小,不能形成喷泉,B符合题意;从a处鼓入空气,打开止水夹,HCl和NaCl溶液接触,因为HCl极易溶于水,导致烧瓶内压强降低,可形成喷泉,C项不符合题意;加入生石灰,生石灰和水反应放出大量的热,导致锥形瓶内气压升高,打开止水夹,浓盐酸被压入烧瓶和NH3接触,NH3极易溶于水且和盐酸发生反应,可形成喷泉,D项不符合题意。
3.(2019·江西赣州中学高一期末)某学生积极思考产生喷泉的其他方法,并设计了如图所示的装置。
(1)在如图所示的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________(填字母)。
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.Mg与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是_________________________________________________
________________________________________________________________________。
(2)在图示锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是________(填字母)。
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是____________________________________________________
________________________________________________________________________。
答案 (1)CD Mg和稀H2SO4反应产生H2,NH4HCO3和稀盐酸反应产生CO2,锥形瓶内气体压强增大,把液体压入烧瓶,形成喷泉 (2)A 浓硫酸溶于水放出大量的热,使锥形瓶中的酒精汽化,锥形瓶中气体压强增大,把酒精压入烧瓶中形成喷泉
解析 根据装置特点,要形成喷泉,必须使锥形瓶气体压强增大,打开止水夹,将锥形瓶内液体压入烧瓶。
4.(2020·哈尔滨德强学校检测)利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅰ中产生“红色喷泉”,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是______。
(2)若要烧瓶Ⅱ中产生“蓝色喷泉”,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______________________________________________。
(3)若关闭b活塞,打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是__________。
(4)若要在该装置中产生“红蓝双色喷泉”现象,其操作方法是_________________________。
答案 (1)打开a、b活塞,再用热毛巾捂热烧瓶Ⅰ
(2)先打开b、c活塞,再挤压胶头滴管
(3)烧瓶Ⅱ中导管口处产生白烟
(4)先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
解析 (1)要使烧瓶Ⅰ中形成“红色喷泉”,烧瓶Ⅱ中不形成喷泉,应打开a、b活塞,用热毛巾捂热烧瓶,使HCl和石蕊溶液接触,从而形成喷泉。
(2)要使烧瓶Ⅱ中形成“蓝色喷泉”,烧瓶Ⅰ中不形成喷泉,应打开b、c活塞,挤压胶头滴管,使水进入烧瓶Ⅱ,NH3极易溶于水,从而形成喷泉。
(3)只打开a、c活塞,挤压胶头滴管使水进入烧瓶Ⅱ,NH3极易溶于水,导致烧瓶Ⅱ中气压降低,将HCl“吸入”烧瓶Ⅱ与NH3反应,故在烧瓶Ⅱ导管口处会产生白烟。
(4)打开a、c活塞,挤压胶头滴管,NH3易溶于水,且和HCl反应掉部分,导致烧瓶Ⅰ和烧瓶Ⅱ中压强都减小,再打开b活塞,石蕊溶液进入烧瓶Ⅰ形成红色喷泉,进入烧瓶Ⅱ形成蓝色喷泉。
5.(2020·苍南县嘉禾中学月考)如下图为化学教学中所用的喷泉实验装置。
某同学用烧瓶盛不同的气体进行喷泉实验,请帮助分析实验后烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。
(1)若用HCl气体,则c(HCl)=____________________________________________________。
(2)若用NO2气体,则c(HNO3)=____________________________________________________。
(3)若用n(NO2)∶n(O2)=4∶1的混合气体,则c(HNO3)=_______________________。
答案 (1) mol·L-1
(2) mol·L-1
(3) mol·L-1
解析 设烧瓶的容积为V L,则烧瓶内气体的物质的量都为 mol。
(1)HCl气体形成喷泉后,溶液充满烧瓶,则溶液体积为V L,则c(HCl)== mol·L-1。
(2)NO2气体形成喷泉后,溶质为HNO3,据化学方程式
3NO2+H2O===2HNO3+NO可得形成喷泉后溶液体积为V L,
HNO3的物质的量为× mol,
则c(HNO3)== mol·L-1。
(3)因n(NO2)∶n(O2)=4∶1,n(NO2)=× mol,混合气体溶于水,溶液充满烧瓶,溶液体积为V L,据化学方程式
4NO2+O2+2H2O===4HNO3
× mol × mol
故c(HNO3)==× mol·L-1= mol·L-1。
