2-1 化学能与热能
图片预览










文档简介
课件36张PPT。化学:第二章第一节《化学能与热能》课件PPT(人教版必修2)第二章 化学反应与能量第一节 化学能与热能学习目标知道化学键的断裂和形成是化学反应中能量变化的主要原因。
通过生产、生活中的实例了解化学能与热能的相互转化。
探究化学能转化为热能在生产、生活中的应用。
探究中和反应和中和热的测定。能源与人类 能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。你知道吗?
煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),它们
燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么
关系?石灰石(主要成分是碳酸钙)要经过高温煅烧才能变成生石灰,高温提供的热
能在石灰石的分解反应中起到什么作用?你知道吗?不同的燃料其组成不同,燃烧后放出的热量也不相等。为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?分子里相邻的原子之间强烈的相互作用,通常叫做化学键。化学键一、化学键与化学反应中能量变化的关系分子或化合物里的原子之间是通过化学键相结合的,而化学键是与能量联系在一起的。当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
化学键的断裂和形成正是化学反应中能量变化的主要原因。
各种物质都储存有化学能。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。想一想:在化学反应中,随着物质的变化,既有反应物中化学键的断裂,又有生成物中化学键的形成,化学能也随之而改变。那么,一个化学反应吸收能量还是放出能量是由什么决定的呢?2摩H2和1摩O2生成2摩H2O的能量变化(H与H键能是436KJ/mol,O与O键能是496KJ/mol,H与O键能是463KJ/mol)
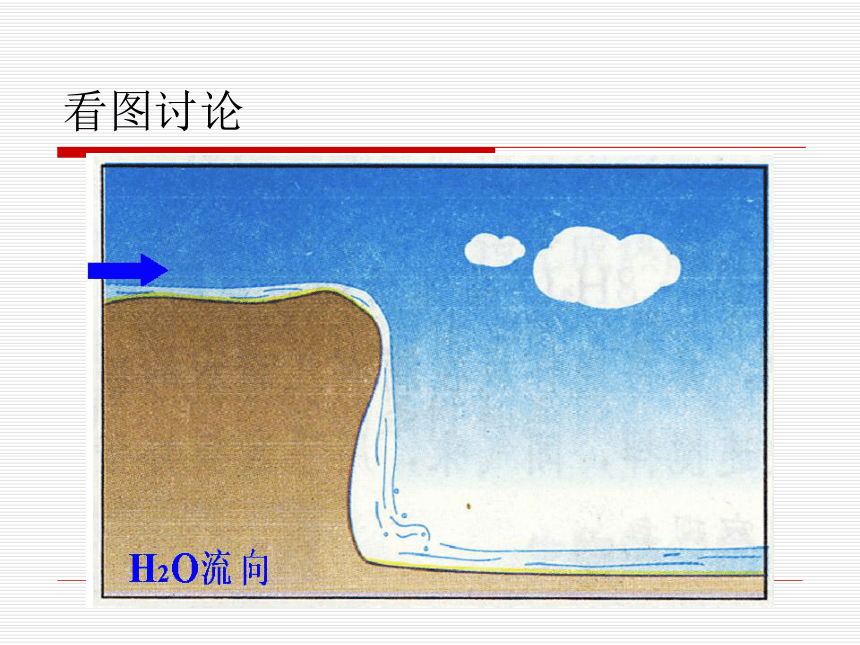
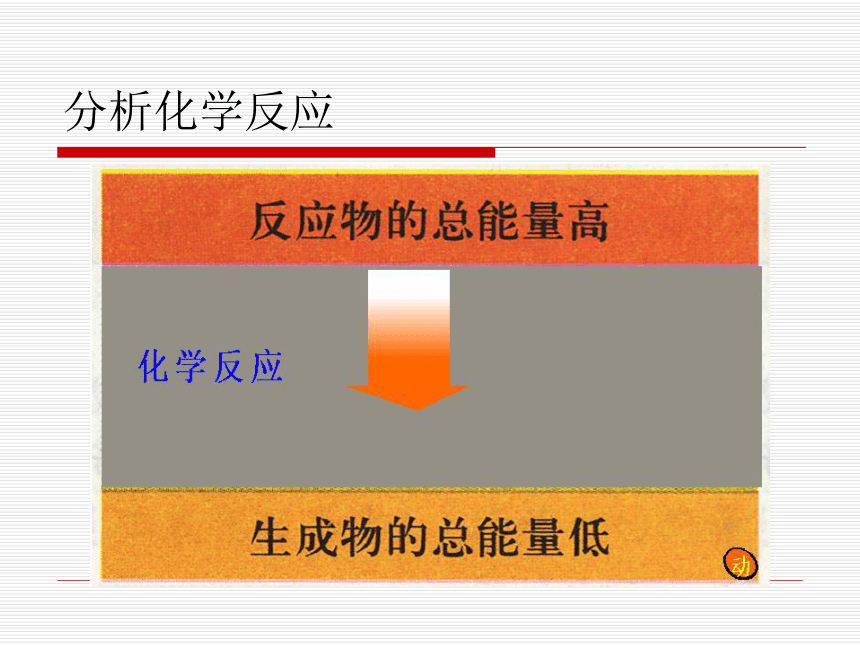
举例:拆开1摩H2所需能量是436KJ,拆1摩O2需要能量是496KJ。算一算:小结:一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。看图讨论分析化学反应看图讨论分析化学反应规律如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。规律练习:1、在化学反应中,断裂化学键需要__________,形成化学键将___________。化学反应是吸热反应还是放热反应决定于________________________。
反应物的总能量与生成物的总能量的相对大小放出能量吸收能量2、两位同学讨论放热和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们的说法正确吗?为什么?第一节 化学能与热能第二课时复习:1、不同的物质不仅组成______、结构______,所包含的化学能也_______。
2、一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于_______________________________________________________________。____________时,有部分能量释放出来;_______________________时,反应物要吸收能量,才能转化为生成物。二、化学能与热能的相互转化质量守恒定律和能量守恒定律
化学反应中的能量变化,通常主要表现为热量的变化。
热量的变化:吸热和放热
实验2-11.铝与盐酸反应的化学方程式:?????????????????????????????? 。
2.在反应过程中你将能看到什么现象?
3.用眼睛不能直接观察到反应中的热量变化,你将采取哪些简单易行的办法来了解反应中的热量变化?
4.要明显的感知或测量反应中的热量变化,你在实验中应注意哪些问题?思考与讨论:实验记录实验2-21、用化学方程式表示上述反应:
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
2.整个实验中有哪些创新之处?
实验2-3本质分析──H+ + OH- = H2O
所以,可提出推测,即中和反应都放热。
反应中H+和OH-离子的量相等 ,生成水
的量相等,放出的热量也相等 .思考与交流酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热。如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学讨论、交流。在设计实验装置和操作时应从两个方面考虑,一是注重“量”的问题,如① 反应物的浓度和体积取定值;② 测量反应前后的温度值;③ 做平行实验取平均值。二是尽量减小实验误差,如① 用经过标定的盐酸和氢氧化钠溶液;② 量液器最好使用移液管;③ 搅拌使反应充分进行;④ 及时散热,使混合液温度均衡;⑤ 温度计的精确度高,最好使用精度为0.1 ℃或更高的温度计;⑥ 盐酸跟氢氧化钠溶液混合后液面上方的空间尽可能小;⑦ 使用绝缘装置,避免热量散发到反应体系之外;⑧ 温度计要读准确。思考与交流化学能的应用利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。如:小结随堂练习:1、1mol H-H键的键能是436KJ, 1mol I – I 键的键能是151KJ, 1molH-I 键的健能是299KJ。则H2(g)+I2(g)=2HI(g)的反应是( )
A、吸热反应 B、放热反应
C、分解反应 D、可逆反应B、D2、指出下列说法的正误A、生物体内进行的缓慢氧化反应是放热反应。
B、化学键断裂吸收的能量越多,化学键越牢固。
C、植物光合作用吸收太阳能,与化学能无关。
D、柴草的燃烧与化学能无关。
E、人类的文明程度与人均耗能无关。课后练习:1.吸收能量,放出能量,反应物总能量与生成物总能量的相对大小。
2.热量,放出。
3. C、H元素,CO2、H2O。
4. ②③④⑤⑥,①。
5.反应物中化学键断裂需要吸收能量,生成物中化学键形成则要放出能量,当成键放出的能量大于断键吸收的能量时,反应最终放出能量,这部分能量以热的形式放出就是热能。吸热反应所吸收的热量被用于破坏反应物中的化学键。
6.同意乙同学的说法。因为放热反应是成键放出的能量大于断键吸收的能量,但化学反应首先需要能量来断键。
通过生产、生活中的实例了解化学能与热能的相互转化。
探究化学能转化为热能在生产、生活中的应用。
探究中和反应和中和热的测定。能源与人类 能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。你知道吗?
煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),它们
燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么
关系?石灰石(主要成分是碳酸钙)要经过高温煅烧才能变成生石灰,高温提供的热
能在石灰石的分解反应中起到什么作用?你知道吗?不同的燃料其组成不同,燃烧后放出的热量也不相等。为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?分子里相邻的原子之间强烈的相互作用,通常叫做化学键。化学键一、化学键与化学反应中能量变化的关系分子或化合物里的原子之间是通过化学键相结合的,而化学键是与能量联系在一起的。当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
化学键的断裂和形成正是化学反应中能量变化的主要原因。
各种物质都储存有化学能。不同的物质不仅组成不同、结构不同,所包含的化学能也不同。想一想:在化学反应中,随着物质的变化,既有反应物中化学键的断裂,又有生成物中化学键的形成,化学能也随之而改变。那么,一个化学反应吸收能量还是放出能量是由什么决定的呢?2摩H2和1摩O2生成2摩H2O的能量变化(H与H键能是436KJ/mol,O与O键能是496KJ/mol,H与O键能是463KJ/mol)
举例:拆开1摩H2所需能量是436KJ,拆1摩O2需要能量是496KJ。算一算:小结:一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。看图讨论分析化学反应看图讨论分析化学反应规律如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。规律练习:1、在化学反应中,断裂化学键需要__________,形成化学键将___________。化学反应是吸热反应还是放热反应决定于________________________。
反应物的总能量与生成物的总能量的相对大小放出能量吸收能量2、两位同学讨论放热和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们的说法正确吗?为什么?第一节 化学能与热能第二课时复习:1、不同的物质不仅组成______、结构______,所包含的化学能也_______。
2、一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于_______________________________________________________________。____________时,有部分能量释放出来;_______________________时,反应物要吸收能量,才能转化为生成物。二、化学能与热能的相互转化质量守恒定律和能量守恒定律
化学反应中的能量变化,通常主要表现为热量的变化。
热量的变化:吸热和放热
实验2-11.铝与盐酸反应的化学方程式:?????????????????????????????? 。
2.在反应过程中你将能看到什么现象?
3.用眼睛不能直接观察到反应中的热量变化,你将采取哪些简单易行的办法来了解反应中的热量变化?
4.要明显的感知或测量反应中的热量变化,你在实验中应注意哪些问题?思考与讨论:实验记录实验2-21、用化学方程式表示上述反应:
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
2.整个实验中有哪些创新之处?
实验2-3本质分析──H+ + OH- = H2O
所以,可提出推测,即中和反应都放热。
反应中H+和OH-离子的量相等 ,生成水
的量相等,放出的热量也相等 .思考与交流酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热。如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应该注意哪些问题?你准备如何设计并进行实验?请与同学讨论、交流。在设计实验装置和操作时应从两个方面考虑,一是注重“量”的问题,如① 反应物的浓度和体积取定值;② 测量反应前后的温度值;③ 做平行实验取平均值。二是尽量减小实验误差,如① 用经过标定的盐酸和氢氧化钠溶液;② 量液器最好使用移液管;③ 搅拌使反应充分进行;④ 及时散热,使混合液温度均衡;⑤ 温度计的精确度高,最好使用精度为0.1 ℃或更高的温度计;⑥ 盐酸跟氢氧化钠溶液混合后液面上方的空间尽可能小;⑦ 使用绝缘装置,避免热量散发到反应体系之外;⑧ 温度计要读准确。思考与交流化学能的应用利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。如:小结随堂练习:1、1mol H-H键的键能是436KJ, 1mol I – I 键的键能是151KJ, 1molH-I 键的健能是299KJ。则H2(g)+I2(g)=2HI(g)的反应是( )
A、吸热反应 B、放热反应
C、分解反应 D、可逆反应B、D2、指出下列说法的正误A、生物体内进行的缓慢氧化反应是放热反应。
B、化学键断裂吸收的能量越多,化学键越牢固。
C、植物光合作用吸收太阳能,与化学能无关。
D、柴草的燃烧与化学能无关。
E、人类的文明程度与人均耗能无关。课后练习:1.吸收能量,放出能量,反应物总能量与生成物总能量的相对大小。
2.热量,放出。
3. C、H元素,CO2、H2O。
4. ②③④⑤⑥,①。
5.反应物中化学键断裂需要吸收能量,生成物中化学键形成则要放出能量,当成键放出的能量大于断键吸收的能量时,反应最终放出能量,这部分能量以热的形式放出就是热能。吸热反应所吸收的热量被用于破坏反应物中的化学键。
6.同意乙同学的说法。因为放热反应是成键放出的能量大于断键吸收的能量,但化学反应首先需要能量来断键。
