4.2.1 电解原理课后强化习题(word版含答案)
文档属性
| 名称 | 4.2.1 电解原理课后强化习题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 556.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-12 09:17:38 | ||
图片预览




文档简介
第二节第一课时电解原理课后强化习题
一、单选题(共16题)
1.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.AgNO3 [Ag2O] B.NaOH [NaOH] C.NaCl [盐酸] D.CuSO4 [Cu(OH)2]
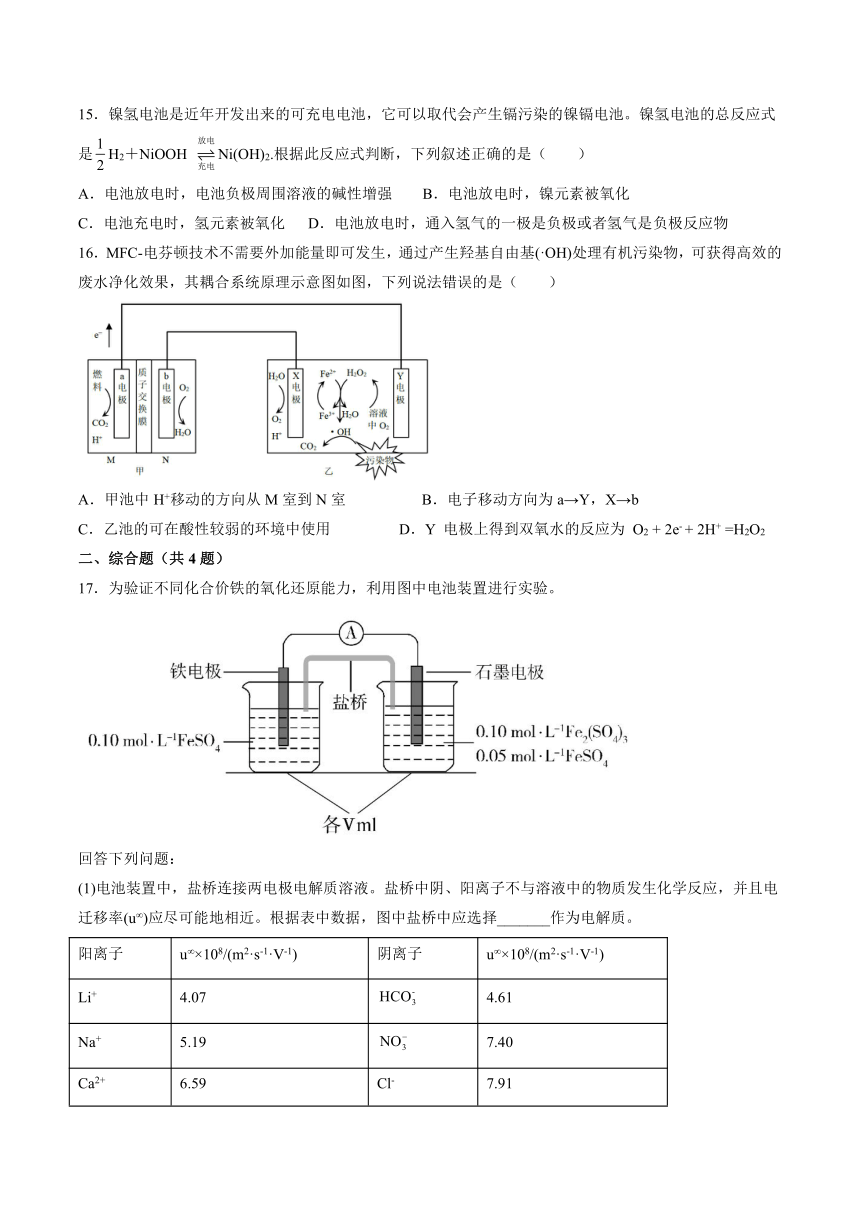
2.利用电化学原理可同时将、变废为宝,装置如图所示(电极均为惰性电极)。下列说法不正确的是( )
A.为负极,发生氧化反应,电极反应式为:
B.装置工作时,电子从极流入极,然后经溶液流入极
C.电极反应式为
D.若极消耗,则中左侧溶液质量减轻
3.某科研小组设计了一种新型双微生物燃料电池装置,如图所示。在a极将生活污水中的有机物(以C6H12O6为例)转化为CO2,b极将酸性工业废水中的硝酸盐转化为N2。下列说法不正确的是( )
A.a电极反应式为:C6H12O6-24e-+6H2O=6CO2↑+24H+
B.若b极产生了4.48 L(已换算为标准状况)的气体,则穿过质子交换膜进入左室的H+数目为2NA
C.电池工作时,电流由b极经负载流向a极,再经两电解质溶液回到b极
D.若用该电池对铅蓄电池进行充电,b极接PbO2极
4.下列离子方程式正确的是( )
A.少量气体通入溶液中:
B.稀硝酸与少量的铁粉反应:
C.电解水溶液:
D.稀硫酸逐滴加入溶液中,出现乳白色浑浊:
5.镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法不正确的是( )
A.断开K2、合上K1,电极A的电势低于电极B
B.断开K1、合上K2,电极A为阴极,发生氧化反应
C.电极B发生还原反应过程中,溶液中的KOH浓度有变化
D.镍镉二次电池的总反应式: Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O
6.下列反应的方程式不正确的是( )
A.NaClO溶液中通入少量SO2:ClO-+H2O+SO2=Cl-+SO+2H+
B.碳酸钠溶液中加入少量的苯酚:CO+C6H5OHC6H5O-+HCO
C.向NaHSO4溶液滴加Ba(OH)2溶液至SO沉淀完全Ba2++OH-+H++SO=BaSO4↓+H2O
D.电解精炼铜的阴极反应式:Cu2++2e-=Cu
7.我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )
A.充电时,b电极每增重0.65 g,溶液中有0.02 molI-被氧化 B.充电时,a电极接外电源负极
C.放电时,a电极反应为 D.放电时,溶液中离子的数目增大
8.一种突破传统电池设计理念的镁—锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )
A.放电时,Mg(液)层的质量减小 B.放电时,正极反应式为Mg2++2e-=Mg
C.该电池充电时,Mg—Sb(液)层发生还原反应 D.该电池充电时,Cl-向下移动
9.我国科学家在研究HCOOH燃料电池方面有重大进展,装置如图所示,两电极区间用离子交换膜隔开。下列说法正确的是( )
A.正极电极反应式为HCOO--2e-+2OH-=HCO+H2O B.隔膜为阴离子交换膜,储液池中需补充的物质A为H2SO4
C.放电时,1mol HCOOH转化为KHCO3时,消耗11.2L氧气D.当电路中转移1mol电子时,理论上生成87g K2SO4
10.金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如图。下列说法不正确的是( )
A.①中需持续吹入空气作氧化剂 B.A为Na2Cr2O7溶液
C.②中需加入过量稀硫酸 D.③中Cr在阴极生成
11.是一种半导体材料,基于绿色化学理念设计的一种制取的电解池示意图如下,电池总反应为。下列说法正确的是( )
A.石墨电极上的反应式为 B.电解后溶液的减小
C.铜电极接直流电源的负极 D.当有电子转移时,有生成
12.近日,我国学者在Science报道了一种氯离子介导的电化学合成方法,能将乙烯高效清洁、选择性地转化为环氧乙烷,电化学反应的具体过程如图所示。在电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下列说法错误的是( )
A.Ni电极与电源负极相连
B.工作过程中阴极附近pH增大
C.电解结束后,输出混合过程前两极电解液KCl浓度相同
D.该过程的总反应为
13.下列离子方程式书写正确的是( )
A.饱和碳酸钠溶液通二氧化碳:CO2+H2O+CO=2HCO
B.在偏铝酸钠溶液中通入少量二氧化碳:
C.溶液中n(FeBr2)∶n(Cl2)=4∶5时: 4Fe2++5Cl2+6Br-= 4Fe3++10Cl-+3Br2
D.用石墨作阴极、铁作阳极电解食盐水:
14.下列叙述不正确的是( )
A.与电源正极相连的是电解槽的阴极 B.电子从电源负极沿导线流入电解槽的阴极
C.用电解法精炼粗铜时粗铜作阳极 D.铜锌原电池中铜是正极
15.镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是H2+NiOOH Ni(OH)2.根据此反应式判断,下列叙述正确的是( )
A.电池放电时,电池负极周围溶液的碱性增强 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被氧化 D.电池放电时,通入氢气的一极是负极或者氢气是负极反应物
16.MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果,其耦合系统原理示意图如图,下列说法错误的是( )
A.甲池中H+移动的方向从M室到N室 B.电子移动方向为a→Y,X→b
C.乙池的可在酸性较弱的环境中使用 D.Y 电极上得到双氧水的反应为 O2 + 2e- + 2H+ =H2O2
二、综合题(共4题)
17.为验证不同化合价铁的氧化还原能力,利用图中电池装置进行实验。
回答下列问题:
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据表中数据,图中盐桥中应选择_______作为电解质。
阳离子 u∞×108/(m2·s-1·V-1) 阴离子 u∞×108/(m2·s-1·V-1)
Li+ 4.07 4.61
Na+ 5.19 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 8.27
(2)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入_______(填写“铁”或“石墨”)电极溶液中。
(3)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=_______。
(4)根据(2)、(3)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了氧化性_______ >_______,还原性_______ >_______。
(5)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的操作是_______。
18.某小组以软锰矿、闪锌矿为原料,尝试在铁钉表面镀锌及制取高纯。流程如下:
已知:①矿粉的主要成分是、ZnS,还含有少量FeS、CuS、等。
②酸浸时反应之一:。该生产过程中,与不反应。
③的氧化性与溶液pH有关。
请回答:
(1)滤渣中加NaOH溶液可分离铁和铝,化学方程式是___________。
(2)下列说法正确的是___________(填字母)。
A.可从步骤③的滤渣中回收S B.步骤⑤,可换成
C.步骤⑥,阳极材料可选择Fe D.多次过滤分离,可提高矿石利用价值
(3)除杂时先加后加,原因是___________。
(4)小组同学欲用下列步骤测定铁钉表面镀层的锌的质量。请选出正确操作并排序(实验只进行一次,操作不重复):
称取一定质量的铁钉,放入烧杯中→(___________)→(___________)→(___________)→(___________)→(___________),_______________
a.加过量浓硫酸 b.加过量稀硫酸 c.置于坩埚中,小火烘干
d.置于石棉网上,小火烘干 e.取出,用蒸馏水洗涤 f.搅拌,至气泡速率突然减小
g.用电子天平称量 h.用托盘天平称量
(5)测定产品的纯度:将固体研细,称取一定质量的产品至锥形瓶中,依次加入过量固体、足量稀,振荡至充分反应,再用标准溶液滴定剩余至终点。
①下列关于实验过程的说法,正确的是___________(填字母)。
A.先在滤纸上称量好粉末,再倒入锥形瓶 B.配制溶液时宜在棕色容量瓶中进行
C.“振荡至充分反应”时,锥形瓶须加塞密封 D.滴定时的指示剂是
E.滴定终点后仰视读数,会导致纯度偏大
②读取滴定管中溶液的示数时,因溶液颜色的干扰,凹液面最低点无法准确定位,此时可改为读取___________处的示数。
(6)电解时的总化学方程式为___________。
19.有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
请回答下列问题:
(1)B的电子式为________________。
(2)画出元素M的原子结构示意图__________________________________________。
(3)物质X的化学式为____________________________________________________。
(4)电解混合液时阳极反应式为____________________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:
① 含有L元素的化合反应______________________________________________。
② 含有L元素的置换反应______________________________________________。
(6)已知 E气体在D中完全燃烧生成稳定的化合物时,放出kJ的热量,写出E燃烧热的热化学方程式__________________________________。
20.已知A、B、C、E的焰色反应均为黄色,其中B常作食品的膨化剂,A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。X为一种黑色固体单质,X也有多种同素异形体,其氧化物之一参与大气循环,为温室气体,G为冶炼铁的原料,G溶于盐酸中得到两种盐。A~H之间有如下的转化关系(部分物质未写出):
(1)写出物质的化学式:A______________;F______________。
(2)物质C的电子式为______________。
(3)写出G与稀硝酸反应的离子方程式:____________________________。
(4)已知D→G转化过程中,转移4 mol电子时释放出a kJ热量,写出该反应的热化学方程式:____________________________。
(5)科学家用物质X的一种同素异形体为电极,在酸性介质中用N2、H2为原料,采用电解原理制得NH3,写出电解池阴极的电极反应方程式:____________________。
参考答案
1.A
2.B
3.B
4.B
5.B
6.A
7.B
8.C
9.D
10.C
11.A
12.C
13.C
14.A
15.D
16.C
17.(1)KCl (2) 石墨 (3) 0.09mol/L
(4) Fe3++e-=Fe2+ Fe-2e-= Fe2+ Fe3+ Fe2+ Fe Fe2+
(5) 取少量活化后溶液,滴入KSCN溶液,若溶液未变红,证明活化反应完成
18.(1)
(2) BD
(3) 溶液酸性强有利于充分氧化、氧化时消耗可减少用量
(4) b→f→e→d→g
(5) BCD 凹液面最高点
(6)
19.(1) (2)
(3) (NH4)2Fe(SO4)2
(4) 4OH--4e-===O2↑+2H2O
(5) 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2O3+2Al2Fe+Al2O3
(6) H2(g)+O2(g)===H2O(l) ΔH=-kJ·mol-1
20.(1)NaOH Fe
(2)
(3) 3Fe3O4+28 H++9Fe3++NO↑+14H2O
(4) 3Fe(s)+2O2 (g)Fe3O4(s) ΔH= 2a kJ/mol
(5) N2+6H++6e 2NH3
一、单选题(共16题)
1.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.AgNO3 [Ag2O] B.NaOH [NaOH] C.NaCl [盐酸] D.CuSO4 [Cu(OH)2]
2.利用电化学原理可同时将、变废为宝,装置如图所示(电极均为惰性电极)。下列说法不正确的是( )
A.为负极,发生氧化反应,电极反应式为:
B.装置工作时,电子从极流入极,然后经溶液流入极
C.电极反应式为
D.若极消耗,则中左侧溶液质量减轻
3.某科研小组设计了一种新型双微生物燃料电池装置,如图所示。在a极将生活污水中的有机物(以C6H12O6为例)转化为CO2,b极将酸性工业废水中的硝酸盐转化为N2。下列说法不正确的是( )
A.a电极反应式为:C6H12O6-24e-+6H2O=6CO2↑+24H+
B.若b极产生了4.48 L(已换算为标准状况)的气体,则穿过质子交换膜进入左室的H+数目为2NA
C.电池工作时,电流由b极经负载流向a极,再经两电解质溶液回到b极
D.若用该电池对铅蓄电池进行充电,b极接PbO2极
4.下列离子方程式正确的是( )
A.少量气体通入溶液中:
B.稀硝酸与少量的铁粉反应:
C.电解水溶液:
D.稀硫酸逐滴加入溶液中,出现乳白色浑浊:
5.镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法不正确的是( )
A.断开K2、合上K1,电极A的电势低于电极B
B.断开K1、合上K2,电极A为阴极,发生氧化反应
C.电极B发生还原反应过程中,溶液中的KOH浓度有变化
D.镍镉二次电池的总反应式: Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O
6.下列反应的方程式不正确的是( )
A.NaClO溶液中通入少量SO2:ClO-+H2O+SO2=Cl-+SO+2H+
B.碳酸钠溶液中加入少量的苯酚:CO+C6H5OHC6H5O-+HCO
C.向NaHSO4溶液滴加Ba(OH)2溶液至SO沉淀完全Ba2++OH-+H++SO=BaSO4↓+H2O
D.电解精炼铜的阴极反应式:Cu2++2e-=Cu
7.我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )
A.充电时,b电极每增重0.65 g,溶液中有0.02 molI-被氧化 B.充电时,a电极接外电源负极
C.放电时,a电极反应为 D.放电时,溶液中离子的数目增大
8.一种突破传统电池设计理念的镁—锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )
A.放电时,Mg(液)层的质量减小 B.放电时,正极反应式为Mg2++2e-=Mg
C.该电池充电时,Mg—Sb(液)层发生还原反应 D.该电池充电时,Cl-向下移动
9.我国科学家在研究HCOOH燃料电池方面有重大进展,装置如图所示,两电极区间用离子交换膜隔开。下列说法正确的是( )
A.正极电极反应式为HCOO--2e-+2OH-=HCO+H2O B.隔膜为阴离子交换膜,储液池中需补充的物质A为H2SO4
C.放电时,1mol HCOOH转化为KHCO3时,消耗11.2L氧气D.当电路中转移1mol电子时,理论上生成87g K2SO4
10.金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如图。下列说法不正确的是( )
A.①中需持续吹入空气作氧化剂 B.A为Na2Cr2O7溶液
C.②中需加入过量稀硫酸 D.③中Cr在阴极生成
11.是一种半导体材料,基于绿色化学理念设计的一种制取的电解池示意图如下,电池总反应为。下列说法正确的是( )
A.石墨电极上的反应式为 B.电解后溶液的减小
C.铜电极接直流电源的负极 D.当有电子转移时,有生成
12.近日,我国学者在Science报道了一种氯离子介导的电化学合成方法,能将乙烯高效清洁、选择性地转化为环氧乙烷,电化学反应的具体过程如图所示。在电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下列说法错误的是( )
A.Ni电极与电源负极相连
B.工作过程中阴极附近pH增大
C.电解结束后,输出混合过程前两极电解液KCl浓度相同
D.该过程的总反应为
13.下列离子方程式书写正确的是( )
A.饱和碳酸钠溶液通二氧化碳:CO2+H2O+CO=2HCO
B.在偏铝酸钠溶液中通入少量二氧化碳:
C.溶液中n(FeBr2)∶n(Cl2)=4∶5时: 4Fe2++5Cl2+6Br-= 4Fe3++10Cl-+3Br2
D.用石墨作阴极、铁作阳极电解食盐水:
14.下列叙述不正确的是( )
A.与电源正极相连的是电解槽的阴极 B.电子从电源负极沿导线流入电解槽的阴极
C.用电解法精炼粗铜时粗铜作阳极 D.铜锌原电池中铜是正极
15.镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是H2+NiOOH Ni(OH)2.根据此反应式判断,下列叙述正确的是( )
A.电池放电时,电池负极周围溶液的碱性增强 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被氧化 D.电池放电时,通入氢气的一极是负极或者氢气是负极反应物
16.MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果,其耦合系统原理示意图如图,下列说法错误的是( )
A.甲池中H+移动的方向从M室到N室 B.电子移动方向为a→Y,X→b
C.乙池的可在酸性较弱的环境中使用 D.Y 电极上得到双氧水的反应为 O2 + 2e- + 2H+ =H2O2
二、综合题(共4题)
17.为验证不同化合价铁的氧化还原能力,利用图中电池装置进行实验。
回答下列问题:
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据表中数据,图中盐桥中应选择_______作为电解质。
阳离子 u∞×108/(m2·s-1·V-1) 阴离子 u∞×108/(m2·s-1·V-1)
Li+ 4.07 4.61
Na+ 5.19 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 8.27
(2)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入_______(填写“铁”或“石墨”)电极溶液中。
(3)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=_______。
(4)根据(2)、(3)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了氧化性_______ >_______,还原性_______ >_______。
(5)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的操作是_______。
18.某小组以软锰矿、闪锌矿为原料,尝试在铁钉表面镀锌及制取高纯。流程如下:
已知:①矿粉的主要成分是、ZnS,还含有少量FeS、CuS、等。
②酸浸时反应之一:。该生产过程中,与不反应。
③的氧化性与溶液pH有关。
请回答:
(1)滤渣中加NaOH溶液可分离铁和铝,化学方程式是___________。
(2)下列说法正确的是___________(填字母)。
A.可从步骤③的滤渣中回收S B.步骤⑤,可换成
C.步骤⑥,阳极材料可选择Fe D.多次过滤分离,可提高矿石利用价值
(3)除杂时先加后加,原因是___________。
(4)小组同学欲用下列步骤测定铁钉表面镀层的锌的质量。请选出正确操作并排序(实验只进行一次,操作不重复):
称取一定质量的铁钉,放入烧杯中→(___________)→(___________)→(___________)→(___________)→(___________),_______________
a.加过量浓硫酸 b.加过量稀硫酸 c.置于坩埚中,小火烘干
d.置于石棉网上,小火烘干 e.取出,用蒸馏水洗涤 f.搅拌,至气泡速率突然减小
g.用电子天平称量 h.用托盘天平称量
(5)测定产品的纯度:将固体研细,称取一定质量的产品至锥形瓶中,依次加入过量固体、足量稀,振荡至充分反应,再用标准溶液滴定剩余至终点。
①下列关于实验过程的说法,正确的是___________(填字母)。
A.先在滤纸上称量好粉末,再倒入锥形瓶 B.配制溶液时宜在棕色容量瓶中进行
C.“振荡至充分反应”时,锥形瓶须加塞密封 D.滴定时的指示剂是
E.滴定终点后仰视读数,会导致纯度偏大
②读取滴定管中溶液的示数时,因溶液颜色的干扰,凹液面最低点无法准确定位,此时可改为读取___________处的示数。
(6)电解时的总化学方程式为___________。
19.有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中,B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
请回答下列问题:
(1)B的电子式为________________。
(2)画出元素M的原子结构示意图__________________________________________。
(3)物质X的化学式为____________________________________________________。
(4)电解混合液时阳极反应式为____________________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:
① 含有L元素的化合反应______________________________________________。
② 含有L元素的置换反应______________________________________________。
(6)已知 E气体在D中完全燃烧生成稳定的化合物时,放出kJ的热量,写出E燃烧热的热化学方程式__________________________________。
20.已知A、B、C、E的焰色反应均为黄色,其中B常作食品的膨化剂,A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。X为一种黑色固体单质,X也有多种同素异形体,其氧化物之一参与大气循环,为温室气体,G为冶炼铁的原料,G溶于盐酸中得到两种盐。A~H之间有如下的转化关系(部分物质未写出):
(1)写出物质的化学式:A______________;F______________。
(2)物质C的电子式为______________。
(3)写出G与稀硝酸反应的离子方程式:____________________________。
(4)已知D→G转化过程中,转移4 mol电子时释放出a kJ热量,写出该反应的热化学方程式:____________________________。
(5)科学家用物质X的一种同素异形体为电极,在酸性介质中用N2、H2为原料,采用电解原理制得NH3,写出电解池阴极的电极反应方程式:____________________。
参考答案
1.A
2.B
3.B
4.B
5.B
6.A
7.B
8.C
9.D
10.C
11.A
12.C
13.C
14.A
15.D
16.C
17.(1)KCl (2) 石墨 (3) 0.09mol/L
(4) Fe3++e-=Fe2+ Fe-2e-= Fe2+ Fe3+ Fe2+ Fe Fe2+
(5) 取少量活化后溶液,滴入KSCN溶液,若溶液未变红,证明活化反应完成
18.(1)
(2) BD
(3) 溶液酸性强有利于充分氧化、氧化时消耗可减少用量
(4) b→f→e→d→g
(5) BCD 凹液面最高点
(6)
19.(1) (2)
(3) (NH4)2Fe(SO4)2
(4) 4OH--4e-===O2↑+2H2O
(5) 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2O3+2Al2Fe+Al2O3
(6) H2(g)+O2(g)===H2O(l) ΔH=-kJ·mol-1
20.(1)NaOH Fe
(2)
(3) 3Fe3O4+28 H++9Fe3++NO↑+14H2O
(4) 3Fe(s)+2O2 (g)Fe3O4(s) ΔH= 2a kJ/mol
(5) N2+6H++6e 2NH3
