4.2.2 电解饱和食盐水课后强化习题(word版含答案)
文档属性
| 名称 | 4.2.2 电解饱和食盐水课后强化习题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 303.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-12 09:22:12 | ||
图片预览

文档简介
第二节第二课时 电解饱和食盐水课后强化习题
一、单选题(共16题)
1.下列解释工业生产或应用的化学方程式正确的是( )
A.氯碱工业制氯气:2NaCl(熔融)2Na+C12↑ B.利用磁铁矿冶炼铁:CO+FeOFe+CO2
C.工业制小苏打:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl D.工业制粗硅:C+SiO2Si+CO2↑
2.有关电化学原理的推断正确的是( )
A.金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-=4OH-
C.氯碱工业中,阳极发生的反应为:2Cl-–2e-=Cl2↑ D.镀锌铁皮的镀层部分损坏后,铁更容易腐蚀
3.下列关于工业生产说法正确的是( )
A.氯碱工业中的阳离子交换膜阻止阳离子通过
B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理
C.工业上均用电解熔融氧化物的方法制金属镁和铝
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
4.观察下列几个装置示意图,有关叙述不正确的是( )
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
5.下列说法正确的是( )
A.海水中含量最高的物质是氯化物
B.用红外光谱仪可以确定物质中是否存在某些有机原子团
C.科学研究证明,所有原子的原子核都由质子和中子构成,原子核都带正电荷
D.以电解盐酸为基础制取氯气等产品的工业称为“氯碱工业”
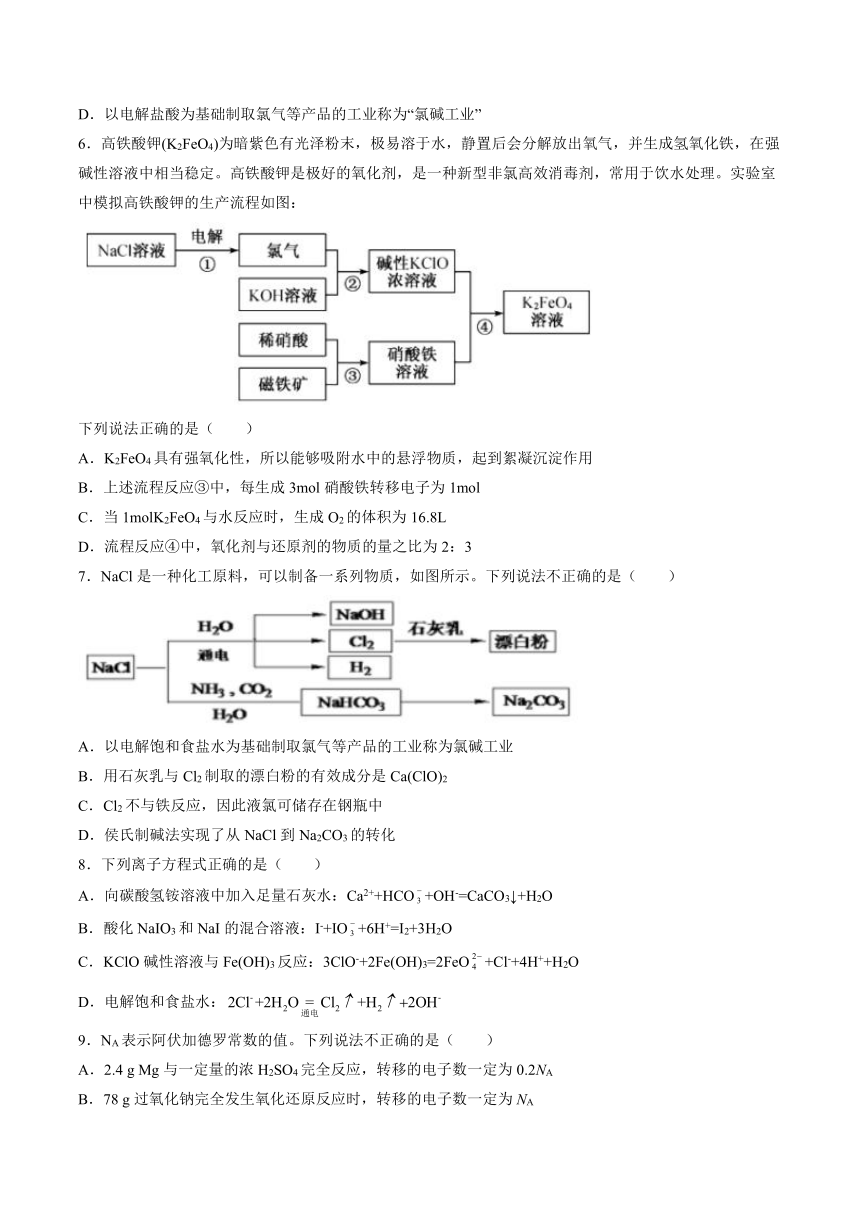
6.高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如图:
下列说法正确的是( )
A.K2FeO4具有强氧化性,所以能够吸附水中的悬浮物质,起到絮凝沉淀作用
B.上述流程反应③中,每生成3mol硝酸铁转移电子为1mol
C.当1molK2FeO4与水反应时,生成O2的体积为16.8L
D.流程反应④中,氧化剂与还原剂的物质的量之比为2:3
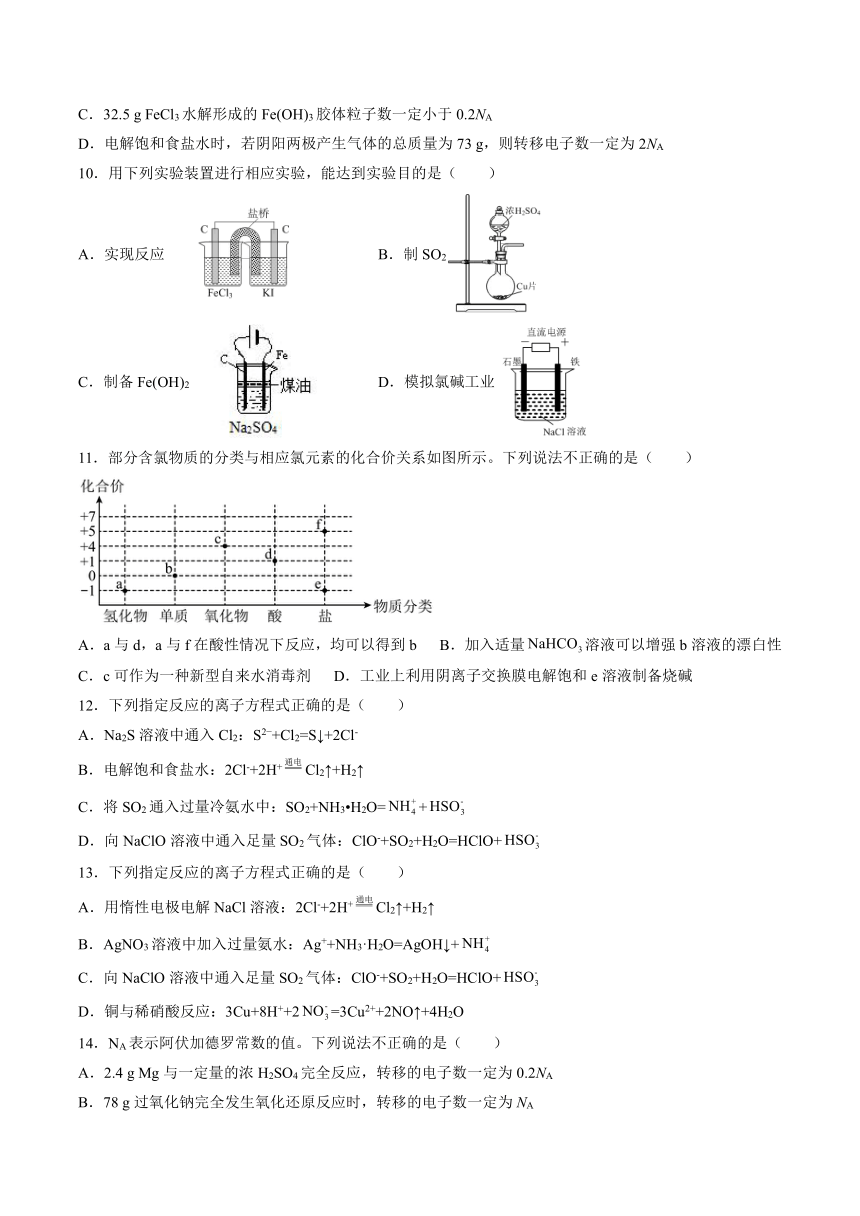
7.NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法不正确的是( )
A.以电解饱和食盐水为基础制取氯气等产品的工业称为氯碱工业
B.用石灰乳与Cl2制取的漂白粉的有效成分是Ca(ClO)2
C.Cl2不与铁反应,因此液氯可储存在钢瓶中
D.侯氏制碱法实现了从NaCl到Na2CO3的转化
8.下列离子方程式正确的是( )
A.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO+OH-=CaCO3↓+H2O
B.酸化NaIO3和NaI的混合溶液:I-+IO+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO+Cl-+4H++H2O
D.电解饱和食盐水:
9.NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.2.4 g Mg与一定量的浓H2SO4完全反应,转移的电子数一定为0.2NA
B.78 g过氧化钠完全发生氧化还原反应时,转移的电子数一定为NA
C.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数一定小于0.2NA
D.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数一定为2NA
10.用下列实验装置进行相应实验,能达到实验目的是( )
A.实现反应 B.制SO2
C.制备Fe(OH)2 D.模拟氯碱工业
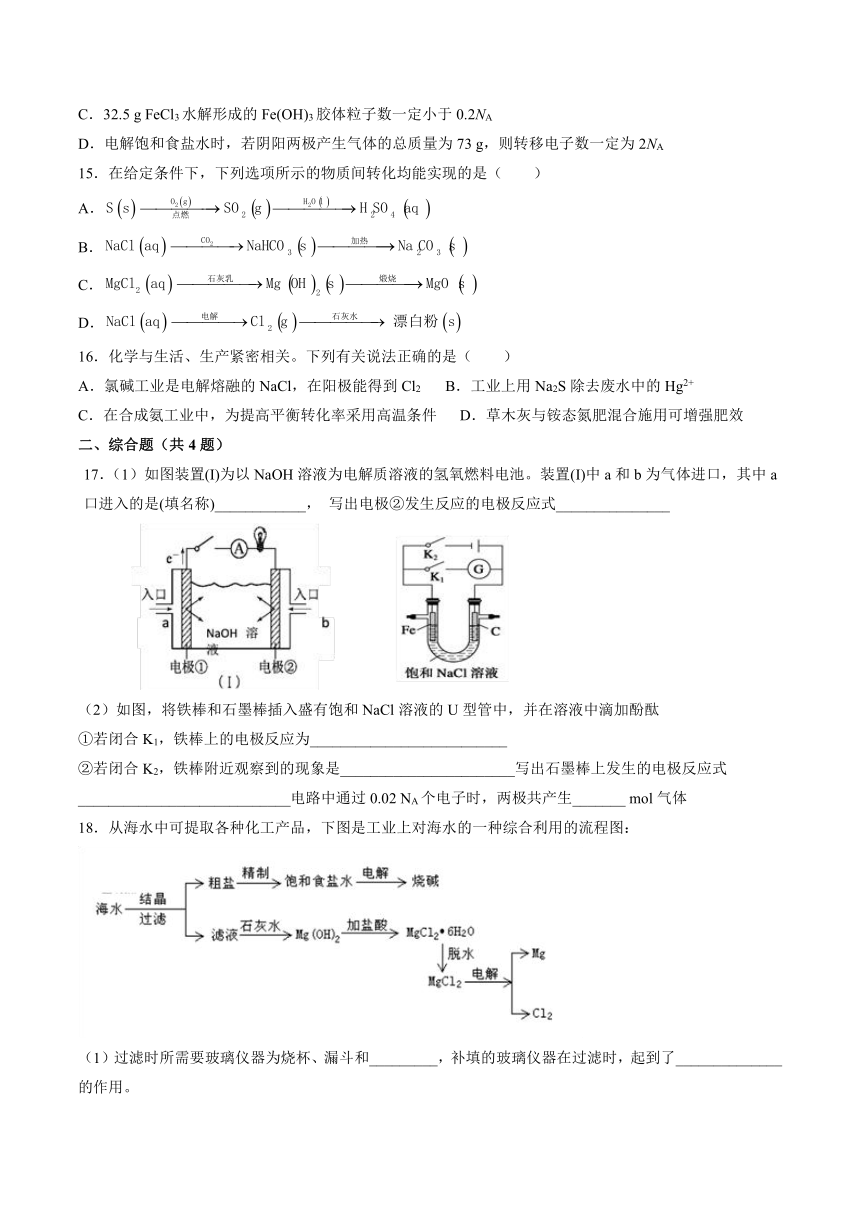
11.部分含氯物质的分类与相应氯元素的化合价关系如图所示。下列说法不正确的是( )
A.a与d,a与f在酸性情况下反应,均可以得到b B.加入适量溶液可以增强b溶液的漂白性
C.c可作为一种新型自来水消毒剂 D.工业上利用阴离子交换膜电解饱和e溶液制备烧碱
12.下列指定反应的离子方程式正确的是( )
A.Na2S溶液中通入Cl2:S2 +Cl2=S↓+2Cl-
B.电解饱和食盐水:2Cl-+2H+Cl2↑+H2↑
C.将SO2通入过量冷氨水中:SO2+NH3 H2O=+
D.向NaClO溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+
13.下列指定反应的离子方程式正确的是( )
A.用惰性电极电解NaCl溶液:2Cl-+2H+Cl2↑+H2↑
B.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+
C.向NaClO溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+
D.铜与稀硝酸反应:3Cu+8H++2=3Cu2++2NO↑+4H2O
14.NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.2.4 g Mg与一定量的浓H2SO4完全反应,转移的电子数一定为0.2NA
B.78 g过氧化钠完全发生氧化还原反应时,转移的电子数一定为NA
C.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数一定小于0.2NA
D.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数一定为2NA
15.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.
16.化学与生活、生产紧密相关。下列有关说法正确的是( )
A.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 B.工业上用Na2S除去废水中的Hg2+
C.在合成氨工业中,为提高平衡转化率采用高温条件 D.草木灰与铵态氮肥混合施用可增强肥效
二、综合题(共4题)
17.(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____________, 写出电极②发生反应的电极反应式_______________
(2)如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,并在溶液中滴加酚酞
①若闭合K1,铁棒上的电极反应为__________________________
②若闭合K2,铁棒附近观察到的现象是_______________________写出石墨棒上发生的电极反应式____________________________电路中通过0.02 NA个电子时,两极共产生_______ mol气体
18.从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________,补填的玻璃仪器在过滤时,起到了______________的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________;在铁棒周围的溶液里滴加酚酞溶液,溶液变________色。
(3)写出电解饱和食盐水的化学方程式:____________________________。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
配料 氯化钠(NaCl)、碘酸钾(KIO3)
含碘量 20~40 mg·kg-1
保质期 18个月
食用方法 勿长时间炖炒
贮藏指南 避热、避光、密封、防潮
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__mol,该“加碘食盐”的含碘量为__mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为_________mol·L-1。
19.已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1molB隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。
请回答下列题:
(1)B的化学式为________;H的结构式为________
(2)电解A溶液的离子方程式为______________________________________
(3)D与E反应可制得一种重要的化工原料,其反应的现象是____________________________
(4)F与G反应的化学方程式为________________________________
20.下图每一方框中的字母代表一种反应物或生成物:
物质A跟B反应生成物质E、F和G;物质C跟D反应生成气体I,I中含有植物生长必须的元素之一,请填写下列空白:
(1)物质H的分子式是___________,气体I的分子式是____________
(2)写出电解饱和食盐水的化学方程式,并标出电子转移的方向和数目。
___________________________________________该反应中的还原剂是___________
(3)反应①的化学方程式是_________________________________________。
参考答案
1.C
2.C
3.D
4.B
5.B
6.B
7.C
8.D
9.B
10.A
11.D
12.A
13.D
14. B
15. C
16. B
17.(1)氢气 O2 +4eˉ+ 2H2O=4 OHˉ
(2) Fe -2eˉ=Fe2+ 产生气泡、变红色 2 Clˉ-2eˉ=Cl2 0.02mol
18.(1)玻璃棒 引流
(2) 氯气(或Cl2) 红
(3) 2NaCl+2H2O C12↑+ H2↑+2NaOH
(4) 0.0002 25.4 1×10-5
19.(1)FeC2O4 O=C=O
(2) 2Cl-+2H2OH2↑+Cl2↑+2OH-
(3) 苍白色火焰,放出大量热
(4) FeO+COFe+CO2
20.(1)HCl NH3
(2) NaCl
(3) Cl2+2NaOH = NaCl+NaClO+H2O
一、单选题(共16题)
1.下列解释工业生产或应用的化学方程式正确的是( )
A.氯碱工业制氯气:2NaCl(熔融)2Na+C12↑ B.利用磁铁矿冶炼铁:CO+FeOFe+CO2
C.工业制小苏打:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl D.工业制粗硅:C+SiO2Si+CO2↑
2.有关电化学原理的推断正确的是( )
A.金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-=4OH-
C.氯碱工业中,阳极发生的反应为:2Cl-–2e-=Cl2↑ D.镀锌铁皮的镀层部分损坏后,铁更容易腐蚀
3.下列关于工业生产说法正确的是( )
A.氯碱工业中的阳离子交换膜阻止阳离子通过
B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理
C.工业上均用电解熔融氧化物的方法制金属镁和铝
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
4.观察下列几个装置示意图,有关叙述不正确的是( )
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
5.下列说法正确的是( )
A.海水中含量最高的物质是氯化物
B.用红外光谱仪可以确定物质中是否存在某些有机原子团
C.科学研究证明,所有原子的原子核都由质子和中子构成,原子核都带正电荷
D.以电解盐酸为基础制取氯气等产品的工业称为“氯碱工业”
6.高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如图:
下列说法正确的是( )
A.K2FeO4具有强氧化性,所以能够吸附水中的悬浮物质,起到絮凝沉淀作用
B.上述流程反应③中,每生成3mol硝酸铁转移电子为1mol
C.当1molK2FeO4与水反应时,生成O2的体积为16.8L
D.流程反应④中,氧化剂与还原剂的物质的量之比为2:3
7.NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法不正确的是( )
A.以电解饱和食盐水为基础制取氯气等产品的工业称为氯碱工业
B.用石灰乳与Cl2制取的漂白粉的有效成分是Ca(ClO)2
C.Cl2不与铁反应,因此液氯可储存在钢瓶中
D.侯氏制碱法实现了从NaCl到Na2CO3的转化
8.下列离子方程式正确的是( )
A.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO+OH-=CaCO3↓+H2O
B.酸化NaIO3和NaI的混合溶液:I-+IO+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO+Cl-+4H++H2O
D.电解饱和食盐水:
9.NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.2.4 g Mg与一定量的浓H2SO4完全反应,转移的电子数一定为0.2NA
B.78 g过氧化钠完全发生氧化还原反应时,转移的电子数一定为NA
C.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数一定小于0.2NA
D.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数一定为2NA
10.用下列实验装置进行相应实验,能达到实验目的是( )
A.实现反应 B.制SO2
C.制备Fe(OH)2 D.模拟氯碱工业
11.部分含氯物质的分类与相应氯元素的化合价关系如图所示。下列说法不正确的是( )
A.a与d,a与f在酸性情况下反应,均可以得到b B.加入适量溶液可以增强b溶液的漂白性
C.c可作为一种新型自来水消毒剂 D.工业上利用阴离子交换膜电解饱和e溶液制备烧碱
12.下列指定反应的离子方程式正确的是( )
A.Na2S溶液中通入Cl2:S2 +Cl2=S↓+2Cl-
B.电解饱和食盐水:2Cl-+2H+Cl2↑+H2↑
C.将SO2通入过量冷氨水中:SO2+NH3 H2O=+
D.向NaClO溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+
13.下列指定反应的离子方程式正确的是( )
A.用惰性电极电解NaCl溶液:2Cl-+2H+Cl2↑+H2↑
B.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+
C.向NaClO溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+
D.铜与稀硝酸反应:3Cu+8H++2=3Cu2++2NO↑+4H2O
14.NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.2.4 g Mg与一定量的浓H2SO4完全反应,转移的电子数一定为0.2NA
B.78 g过氧化钠完全发生氧化还原反应时,转移的电子数一定为NA
C.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数一定小于0.2NA
D.电解饱和食盐水时,若阴阳两极产生气体的总质量为73 g,则转移电子数一定为2NA
15.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.
16.化学与生活、生产紧密相关。下列有关说法正确的是( )
A.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 B.工业上用Na2S除去废水中的Hg2+
C.在合成氨工业中,为提高平衡转化率采用高温条件 D.草木灰与铵态氮肥混合施用可增强肥效
二、综合题(共4题)
17.(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____________, 写出电极②发生反应的电极反应式_______________
(2)如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,并在溶液中滴加酚酞
①若闭合K1,铁棒上的电极反应为__________________________
②若闭合K2,铁棒附近观察到的现象是_______________________写出石墨棒上发生的电极反应式____________________________电路中通过0.02 NA个电子时,两极共产生_______ mol气体
18.从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________,补填的玻璃仪器在过滤时,起到了______________的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________;在铁棒周围的溶液里滴加酚酞溶液,溶液变________色。
(3)写出电解饱和食盐水的化学方程式:____________________________。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
配料 氯化钠(NaCl)、碘酸钾(KIO3)
含碘量 20~40 mg·kg-1
保质期 18个月
食用方法 勿长时间炖炒
贮藏指南 避热、避光、密封、防潮
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__mol,该“加碘食盐”的含碘量为__mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为_________mol·L-1。
19.已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1molB隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。
请回答下列题:
(1)B的化学式为________;H的结构式为________
(2)电解A溶液的离子方程式为______________________________________
(3)D与E反应可制得一种重要的化工原料,其反应的现象是____________________________
(4)F与G反应的化学方程式为________________________________
20.下图每一方框中的字母代表一种反应物或生成物:
物质A跟B反应生成物质E、F和G;物质C跟D反应生成气体I,I中含有植物生长必须的元素之一,请填写下列空白:
(1)物质H的分子式是___________,气体I的分子式是____________
(2)写出电解饱和食盐水的化学方程式,并标出电子转移的方向和数目。
___________________________________________该反应中的还原剂是___________
(3)反应①的化学方程式是_________________________________________。
参考答案
1.C
2.C
3.D
4.B
5.B
6.B
7.C
8.D
9.B
10.A
11.D
12.A
13.D
14. B
15. C
16. B
17.(1)氢气 O2 +4eˉ+ 2H2O=4 OHˉ
(2) Fe -2eˉ=Fe2+ 产生气泡、变红色 2 Clˉ-2eˉ=Cl2 0.02mol
18.(1)玻璃棒 引流
(2) 氯气(或Cl2) 红
(3) 2NaCl+2H2O C12↑+ H2↑+2NaOH
(4) 0.0002 25.4 1×10-5
19.(1)FeC2O4 O=C=O
(2) 2Cl-+2H2OH2↑+Cl2↑+2OH-
(3) 苍白色火焰,放出大量热
(4) FeO+COFe+CO2
20.(1)HCl NH3
(2) NaCl
(3) Cl2+2NaOH = NaCl+NaClO+H2O
