4.2.3 电镀课后强化习题(word版含答案)
文档属性
| 名称 | 4.2.3 电镀课后强化习题(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 681.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-12 09:22:19 | ||
图片预览




文档简介
第二节第三课时 电镀课后强化习题
一、单选题(共17题)
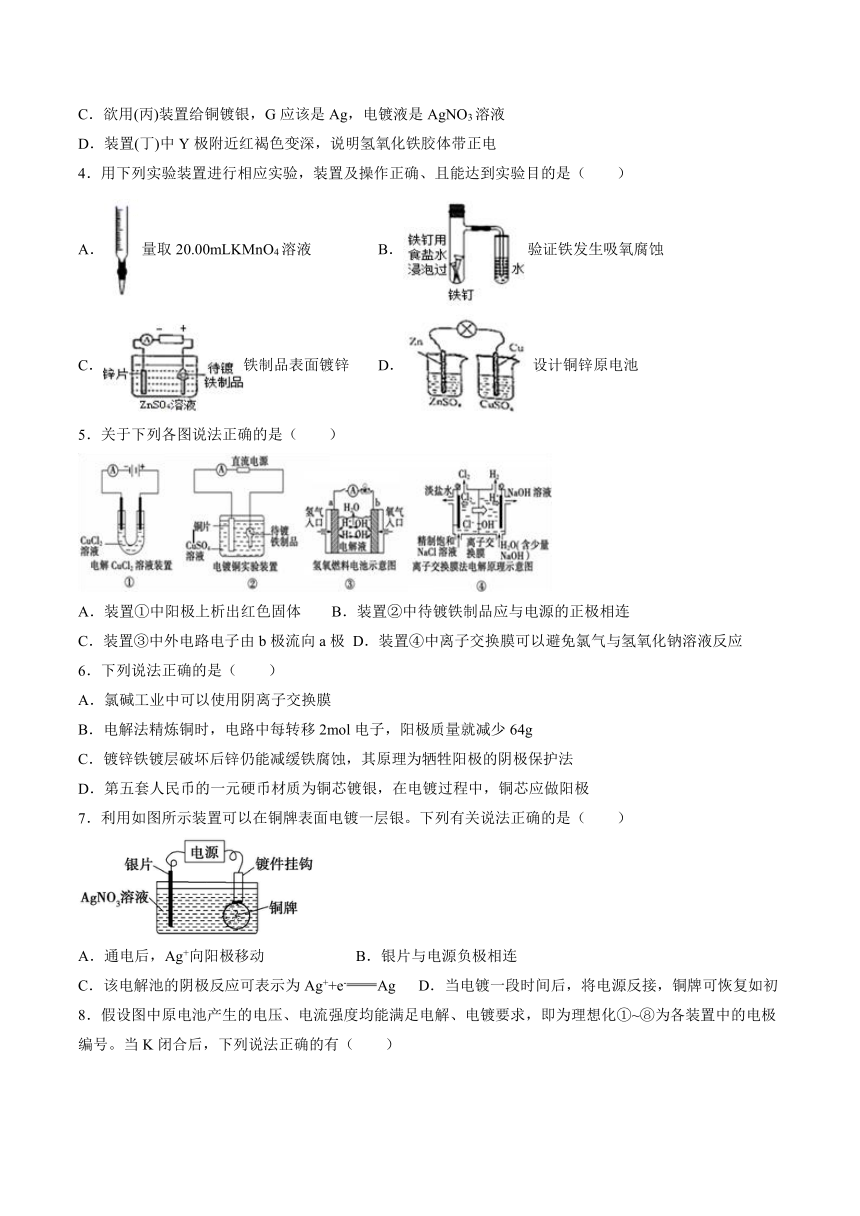
1.下列说法正确的是( )
A.装置①中,反应开始时,Al是负极,且在NaCl溶液中生成红棕色气体
B.装置②在电解过程中,a极附近溶液变红
C.可以用装置③在铁上镀铜,d极为铜,c极为铁
D.装置④中发生铁的吸氧腐蚀
2.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.铁片上镀铜时,Y是纯铜
B.制取金属镁时,Z是熔融的氯化镁
C.电解精炼铜时,Z溶液中的Cu2+浓度不变
D.电解饱和食盐水时,X极的电极反应式为4OH--4e-=2H2O+O2↑
3.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法不正确的是( )
A.电源A极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶体带正电
4.用下列实验装置进行相应实验,装置及操作正确、且能达到实验目的是( )
A.量取20.00mLKMnO4溶液 B.验证铁发生吸氧腐蚀
C.铁制品表面镀锌 D.设计铜锌原电池
5.关于下列各图说法正确的是( )
A.装置①中阳极上析出红色固体 B.装置②中待镀铁制品应与电源的正极相连
C.装置③中外电路电子由b极流向a极 D.装置④中离子交换膜可以避免氯气与氢氧化钠溶液反应
6.下列说法正确的是( )
A.氯碱工业中可以使用阴离子交换膜
B.电解法精炼铜时,电路中每转移2mol电子,阳极质量就减少64g
C.镀锌铁镀层破坏后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法
D.第五套人民币的一元硬币材质为铜芯镀银,在电镀过程中,铜芯应做阳极
7.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,Ag+向阳极移动 B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-Ag D.当电镀一段时间后,将电源反接,铜牌可恢复如初
8.假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )
①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→③;⑦→⑥;⑤→④
③装置原理上是一个电镀池(Ag表面镀Cu),其中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A.①② B.③④ C.②③④ D.①②④
9.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝 B.在镀件上电镀锌,用锌作阳极
C.电解法精炼粗铜,用纯铜作阳极 D.电解饱和食盐水制烧碱,阳极室产生氯气
10.下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧碱性燃料电池的负极反应式:O2+2H2O+4e-4OH-
B.粗铜精炼时与电源正极相连的是纯铜,主要电极反应式:Cu-2e-=Cu2+
C.钢铁发生电化学腐蚀的负极反应式:Fe-3e-Fe3+
D.钢闸门应与外接电源的负极相连,起保护作用
11.某化学小组进行电化学研究,甲同学设计如图所示装置,乙同学利用甲同学的装置和桌面上其他的药品与材料,不能完成的实验是( )
A.使甲同学装置中的正极变为负极 B.设计一个新的原电池
C.在石墨电极上镀锌 D.使锌电极受到保护
12.假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
A.当K闭合后,B装置在电路中做电源
B.当K闭合后,C装置中银片质量增加
C.当K闭合后,整个电路中电子的流动方向为③→②;①→⑧;⑦→⑥;⑤→④
D.当K闭合后,保持温度不变,A、B装置pH均变大,D装置中CuCl2溶液的浓度保持不变
13.若要在铜片上镀银时,下列叙述中正确的是( )
①将铜片接在电源的负极 ②将银片接在电源的负极
③在铜片上发生的反应是Ag++e-=Ag ④在银片上发生的反应是4OH--4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质溶液 ⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥
C.①④⑤ D.②③④
14.化学是一门以实验为基础的学科,掌握基本实验方法和操作技能是做好化学实验的基础。关于下列叙述中,正确的是( )
A.用玻璃棒蘸取0.lmo/LNaOH溶液滴在湿润的pH试纸中央,与标准比色卡对比,读出pH为13
B.贮存FeCl3溶液,要在溶液中加入少量硫酸
C.向1mL0.1mo/LMgCl2溶液中滴加1mL0.2mol/LNaOH溶液,产生白色沉淀,再滴加2滴0.lmol/LFeCl3溶液,白色沉淀再变为红褐色
D.电镀铜实验时,应该把待镀铁制品与电源正极相连
15.下列电化学装置正确且能达到目的的是( )
A.用装置甲在铁制品表面镀铜 B.用装置乙电解精炼铜
C.用装置丙制备NaOH和氯气 D.用装置丁保护钢闸门
16.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法不正确的是( )
A.燃料电池工作时,正极反应为O2+4H++4e﹣=2H2O
B.a极是铜,b极是铁时,可实现铁上镀铜
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出的铜质量相等
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积不相同
17.设阿伏加德罗常数的值为NA,下列说法正确的是( )
A.0.1mol氧气与2.3g金属钠充分反应,转移的电子数为0.4NA
B.电镀铜时,镀件上质量增加6.4g时,转移的电子数为0.2NA
C.将0.1mol乙烷和0.1molCl2混合光照,生成一氯乙烷的分子数为0.1NA
D.0.2mol/L的NaAlO2溶液中的数目小于0.2NA
二、综合题(共4题)
18.硫及其化合物与人类生产、生活密切相关。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
则a___(填“>”或“<”)b。
(2)在一定温度和压强下,将2molSO2和1molO2置于密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),并达到平衡。
①若再加入1 molO2,该平衡向___(填“正”或“逆”)反应方向移动;
②若降低温度,达到平衡时测得SO2的含量减少,则正反应是___(填“吸热”或“放热”)反应;
③该反应的化学平衡常数表达式K=___。若只增大压强,则K__(填“增大”“减小”或“不变”)。
(3)常温下,现有0.5mol·L-1Na2SO3溶液,请判断:(Na2SO3第一步水解的离子方程式是SO32-+H2OHSO3-+OH-)
①该溶液的pH___(填“>”或“<”)7;
②该溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③盐类水解反应是吸热反应。加热该溶液,SO32-的浓度将__(填“增大”或“减小”)。
(4)如图是电解硫酸铜溶液的装置。
①若a、b为石墨电极,b电极的质量增加,写出该极的电极反应式:___;
②电镀是电解原理的一种重要应用。若利用该装置在铁件上镀铜,则铁件应与电源的__ (填“正极”或“负极”)连接。
(5)已知硫酸钡的沉淀溶解平衡为:BaSO4(s)Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
19.Ni常被镀在金属制品上以保护金属不生锈。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni ++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________,加热温度不宜过高的原因是________________________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀 ____________(列式计算,并使用必要的文字说明)。
20.次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
据此回答下列问题:
(1)红磷与黄磷之间的关系为___________。
(2)次磷酸钠中磷元素的化合价为___________。
(3)写出碱溶过程的化学反应方程式___________,该反应中氧化剂与还原剂物质的量之比为___________。
(4)已知次磷酸钠中的为四面体结构,请写出的结构式___________,次磷酸钠NaH2PO2为___________填“酸式盐”、“碱式盐”、“正盐”。
(5)请简述化学镀镍的反应原理___________。
21.NiSO4·XH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如图:
(1)在待镀件上镀镍时,待镀件应作___极,电镀过程中电解质溶液浓度_____(填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质。已知FeS难溶解于水,利用溶解平衡移动原理解释加入FeS前调pH的原因____(请用化学用语结合文字说明);当Zn2+恰好沉淀完全时,c(Zn2+)=10-5mol/L,则c(Cu2+)=_____mol/L[已知Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.6×10-24]。
(3)滤液Ⅲ溶质的主要成分是NiSO4,流程中在滤液Ⅲ后又设计了两步,再次得到NiSO4溶液,这样设计流程的目的是_______。
(4)为测定NiSO4 xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于____。
参考答案
1.C
2.B
3.D
4.B
5.D
6.C
7.C
8.A
9.C
10.D
11.C
12.D
13.A
14.C
15.B
16.C
17. B
18.(1)<
(2) 正 放热 或 不变
(3) > > 减小
(4) Cu2++2e-=Cu 负极
(5) 1.0×10-5
19.(1)负极 2、1、1H2O、2、1、2H+
(2) 4Ni(OH)2+4LiOH+O24LiNiO2+6H2O
防止温度高于850℃时LiNiO2分解 产生氮氧化物,污染环境
(3) 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。
20.(1)同素异形体
(2) +1
(3) P4+3NaOH+3H2O=3NaH2PO2+PH3↑ 1:3
(4) 正盐
(5) 次磷酸钠作为还原剂将硫酸镍中的镍还原成金属单质,沉积在镀件表面。
21.(1)阴 不变
(2) FeS(s)Fe2+(aq)+ S2-(aq),若不调pH,在酸性溶液中将发生S2-+2H+=H2S↑,促进FeS溶解,生成 H2S气体;H2S有毒,会造成污染,且浪费原料,也不能完全除去Zn2+等杂质 8.1×10-18
(3) 增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)
(4) 6
一、单选题(共17题)
1.下列说法正确的是( )
A.装置①中,反应开始时,Al是负极,且在NaCl溶液中生成红棕色气体
B.装置②在电解过程中,a极附近溶液变红
C.可以用装置③在铁上镀铜,d极为铜,c极为铁
D.装置④中发生铁的吸氧腐蚀
2.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.铁片上镀铜时,Y是纯铜
B.制取金属镁时,Z是熔融的氯化镁
C.电解精炼铜时,Z溶液中的Cu2+浓度不变
D.电解饱和食盐水时,X极的电极反应式为4OH--4e-=2H2O+O2↑
3.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法不正确的是( )
A.电源A极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶体带正电
4.用下列实验装置进行相应实验,装置及操作正确、且能达到实验目的是( )
A.量取20.00mLKMnO4溶液 B.验证铁发生吸氧腐蚀
C.铁制品表面镀锌 D.设计铜锌原电池
5.关于下列各图说法正确的是( )
A.装置①中阳极上析出红色固体 B.装置②中待镀铁制品应与电源的正极相连
C.装置③中外电路电子由b极流向a极 D.装置④中离子交换膜可以避免氯气与氢氧化钠溶液反应
6.下列说法正确的是( )
A.氯碱工业中可以使用阴离子交换膜
B.电解法精炼铜时,电路中每转移2mol电子,阳极质量就减少64g
C.镀锌铁镀层破坏后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法
D.第五套人民币的一元硬币材质为铜芯镀银,在电镀过程中,铜芯应做阳极
7.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,Ag+向阳极移动 B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-Ag D.当电镀一段时间后,将电源反接,铜牌可恢复如初
8.假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )
①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→③;⑦→⑥;⑤→④
③装置原理上是一个电镀池(Ag表面镀Cu),其中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A.①② B.③④ C.②③④ D.①②④
9.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝 B.在镀件上电镀锌,用锌作阳极
C.电解法精炼粗铜,用纯铜作阳极 D.电解饱和食盐水制烧碱,阳极室产生氯气
10.下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧碱性燃料电池的负极反应式:O2+2H2O+4e-4OH-
B.粗铜精炼时与电源正极相连的是纯铜,主要电极反应式:Cu-2e-=Cu2+
C.钢铁发生电化学腐蚀的负极反应式:Fe-3e-Fe3+
D.钢闸门应与外接电源的负极相连,起保护作用
11.某化学小组进行电化学研究,甲同学设计如图所示装置,乙同学利用甲同学的装置和桌面上其他的药品与材料,不能完成的实验是( )
A.使甲同学装置中的正极变为负极 B.设计一个新的原电池
C.在石墨电极上镀锌 D.使锌电极受到保护
12.假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
A.当K闭合后,B装置在电路中做电源
B.当K闭合后,C装置中银片质量增加
C.当K闭合后,整个电路中电子的流动方向为③→②;①→⑧;⑦→⑥;⑤→④
D.当K闭合后,保持温度不变,A、B装置pH均变大,D装置中CuCl2溶液的浓度保持不变
13.若要在铜片上镀银时,下列叙述中正确的是( )
①将铜片接在电源的负极 ②将银片接在电源的负极
③在铜片上发生的反应是Ag++e-=Ag ④在银片上发生的反应是4OH--4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质溶液 ⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥
C.①④⑤ D.②③④
14.化学是一门以实验为基础的学科,掌握基本实验方法和操作技能是做好化学实验的基础。关于下列叙述中,正确的是( )
A.用玻璃棒蘸取0.lmo/LNaOH溶液滴在湿润的pH试纸中央,与标准比色卡对比,读出pH为13
B.贮存FeCl3溶液,要在溶液中加入少量硫酸
C.向1mL0.1mo/LMgCl2溶液中滴加1mL0.2mol/LNaOH溶液,产生白色沉淀,再滴加2滴0.lmol/LFeCl3溶液,白色沉淀再变为红褐色
D.电镀铜实验时,应该把待镀铁制品与电源正极相连
15.下列电化学装置正确且能达到目的的是( )
A.用装置甲在铁制品表面镀铜 B.用装置乙电解精炼铜
C.用装置丙制备NaOH和氯气 D.用装置丁保护钢闸门
16.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法不正确的是( )
A.燃料电池工作时,正极反应为O2+4H++4e﹣=2H2O
B.a极是铜,b极是铁时,可实现铁上镀铜
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出的铜质量相等
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积不相同
17.设阿伏加德罗常数的值为NA,下列说法正确的是( )
A.0.1mol氧气与2.3g金属钠充分反应,转移的电子数为0.4NA
B.电镀铜时,镀件上质量增加6.4g时,转移的电子数为0.2NA
C.将0.1mol乙烷和0.1molCl2混合光照,生成一氯乙烷的分子数为0.1NA
D.0.2mol/L的NaAlO2溶液中的数目小于0.2NA
二、综合题(共4题)
18.硫及其化合物与人类生产、生活密切相关。
(1)已知:S(s)+O2(g)= SO2(g) ΔH1=-a kJ·mol-1
S(g)+O2(g)= SO2(g) ΔH2=- b kJ·mol-1
则a___(填“>”或“<”)b。
(2)在一定温度和压强下,将2molSO2和1molO2置于密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),并达到平衡。
①若再加入1 molO2,该平衡向___(填“正”或“逆”)反应方向移动;
②若降低温度,达到平衡时测得SO2的含量减少,则正反应是___(填“吸热”或“放热”)反应;
③该反应的化学平衡常数表达式K=___。若只增大压强,则K__(填“增大”“减小”或“不变”)。
(3)常温下,现有0.5mol·L-1Na2SO3溶液,请判断:(Na2SO3第一步水解的离子方程式是SO32-+H2OHSO3-+OH-)
①该溶液的pH___(填“>”或“<”)7;
②该溶液中c(Na+)___(填“>”或“<”)2c(SO32-);
③盐类水解反应是吸热反应。加热该溶液,SO32-的浓度将__(填“增大”或“减小”)。
(4)如图是电解硫酸铜溶液的装置。
①若a、b为石墨电极,b电极的质量增加,写出该极的电极反应式:___;
②电镀是电解原理的一种重要应用。若利用该装置在铁件上镀铜,则铁件应与电源的__ (填“正极”或“负极”)连接。
(5)已知硫酸钡的沉淀溶解平衡为:BaSO4(s)Ba2+(aq)+SO42-(aq) Ksp=1.0×10-10。在硫酸钡的饱和溶液中Ba2+的浓度为____mol·L-1。
19.Ni常被镀在金属制品上以保护金属不生锈。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni ++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________,加热温度不宜过高的原因是________________________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀 ____________(列式计算,并使用必要的文字说明)。
20.次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
据此回答下列问题:
(1)红磷与黄磷之间的关系为___________。
(2)次磷酸钠中磷元素的化合价为___________。
(3)写出碱溶过程的化学反应方程式___________,该反应中氧化剂与还原剂物质的量之比为___________。
(4)已知次磷酸钠中的为四面体结构,请写出的结构式___________,次磷酸钠NaH2PO2为___________填“酸式盐”、“碱式盐”、“正盐”。
(5)请简述化学镀镍的反应原理___________。
21.NiSO4·XH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如图:
(1)在待镀件上镀镍时,待镀件应作___极,电镀过程中电解质溶液浓度_____(填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质。已知FeS难溶解于水,利用溶解平衡移动原理解释加入FeS前调pH的原因____(请用化学用语结合文字说明);当Zn2+恰好沉淀完全时,c(Zn2+)=10-5mol/L,则c(Cu2+)=_____mol/L[已知Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.6×10-24]。
(3)滤液Ⅲ溶质的主要成分是NiSO4,流程中在滤液Ⅲ后又设计了两步,再次得到NiSO4溶液,这样设计流程的目的是_______。
(4)为测定NiSO4 xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于____。
参考答案
1.C
2.B
3.D
4.B
5.D
6.C
7.C
8.A
9.C
10.D
11.C
12.D
13.A
14.C
15.B
16.C
17. B
18.(1)<
(2) 正 放热 或 不变
(3) > > 减小
(4) Cu2++2e-=Cu 负极
(5) 1.0×10-5
19.(1)负极 2、1、1H2O、2、1、2H+
(2) 4Ni(OH)2+4LiOH+O24LiNiO2+6H2O
防止温度高于850℃时LiNiO2分解 产生氮氧化物,污染环境
(3) 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。
20.(1)同素异形体
(2) +1
(3) P4+3NaOH+3H2O=3NaH2PO2+PH3↑ 1:3
(4) 正盐
(5) 次磷酸钠作为还原剂将硫酸镍中的镍还原成金属单质,沉积在镀件表面。
21.(1)阴 不变
(2) FeS(s)Fe2+(aq)+ S2-(aq),若不调pH,在酸性溶液中将发生S2-+2H+=H2S↑,促进FeS溶解,生成 H2S气体;H2S有毒,会造成污染,且浪费原料,也不能完全除去Zn2+等杂质 8.1×10-18
(3) 增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)
(4) 6
