3.1构成物质的基本微粒-2021-2022学年九年级化学沪教版上册(共26张PPT)
文档属性
| 名称 | 3.1构成物质的基本微粒-2021-2022学年九年级化学沪教版上册(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-13 17:43:26 | ||
图片预览





文档简介
(共26张PPT)
构成物质的奥秘
任务一:合作探究
原子的结构
谁通过α粒子散射实验(轰击金箔实验)进一步探究了原子的结构?
原子由原子核和电子构成,原子核在原子中所占体积最小,但却几乎集中了原子的全部质量.
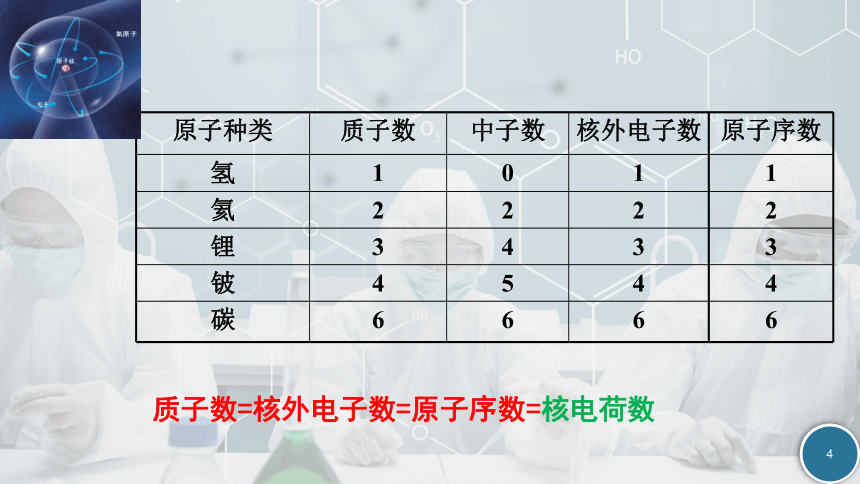
原子种类 质子数 中子数 核外电子数 原子序数
氢 1 0 1 1
氦 2 2 2 2
锂 3 4 3 3
铍 4 5 4 4
碳 6 6 6 6
质子数=核外电子数=原子序数=核电荷数
角色扮演-我是原子
以小组为单位展示原子结构。
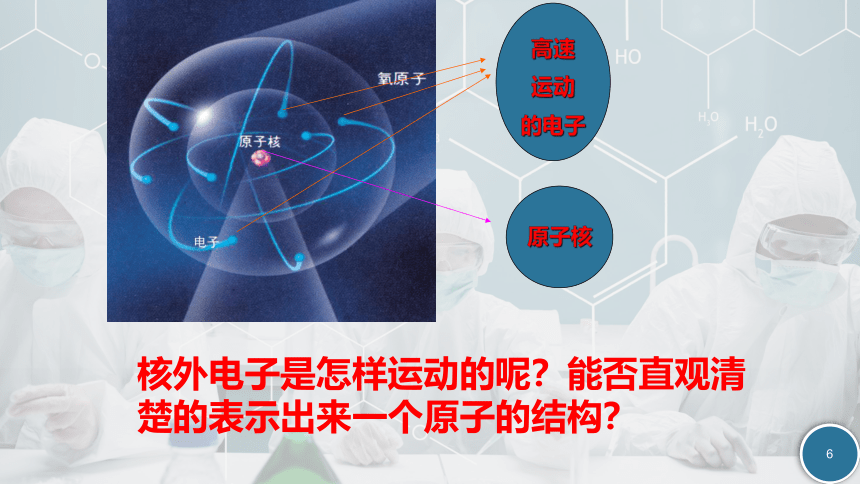
核外电子是怎样运动的呢?能否直观清楚的表示出来一个原子的结构?
原子核
高速
运动
的电子
圆圈表示 ,11表示 ,
+表示 , 弧线表示 ,
弧线上的数字2、8、1分别表示 。
原子结构示意图:
原子结构示意图(直观清晰的表示原子结构):
原子核
质子数
质子带正电
电子层
核外第1层上有2个电子,第二层上有8个电子,第三层(最外层)上有1个电子。
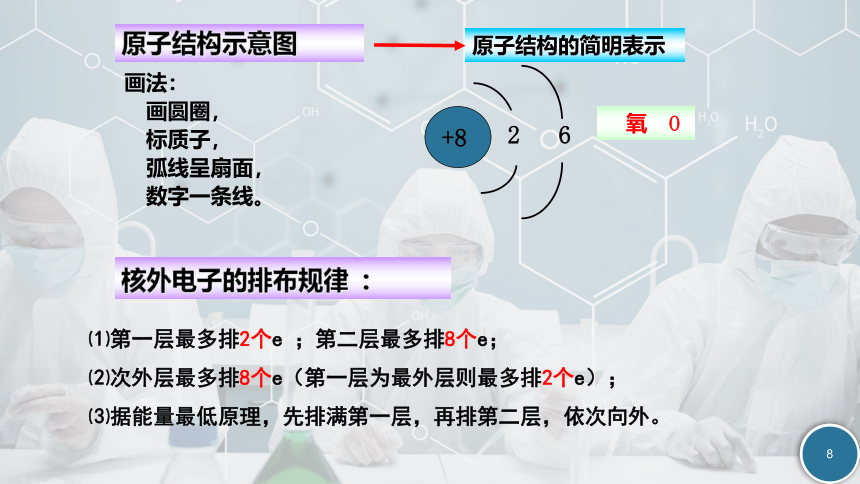
核外电子的排布规律 :
⑴第一层最多排2个e ;第二层最多排8个e;
⑵次外层最多排8个e(第一层为最外层则最多排2个e);
⑶据能量最低原理,先排满第一层,再排第二层,依次向外。
原子结构的简明表示
原子结构示意图
画法:
画圆圈,
标质子,
弧线呈扇面,
数字一条线。
+8
2 6
氧 O
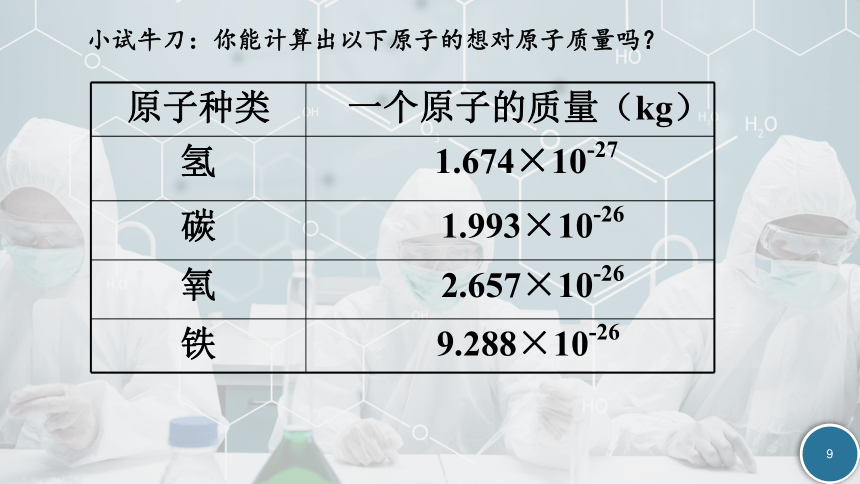
小试牛刀:你能计算出以下原子的想对原子质量吗?
原子种类 一个原子的质量(kg)
氢 1.674×10-27
碳 1.993×10-26
氧 2.657×10-26
铁 9.288×10-26
相对原子质量
=
1个原子质量
1个碳原子质量×1/12
(2)相对原子质量的计算公式
(1)概念:
1.相对原子质量(Ar)
以一种碳原子的质量的1/12 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。
相对原子质量是个比值,单位是 1
任务三:相对原子质量及相对分子质量
原子种类 一个原子的质量(Kg)
氢 1.674×10-27
碳 1.993×10-26
氧 2.657×10-26
铁 9.288×10-26
原子质量主要集中在哪里?
相对原子质量=质子数+中子数
粒子种类 电性 质量
质子 一个单位正电荷 1.6726*10-27kg
中子 不带电 1.6749*10-27kg
电子 一个单位负电荷 质子质量的1/1836
请口算出以下原子的相对原子质量
2.相对分子质量(Mr)
已知:H:1、O:16、C:12
那么,CO2 、H2O 的相对分子质量是多少呢 ?
+1 1
+2 2
+3 2 1
+4 2 2
+5 2 3
+6 2 4
+7 2 5
+8 2 6
+9 2 7
+10 2 8
+11 2 8 1
+12 2 8 2
+13 2 8 3
+14 2 8 4
+15 2 8 5
+16 2 8 6
+17 2 8 7
+18 2 8 8
氢H
氦He
锂Li
铍Be
硼B
碳C
氮N
氧O
氟F
氖Ne
钠Na
镁Mg
铝Al
硅Si
磷P
硫S
氯Cl
氩Ar
第一周期
第二周期
第三周期
+1 1
+2 2
+3 2 1
+4 2 2
+5 2 3
+6 2 4
+7 2 5
+8 2 6
+9 2 7
+10 2 8
+11 2 8 1
+12 2 8 2
+13 2 8 3
+14 2 8 4
+15 2 8 5
+16 2 8 6
+17 2 8 7
+18 2 8 8
氢H
氦He
锂Li
铍Be
硼B
碳C
氮N
氧O
氟F
氖Ne
钠Na
镁Mg
铝Al
硅Si
磷P
硫S
氯Cl
氩Ar
稀有气体元素
稳定结构
不稳定结构
金属元素
非金属元素
元素的化学性质与原子最外层电子数相关,不同原子最外层电子数相同化学性质相似
1、指出下列哪几种原子的化学性质相似
A
B
E
C
D
2、化学性质比较相似的是 。
A B C
+10 2 8
+2 2
+11 2 8 1
+12 2 8 2
+17 2 8 7
D E
B、C
元素的分类 最外层电子数 结构是否稳定 得、失电子 化学性质
金属 元素
非金属元素
稀有气体元素
一般小于4
失电子
大于等于4小于8
(氢为1)
得电子
为8
(氦为2)
不得不失
不稳定
不稳定
稳定
活泼
活泼
稳定
一般情况下,化学反应中的原子总要使自己的最外层达到稳定结构(即最外层电子数为8个或一个电子层时最外层电子数为2个)。
由于金属元素、非金属元素的原子核外最外层没有达到稳定结构,在化学反应中容易得失电子,从而达到稳定结构,那么,原子得失电子的结果怎样呢?
反 思
+11 2 8 1
+17 2 8 7
钠原子Na
氯原子Cl
+11 2 8
+17 2 8 8
钠离子Na+
氯离子Cl-
NaCl
在上述过程中,钠原子因失去1个电子而带上1个单位的_________电荷;氯原子因得到1个电子而带上1个单位的_________电荷。带相反电荷的钠离子与氯离子相互作用就形成了_________。可见, ________也是构成物质的微粒之一。
e
知识点二 离子
1.在化学变化中,电中性的原子因_________或_______电子而成为带电荷的微粒,这种带电的微粒称为______。
离子
得到
失去
[说明] 原子和离子在一定条件下可以进行相互转化。
核对知识清单
离子
2、分类
阴离子—带负电荷的微粒
3、书写方法—离子符号
阳离子—带正电荷的微粒
Cl-
Na+
O2-
氯离子
钠离子
氧离子
4、离子符号的写法:
⑴ 在元素符号的右上角标注离子所带电荷;
⑵ 数字在前,“+”、“-”号在后;
⑶ 离子所带电荷数为1时,1省去不写。
1、定义:
—带电荷的原子或原子团。
练习:写出下列离子符号
(1)氢离子 ; (2)钠离子 ;
(3)氧离子 ; (4)镁离子 ;
(5)铝离子 ;(6)硫离子 。
5、离子符号的意义:
Mg2+
每个镁离子带2个单位的正电荷
课堂练习:
1、对于下面结构示意图所表示的微粒,说法错误的是 ( )
A.它们的核外电子排布相同
B.它们不是同一种元素
C.它们都具有稳定结构
D.它们都是离子
3、下列各组元素的原子结构示意图中,具有相似化学性质的一组元素是( )
4、下列微粒的结构示意图中表示阳离子的是( )
A B
C D
A B C
D
构成物质的奥秘
任务一:合作探究
原子的结构
谁通过α粒子散射实验(轰击金箔实验)进一步探究了原子的结构?
原子由原子核和电子构成,原子核在原子中所占体积最小,但却几乎集中了原子的全部质量.
原子种类 质子数 中子数 核外电子数 原子序数
氢 1 0 1 1
氦 2 2 2 2
锂 3 4 3 3
铍 4 5 4 4
碳 6 6 6 6
质子数=核外电子数=原子序数=核电荷数
角色扮演-我是原子
以小组为单位展示原子结构。
核外电子是怎样运动的呢?能否直观清楚的表示出来一个原子的结构?
原子核
高速
运动
的电子
圆圈表示 ,11表示 ,
+表示 , 弧线表示 ,
弧线上的数字2、8、1分别表示 。
原子结构示意图:
原子结构示意图(直观清晰的表示原子结构):
原子核
质子数
质子带正电
电子层
核外第1层上有2个电子,第二层上有8个电子,第三层(最外层)上有1个电子。
核外电子的排布规律 :
⑴第一层最多排2个e ;第二层最多排8个e;
⑵次外层最多排8个e(第一层为最外层则最多排2个e);
⑶据能量最低原理,先排满第一层,再排第二层,依次向外。
原子结构的简明表示
原子结构示意图
画法:
画圆圈,
标质子,
弧线呈扇面,
数字一条线。
+8
2 6
氧 O
小试牛刀:你能计算出以下原子的想对原子质量吗?
原子种类 一个原子的质量(kg)
氢 1.674×10-27
碳 1.993×10-26
氧 2.657×10-26
铁 9.288×10-26
相对原子质量
=
1个原子质量
1个碳原子质量×1/12
(2)相对原子质量的计算公式
(1)概念:
1.相对原子质量(Ar)
以一种碳原子的质量的1/12 作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量。
相对原子质量是个比值,单位是 1
任务三:相对原子质量及相对分子质量
原子种类 一个原子的质量(Kg)
氢 1.674×10-27
碳 1.993×10-26
氧 2.657×10-26
铁 9.288×10-26
原子质量主要集中在哪里?
相对原子质量=质子数+中子数
粒子种类 电性 质量
质子 一个单位正电荷 1.6726*10-27kg
中子 不带电 1.6749*10-27kg
电子 一个单位负电荷 质子质量的1/1836
请口算出以下原子的相对原子质量
2.相对分子质量(Mr)
已知:H:1、O:16、C:12
那么,CO2 、H2O 的相对分子质量是多少呢 ?
+1 1
+2 2
+3 2 1
+4 2 2
+5 2 3
+6 2 4
+7 2 5
+8 2 6
+9 2 7
+10 2 8
+11 2 8 1
+12 2 8 2
+13 2 8 3
+14 2 8 4
+15 2 8 5
+16 2 8 6
+17 2 8 7
+18 2 8 8
氢H
氦He
锂Li
铍Be
硼B
碳C
氮N
氧O
氟F
氖Ne
钠Na
镁Mg
铝Al
硅Si
磷P
硫S
氯Cl
氩Ar
第一周期
第二周期
第三周期
+1 1
+2 2
+3 2 1
+4 2 2
+5 2 3
+6 2 4
+7 2 5
+8 2 6
+9 2 7
+10 2 8
+11 2 8 1
+12 2 8 2
+13 2 8 3
+14 2 8 4
+15 2 8 5
+16 2 8 6
+17 2 8 7
+18 2 8 8
氢H
氦He
锂Li
铍Be
硼B
碳C
氮N
氧O
氟F
氖Ne
钠Na
镁Mg
铝Al
硅Si
磷P
硫S
氯Cl
氩Ar
稀有气体元素
稳定结构
不稳定结构
金属元素
非金属元素
元素的化学性质与原子最外层电子数相关,不同原子最外层电子数相同化学性质相似
1、指出下列哪几种原子的化学性质相似
A
B
E
C
D
2、化学性质比较相似的是 。
A B C
+10 2 8
+2 2
+11 2 8 1
+12 2 8 2
+17 2 8 7
D E
B、C
元素的分类 最外层电子数 结构是否稳定 得、失电子 化学性质
金属 元素
非金属元素
稀有气体元素
一般小于4
失电子
大于等于4小于8
(氢为1)
得电子
为8
(氦为2)
不得不失
不稳定
不稳定
稳定
活泼
活泼
稳定
一般情况下,化学反应中的原子总要使自己的最外层达到稳定结构(即最外层电子数为8个或一个电子层时最外层电子数为2个)。
由于金属元素、非金属元素的原子核外最外层没有达到稳定结构,在化学反应中容易得失电子,从而达到稳定结构,那么,原子得失电子的结果怎样呢?
反 思
+11 2 8 1
+17 2 8 7
钠原子Na
氯原子Cl
+11 2 8
+17 2 8 8
钠离子Na+
氯离子Cl-
NaCl
在上述过程中,钠原子因失去1个电子而带上1个单位的_________电荷;氯原子因得到1个电子而带上1个单位的_________电荷。带相反电荷的钠离子与氯离子相互作用就形成了_________。可见, ________也是构成物质的微粒之一。
e
知识点二 离子
1.在化学变化中,电中性的原子因_________或_______电子而成为带电荷的微粒,这种带电的微粒称为______。
离子
得到
失去
[说明] 原子和离子在一定条件下可以进行相互转化。
核对知识清单
离子
2、分类
阴离子—带负电荷的微粒
3、书写方法—离子符号
阳离子—带正电荷的微粒
Cl-
Na+
O2-
氯离子
钠离子
氧离子
4、离子符号的写法:
⑴ 在元素符号的右上角标注离子所带电荷;
⑵ 数字在前,“+”、“-”号在后;
⑶ 离子所带电荷数为1时,1省去不写。
1、定义:
—带电荷的原子或原子团。
练习:写出下列离子符号
(1)氢离子 ; (2)钠离子 ;
(3)氧离子 ; (4)镁离子 ;
(5)铝离子 ;(6)硫离子 。
5、离子符号的意义:
Mg2+
每个镁离子带2个单位的正电荷
课堂练习:
1、对于下面结构示意图所表示的微粒,说法错误的是 ( )
A.它们的核外电子排布相同
B.它们不是同一种元素
C.它们都具有稳定结构
D.它们都是离子
3、下列各组元素的原子结构示意图中,具有相似化学性质的一组元素是( )
4、下列微粒的结构示意图中表示阳离子的是( )
A B
C D
A B C
D
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
