第九单元溶液单元测试卷-2021-2022学年九年级化学人教版下册(word版含解析)
文档属性
| 名称 | 第九单元溶液单元测试卷-2021-2022学年九年级化学人教版下册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 150.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-13 20:31:44 | ||
图片预览


文档简介
第九单元 溶液 单元测试卷
一、单选题
1.(2020·全国·九年级单元测试)下列液体属于溶液的是( )
A.芒果汁 B.蒸馏水 C.玉米粥 D.糖水
2.下列厨房用品中,加到水中充分搅拌能形成溶液的是
A.花椒粉 B.面粉 C.白糖 D.花生油
3.(2020·全国·九年级单元测试)若将某溶液的溶质质量分数增大一倍,可采用的方法是(设均未有晶体析出)( )
A.将溶剂蒸发掉一半
B.将溶液倒出一半
C.将溶质的质量增加一倍
D.将溶剂的质量减少至原溶液质量的一半
4.化学在生活中有非常广泛的用途,下列有关化学在生活中应用正确的是( )
A.硬水中加入明矾可以使其转化为软水
B.饱和溶液就是不能再溶解任何物质的溶液
C.用洗洁精除去衣服上的油污利用的是乳化作用
D.氧气具有助燃性,因此可以用作燃料
5.(2018·山东青岛·九年级单元测试)现有一杯糖水,取出一部分,测其密度为,则剩余糖水的密度是
A.小于 B.等于
C.大于 D.无法确定
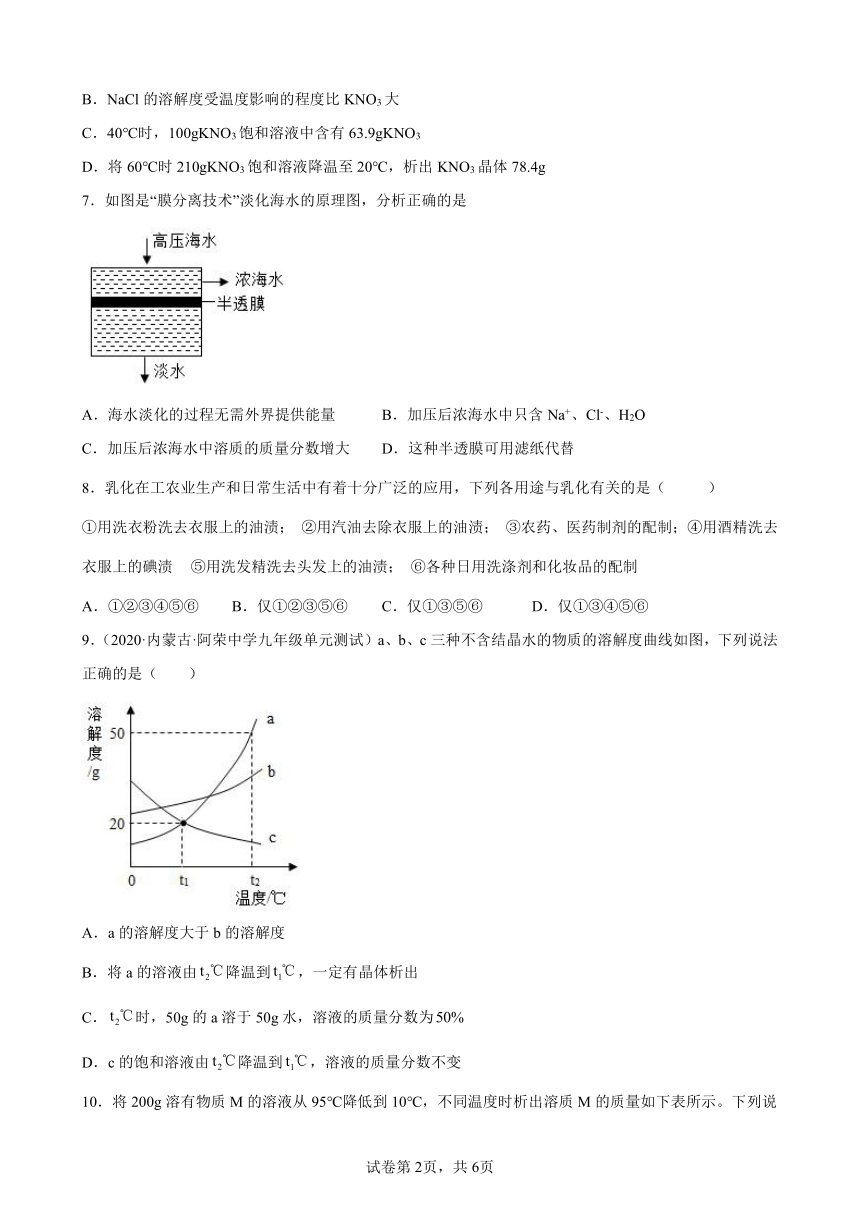
6.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
7.如图是“膜分离技术”淡化海水的原理图,分析正确的是
A.海水淡化的过程无需外界提供能量 B.加压后浓海水中只含Na+、Cl-、H2O
C.加压后浓海水中溶质的质量分数增大 D.这种半透膜可用滤纸代替
8.乳化在工农业生产和日常生活中有着十分广泛的应用,下列各用途与乳化有关的是( )
①用洗衣粉洗去衣服上的油渍; ②用汽油去除衣服上的油渍; ③农药、医药制剂的配制;④用酒精洗去衣服上的碘渍 ⑤用洗发精洗去头发上的油渍; ⑥各种日用洗涤剂和化妆品的配制
A.①②③④⑤⑥ B.仅①②③⑤⑥ C.仅①③⑤⑥ D.仅①③④⑤⑥
9.(2020·内蒙古·阿荣中学九年级单元测试)a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由降温到,一定有晶体析出
C.时,50g的a溶于50g水,溶液的质量分数为
D.c的饱和溶液由降温到,溶液的质量分数不变
10.将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
11.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
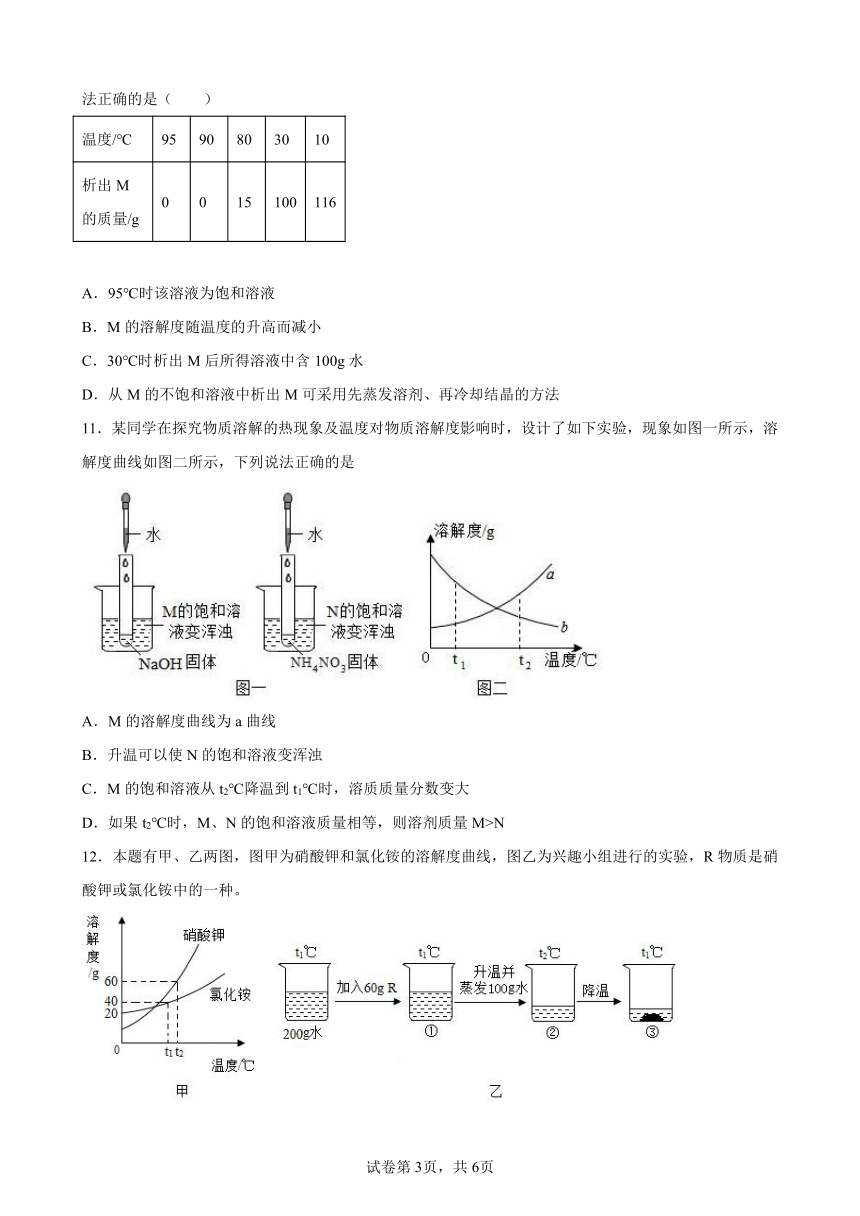
12.本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是
A.R物质是氯化铵
B.溶液的溶质质量分数是烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
二、填空题
13.物质在溶解过程中发生了两种变化,即溶质的分子(或离子)扩散过程和溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)的水合过程。若溶质溶解时,扩散过程吸收的热量小于水合过程放出的热量,此时所得溶液温度_____,反之则溶液的温度____。如浓硫酸、氢氧化钠溶于水时溶液温度____,硝酸钾、硝酸铵溶于水时溶液温度____。
14.常温下,在两只各盛有100ml水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示。则,甲溶液是__________溶液,若乙溶液仍可以继续溶解乙物质则乙是_____________;升高温度,剩余的甲固体一定能溶解吗_______________。
15.一本块漂浮于的饱和溶液中,如图a所示,当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积( )随时间(t)发生了如图b所示的变化。
(1)由此推测出温度的改变是 ______ (填“升温”或“降温”)。
(2)同时观察到烧杯底部晶体 ______ (填“增多”或“减少”)。
16.下列有关溶液的叙述中,正确的是______(填序号)。
①溶液都是无色透明的
②溶液中各部分都是均一的
③溶液中的溶剂一定是水
④气体、液体、固体均可作溶质
⑤任何条件下的溶液都是稳定的
⑥两种液体互溶时,量少的一定是溶质
⑦在溶液中进行的化学反应速率较快
⑧食物里的养料经消化变成溶液才能被吸收
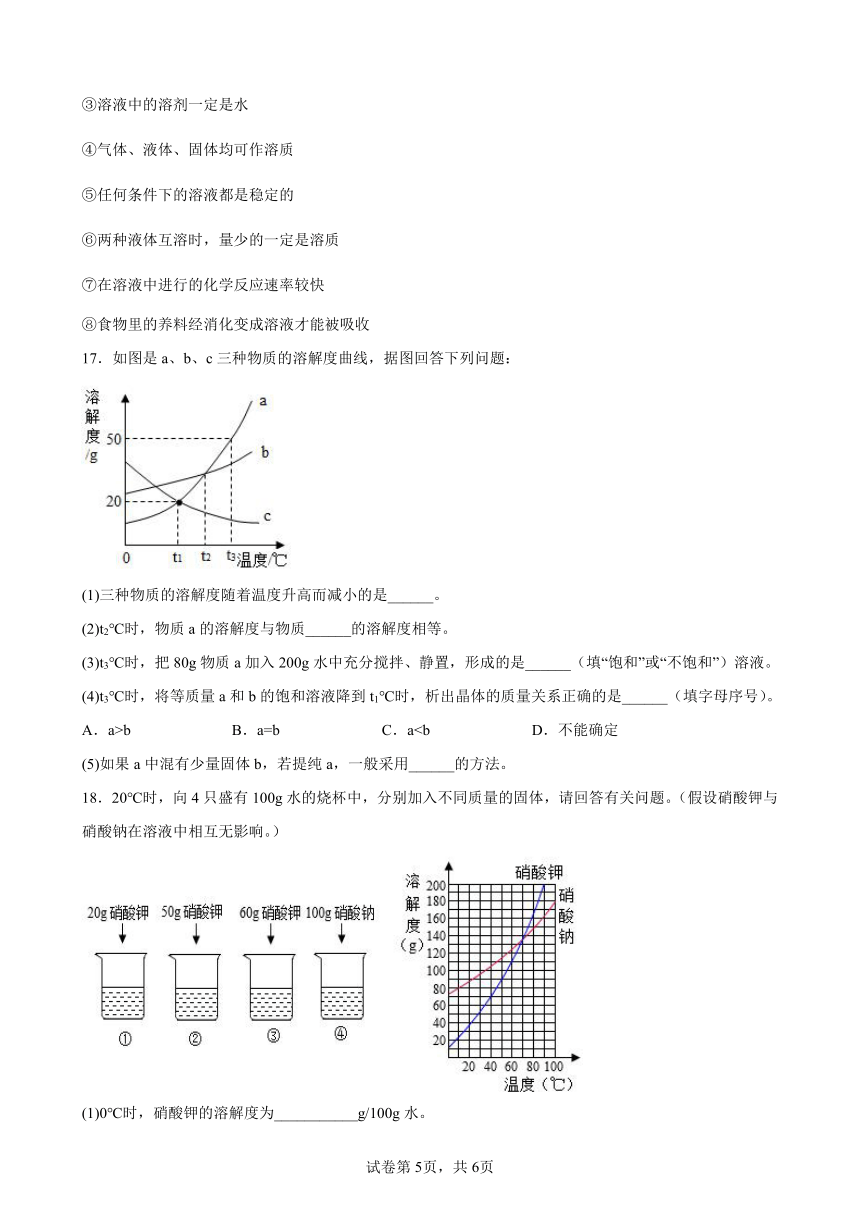
17.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是______。
(2)t2℃时,物质a的溶解度与物质______的溶解度相等。
(3)t3℃时,把80g物质a加入200g水中充分搅拌、静置,形成的是______(填“饱和”或“不饱和”)溶液。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是______(填字母序号)。
A.a>b B.a=b C.a(5)如果a中混有少量固体b,若提纯a,一般采用______的方法。
18.20℃时,向4只盛有100g水的烧杯中,分别加入不同质量的固体,请回答有关问题。(假设硝酸钾与硝酸钠在溶液中相互无影响。)
(1)0℃时,硝酸钾的溶解度为___________g/100g水。
(2)0℃时,溶解等质量的硝酸钾和硝酸钠,需要水较多的是___________(填“硝酸钾”或“硝酸钠”)。
(3)上述4只烧杯中,溶液呈饱和状态的有___________;将烧杯②与④混合,所得溶液呈不饱和状态,理由是___________。
三、计算题
19.(2022·重庆市南川区小河中学校九年级单元测试)6.5g锌和100g 某稀硫酸恰好完全反应(相对原子质量:H-1 O-16 S-32 Zn-65)。
(1)请写出该反应的化学方程式_____;
(2)100g稀硫酸中,溶质的化学式为______,其质量为_________;溶剂是_________,其质量为_____。
(3)反应后溶液中的溶质是_____,其质量为______;溶剂仍然是________, 其质量为_____;反应后溶液的总质量为_____。
20.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
1 第1次 第2次 第3次 第4次 第5次
累计加入稀硫酸的质量/g 50 100 150 200 250
累计产生气体的质量/g 0.2 m 0.6 0.7 0.7
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
21.(2017·全国·九年级单元测试)过氧化氢不稳定会自然分解,久置的过氧化氢溶液的溶质质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质质量分数,进行了实验探究,测得的相关数据如图所示。
(1)根据质量守恒定律,反应生成氧气的质量为__________。
(2)计算该过氧化氢溶液中溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【解析】
A、芒果汁不均一、不稳定,不属于溶液,故A错;
B、蒸馏水属于纯净物,而溶液属于混合物,故B错;
C、玉米粥不均一、不稳定,属于悬浊液,故C错;
D、糖水是均一、稳定的混合物,属于溶液,故D正确。
故选D。
2.C
【解析】
A. 花椒粉不能完全溶解在水,会形成悬浊液,不能形成溶液,故不符合题意;
B. 面粉不能完全溶解在水,会形成悬浊液,不能形成溶液,故不符合题意;
C. 白糖能溶解在水中,形成均一的,稳定的混合物,形成溶液,故符合题意;
D. 花生油不能溶解于水,形成乳浊液,故不符合题意;
故选:C。
3.D
【解析】
A、将溶剂蒸发掉一半,溶液质量并未减少一半,溶质质量分数增大不到一倍,此选项不符合题意;
B、溶液具有均一性,将溶液倒出一半,溶质质量分数不变,此选项不符合题意;
C、将溶质的质量增加一倍,溶液质量增多,溶质质量分数增大不到一倍,此选项不符合题意;
D、将溶剂的质量减少至原溶液质量的一半,溶质质量不变,溶质质量分数增大一倍,此选项符合题意。
故选D。
4.C
【解析】
A、硬水中加入明矾只能吸附水中不溶性的杂质,不能除去水可溶性的钙镁化合物,硬水通过煮沸的方法转化为软水,故错误;
B、饱和溶液是指一定温度下,一定量的溶剂里不能继续溶解该溶质的溶液,但能溶解其他物质,故错误;
C、洗洁精是常见的洗涤剂,用洗洁精除去衣服上的油污利用的是乳化作用,故正确;
D、氧气只有助燃性,没有可燃性,不能做燃料,故错误。
故选C。
5.B
【解析】
因为溶液是均一的,所以溶液中各处的密度相等。故选B。
6.D
【解析】
A、从图示中可以看出,在不同温度范围内,硝酸钾和氯化钠的溶解度大小关系不同,因此没有指明温度,不能比较氯化钠与硝酸钾溶解度的大小,故A选项错误;
B、由两条曲线从左到右的上升趋势可知,NaCl的溶解度受温度影响的程度比KNO3的小,故B选项错误;
C、40℃时,KNO3硝酸钾的溶解度为63.9g,即在40℃时,100g水中最多溶解63.9gKNO3,形成163.9g饱和溶液,即在该温度下,163.9gKNO3饱和溶解中含有63.9gKNO3,因此在40℃时,100gKNO3饱和溶液中含有KNO3的质量小于63.9g,故C选项错误;
D、60℃时,硝酸钾的溶解度为110.0g,即在60℃时,100g水中溶解110.0g硝酸钾形成210.0g饱和溶液;20℃,硝酸钾的溶解度为31.6g,即20℃时,100g水中溶解31.6g硝酸钾形成131.6g饱和溶液,所以将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体的质量为:,故D选项正确;
故选D。
7.C
8.C
【解析】
乳化是指能够把油或难溶于水的有机物以小液滴的形式分散在水中,形成乳浊液。乳化剂所起的作用叫乳化作用。
①洗衣粉含有乳化剂,洗去衣服上的油渍是乳化作用,正确;
②用汽油去除衣服上的油渍,是由于相似相容原理,与乳化无关,错误;
③有些农药是以乳液形式,在合成或使用过程中需利用乳化作用原理制得乳液,农药、医药制剂的配制与乳化有关,正确;
④酒精可以溶解碘,故用酒精洗去衣服上的碘渍与乳化无关,错误;
⑤洗发精中有乳化剂,能将大的油污变成细小的油滴,故用洗发精洗去头发上的油渍与乳化有关,正确;
⑥化妆品一般是乳液形式,在配制时需利用乳化作用原理制得乳液,与乳化有关;
故选:C。
9.D
【解析】
A、在比较物质的溶解度时,需要指明温度,故A错误;
B、将a的溶液由t2℃降温到t1℃,溶液的状态不能确定,所以不一定有晶体析出,故B错误;
C、t2℃时,a物质的溶解度是50g,根据溶解度概念可知,100g水最多溶解50ga,50g水 最多溶解25ga,溶液的质量分数=×100%=33.3%,故C错误;
D、c的饱和溶液由t2℃降温到t1℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液的质量分数不变,故D正确。
故选D。
10.D
【解析】
A、将200g溶有物质M的溶液从95℃降低到90℃,没有晶体析出,说明95℃时该溶液为不饱和溶液,故选项说法错误。
B、将200g溶有物质M的溶液从95℃降低到10℃的过程中,逐渐析出晶体,说明M的溶解度随温度的升高而增大,随温度的降低而减小,故选项说法错误。
C、30℃时析出100gM,所得溶液的质量为100g,不是水的质量,故选项说法错误。
D、M的溶解度随温度的降低而减小,从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法,故选项说法正确。
故选:D。
11.D
【解析】
A、氢氧化钠溶解放热,M饱和溶液变浑浊,说明M温度越高溶解度越小,为b,A错误。
B、硝酸铵溶解吸热,N的饱和溶液变浑浊,说明N温度越低溶解度越小,为a,升温N溶解度变大,变为不饱和溶液,不会变浑浊,B错误。
C、M的饱和溶液即为b的饱和溶液,从t2℃降温到t1℃时,溶解度变大,溶质质量不变,溶剂质量不变,溶质质量分数不变,C错误。
D、如果t2℃时,M、N的饱和溶液质量相等,因为M(b)溶解度小于N(a)溶解度,则溶剂质量M>N,D正确。
故选:D。
12.B
【解析】
A、由图甲可知,t2℃时,NH4Cl的溶解度小于60g,而烧杯②中在t2℃时,100g水中溶解了60gR,所以R是KNO3,故A选项错误;
B、由图甲可知,t1℃时,KNO3的溶解度大于40g。t1℃时, 200g水中加入60g KNO3得到烧杯①中的溶液是不饱和溶液,而烧杯③中的溶液是t1℃时KNO3的饱和溶液,所以烧杯①溶液的溶质质量分数小于烧杯③,故B选项正确;
C、因为KNO3的溶解度随温度的升高而增大,若使烧杯③中的固体溶解可以采用加水或升高温度的方法,故C选项错误;
D、由图甲可知,t2℃时,KNO3的溶解度为60g,所以烧杯②中的溶液也是饱和溶液。烧杯①、②、③中,烧杯②、③中的溶液是饱和溶液,故D选项错误。
故选B。
13. 升高 降低 升高 降低
【解析】
物质在溶解过程中发生了两种变化,即溶质的分子(或离子)扩散过程和溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)的水合过程。若溶质溶解时,扩散过程吸收的热量小于水合过程放出的热量,此时所得溶液温度升高,反之则溶液的温度降低。如浓硫酸、氢氧化钠溶于水时溶液温度升高,硝酸钾、硝酸铵溶于水时溶液温度降低。
14. 饱和 不饱和溶液 不一定
【解析】
甲溶液中有固体有剩余,说明溶液饱和;乙溶液还能溶解溶质,说明乙是不饱和溶液;因不知甲固体的溶解度受温度的影响情况,若甲固体的溶解度随温度升高而降低,则升温将有固体析出,故填:饱和、不饱和溶液、不一定。
15. 降温 增多
【解析】
由函数图像看出木块排开水的体积增大,根据F浮=m=ρgV排可知,溶液的密度减小,密度减小的原因是溶液中的溶质减少,当温度降低时,KNO3饱和溶液会析出溶质,同时溶液中的固体增多。
(1)由此推测出温度的改变是降温;
(2)同时观察到烧杯底部晶体增多。
16.②④⑦⑧
【解析】
①、有些溶液是有颜色的,如硫酸铜溶液为蓝色,故错误;
②、溶液是均一稳定的,溶液中各部分都是均一的,故正确;
③、水是最常用的溶剂,其他物质如汽油、酒精等也可以作溶剂,故错误;
④、溶质可以是固体,也可以是液体或气体.例如盐酸中的溶质氯化氢是气体,酒精溶液中的溶质酒精是液体,蔗糖溶液中的溶质蔗糖是固体,故正确;
⑤、当外界条件不变时,溶液因具有均一性和稳定性不会发生变化,但如果外界条件改变,溶液也会发生变化,如温度降低,溶液中可能会有溶质析出等,故错误;
⑥、两种液体互溶时,量少的不一定是溶质,如75%酒精中,水是溶剂,故错误;
⑦、因为溶液中各物质个离子、分子、原子的接触面积很大,几乎一个离子对应一个离子或者分子原子来进行反应,自然反应速度会很快,故正确;
⑧、食物里的养料经消化变成溶液才能被吸收,故正确。
故选:②④⑦⑧。
17.(1)c
(2)b
(3)不饱和
(4)A
(5)降温结晶
【解析】
(1)
通过分析溶解度曲线可知,三种物质的溶解度随着温度升高而减小的是c,故填:c。
(2)
由图可知,t2℃时,a、b的溶解度曲线相交,说明该温度下,物质a的溶解度与物质b的溶解度相等,故填:b。
(3)
t3℃时,a物质的溶解度是50g,即该温度下,100g水中最多能溶解度50ga物质,200g水可以溶解a物质100g,所以把80g物质a加入到200g水中充分搅拌、静置,形成溶液的质量是280g,形成的是不饱和溶液,故填:不饱和。
(4)
t3℃时,a物质的溶解度大于b,将等质量a和b的饱和溶液降到t1℃时,a物质的溶解度小于b,所以析出晶体的质量关系正确的是a>b,故选A。
(5)
a物质溶解度随温度变化较大,如果a中混有少量固体b,若提纯a,一般采用降温结晶的方法,故填:降温结晶。
18.(1)12
(2)硝酸钾
(3) ②③④ 将烧杯②与④混合后溶剂水的质量为100+100=200g,最多溶解硝酸钾、硝酸钠的质量分别为60g、176g,60g>50g、176g>100g,故所得溶液呈不饱和状态
【解析】
(1)
由图可知,0℃时,硝酸钾的溶解度为12g左右。
(2)
0℃时,硝酸钾的溶解度小于硝酸钠,溶解等质量的硝酸钾和硝酸钠,硝酸钾需要更多的水,故需要水较多的是硝酸钾。
(3)
由图可知,20℃时,硝酸钾、硝酸钠溶解度分别为30g、88g左右;20℃时,向4只盛有100g水的烧杯中,分别加入20g<30g的硝酸钾、50g>30g的硝酸钾、60g>30g的硝酸钾、100g>88g的硝酸钠,则上述4只烧杯中,溶液呈饱和状态的有②③④;
将烧杯②与④混合后溶剂水的质量为100+100=200g,最多溶解硝酸钾、硝酸钠的质量分别为60g、176g,60g>50g、176g>100g,故所得溶液呈不饱和状态。
19.(1)Zn+H2SO4=ZnSO4+H2↑
(2) H2SO4 9.8g 水 H2O 90.2g
(3) 硫酸锌 ZnSO4 16.1g 水 H2O 90.2g 106.3g
【解析】
6.5g 锌和 100g 某稀硫酸恰好完全反应,设参加反应的H2SO4的质量为x,生成ZnSO4的质量为y,根据Zn和H2SO4反应的化学方程式进行计算,则
(1)
锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;
(2)
100g稀硫酸中,溶质为硫酸,化学式为H2SO4,根据计算,H2SO4的质量为9.8g,溶剂为水,水的质量为100g-9.8g=90.2g;
(3)
反应后的溶液为硫酸锌溶液,溶质为硫酸锌,根据计算,硫酸锌的质量为16.1g,溶剂仍然为水,且由于水未参加反应,其质量仍然为90.2g,反应后溶液的总质量为16.1g+90.2g=106.3g。
20.(1)0.4
(2)54.5%
(3)解:设50g稀硫酸中硫酸的质量为
=9.8g
所用稀硫酸中溶质的质量分数为×100%=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
【解析】
(1)
由表格数据可知,第1次加入稀硫酸50g,产生0.2g气体,第3次共加入稀硫酸150g,共产生0.6g气体,即每50g稀硫酸对应生成0.2g气体,所以m= 0.4;
(2)
黄铜(铜、锌合金)样品中,锌与稀硫酸反应生成硫酸锌和氢气,由表格可知,最终共生成氢气的质量为0.7g。
解:设样品中锌的质量为
=22.75g
则黄铜样品中铜的质量为50g-22.75g=27.25g
黄铜样品中铜的质量分数为×100%=54.5%。
(3)
见答案。
21.(1)0.8g
(2)5%
解:设过氧化氢溶液溶质质量分数为x。
x=5%
答:溶质质量分数5%。
【解析】
(1)
反应生成氧气的质量为34.0g+0.5g-33.7g=0.8g,故填:0.8g。
(2)
见答案
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2020·全国·九年级单元测试)下列液体属于溶液的是( )
A.芒果汁 B.蒸馏水 C.玉米粥 D.糖水
2.下列厨房用品中,加到水中充分搅拌能形成溶液的是
A.花椒粉 B.面粉 C.白糖 D.花生油
3.(2020·全国·九年级单元测试)若将某溶液的溶质质量分数增大一倍,可采用的方法是(设均未有晶体析出)( )
A.将溶剂蒸发掉一半
B.将溶液倒出一半
C.将溶质的质量增加一倍
D.将溶剂的质量减少至原溶液质量的一半
4.化学在生活中有非常广泛的用途,下列有关化学在生活中应用正确的是( )
A.硬水中加入明矾可以使其转化为软水
B.饱和溶液就是不能再溶解任何物质的溶液
C.用洗洁精除去衣服上的油污利用的是乳化作用
D.氧气具有助燃性,因此可以用作燃料
5.(2018·山东青岛·九年级单元测试)现有一杯糖水,取出一部分,测其密度为,则剩余糖水的密度是
A.小于 B.等于
C.大于 D.无法确定
6.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
7.如图是“膜分离技术”淡化海水的原理图,分析正确的是
A.海水淡化的过程无需外界提供能量 B.加压后浓海水中只含Na+、Cl-、H2O
C.加压后浓海水中溶质的质量分数增大 D.这种半透膜可用滤纸代替
8.乳化在工农业生产和日常生活中有着十分广泛的应用,下列各用途与乳化有关的是( )
①用洗衣粉洗去衣服上的油渍; ②用汽油去除衣服上的油渍; ③农药、医药制剂的配制;④用酒精洗去衣服上的碘渍 ⑤用洗发精洗去头发上的油渍; ⑥各种日用洗涤剂和化妆品的配制
A.①②③④⑤⑥ B.仅①②③⑤⑥ C.仅①③⑤⑥ D.仅①③④⑤⑥
9.(2020·内蒙古·阿荣中学九年级单元测试)a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由降温到,一定有晶体析出
C.时,50g的a溶于50g水,溶液的质量分数为
D.c的饱和溶液由降温到,溶液的质量分数不变
10.将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
11.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
12.本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是
A.R物质是氯化铵
B.溶液的溶质质量分数是烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
二、填空题
13.物质在溶解过程中发生了两种变化,即溶质的分子(或离子)扩散过程和溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)的水合过程。若溶质溶解时,扩散过程吸收的热量小于水合过程放出的热量,此时所得溶液温度_____,反之则溶液的温度____。如浓硫酸、氢氧化钠溶于水时溶液温度____,硝酸钾、硝酸铵溶于水时溶液温度____。
14.常温下,在两只各盛有100ml水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示。则,甲溶液是__________溶液,若乙溶液仍可以继续溶解乙物质则乙是_____________;升高温度,剩余的甲固体一定能溶解吗_______________。
15.一本块漂浮于的饱和溶液中,如图a所示,当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积( )随时间(t)发生了如图b所示的变化。
(1)由此推测出温度的改变是 ______ (填“升温”或“降温”)。
(2)同时观察到烧杯底部晶体 ______ (填“增多”或“减少”)。
16.下列有关溶液的叙述中,正确的是______(填序号)。
①溶液都是无色透明的
②溶液中各部分都是均一的
③溶液中的溶剂一定是水
④气体、液体、固体均可作溶质
⑤任何条件下的溶液都是稳定的
⑥两种液体互溶时,量少的一定是溶质
⑦在溶液中进行的化学反应速率较快
⑧食物里的养料经消化变成溶液才能被吸收
17.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是______。
(2)t2℃时,物质a的溶解度与物质______的溶解度相等。
(3)t3℃时,把80g物质a加入200g水中充分搅拌、静置,形成的是______(填“饱和”或“不饱和”)溶液。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是______(填字母序号)。
A.a>b B.a=b C.a(5)如果a中混有少量固体b,若提纯a,一般采用______的方法。
18.20℃时,向4只盛有100g水的烧杯中,分别加入不同质量的固体,请回答有关问题。(假设硝酸钾与硝酸钠在溶液中相互无影响。)
(1)0℃时,硝酸钾的溶解度为___________g/100g水。
(2)0℃时,溶解等质量的硝酸钾和硝酸钠,需要水较多的是___________(填“硝酸钾”或“硝酸钠”)。
(3)上述4只烧杯中,溶液呈饱和状态的有___________;将烧杯②与④混合,所得溶液呈不饱和状态,理由是___________。
三、计算题
19.(2022·重庆市南川区小河中学校九年级单元测试)6.5g锌和100g 某稀硫酸恰好完全反应(相对原子质量:H-1 O-16 S-32 Zn-65)。
(1)请写出该反应的化学方程式_____;
(2)100g稀硫酸中,溶质的化学式为______,其质量为_________;溶剂是_________,其质量为_____。
(3)反应后溶液中的溶质是_____,其质量为______;溶剂仍然是________, 其质量为_____;反应后溶液的总质量为_____。
20.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
1 第1次 第2次 第3次 第4次 第5次
累计加入稀硫酸的质量/g 50 100 150 200 250
累计产生气体的质量/g 0.2 m 0.6 0.7 0.7
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
21.(2017·全国·九年级单元测试)过氧化氢不稳定会自然分解,久置的过氧化氢溶液的溶质质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质质量分数,进行了实验探究,测得的相关数据如图所示。
(1)根据质量守恒定律,反应生成氧气的质量为__________。
(2)计算该过氧化氢溶液中溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【解析】
A、芒果汁不均一、不稳定,不属于溶液,故A错;
B、蒸馏水属于纯净物,而溶液属于混合物,故B错;
C、玉米粥不均一、不稳定,属于悬浊液,故C错;
D、糖水是均一、稳定的混合物,属于溶液,故D正确。
故选D。
2.C
【解析】
A. 花椒粉不能完全溶解在水,会形成悬浊液,不能形成溶液,故不符合题意;
B. 面粉不能完全溶解在水,会形成悬浊液,不能形成溶液,故不符合题意;
C. 白糖能溶解在水中,形成均一的,稳定的混合物,形成溶液,故符合题意;
D. 花生油不能溶解于水,形成乳浊液,故不符合题意;
故选:C。
3.D
【解析】
A、将溶剂蒸发掉一半,溶液质量并未减少一半,溶质质量分数增大不到一倍,此选项不符合题意;
B、溶液具有均一性,将溶液倒出一半,溶质质量分数不变,此选项不符合题意;
C、将溶质的质量增加一倍,溶液质量增多,溶质质量分数增大不到一倍,此选项不符合题意;
D、将溶剂的质量减少至原溶液质量的一半,溶质质量不变,溶质质量分数增大一倍,此选项符合题意。
故选D。
4.C
【解析】
A、硬水中加入明矾只能吸附水中不溶性的杂质,不能除去水可溶性的钙镁化合物,硬水通过煮沸的方法转化为软水,故错误;
B、饱和溶液是指一定温度下,一定量的溶剂里不能继续溶解该溶质的溶液,但能溶解其他物质,故错误;
C、洗洁精是常见的洗涤剂,用洗洁精除去衣服上的油污利用的是乳化作用,故正确;
D、氧气只有助燃性,没有可燃性,不能做燃料,故错误。
故选C。
5.B
【解析】
因为溶液是均一的,所以溶液中各处的密度相等。故选B。
6.D
【解析】
A、从图示中可以看出,在不同温度范围内,硝酸钾和氯化钠的溶解度大小关系不同,因此没有指明温度,不能比较氯化钠与硝酸钾溶解度的大小,故A选项错误;
B、由两条曲线从左到右的上升趋势可知,NaCl的溶解度受温度影响的程度比KNO3的小,故B选项错误;
C、40℃时,KNO3硝酸钾的溶解度为63.9g,即在40℃时,100g水中最多溶解63.9gKNO3,形成163.9g饱和溶液,即在该温度下,163.9gKNO3饱和溶解中含有63.9gKNO3,因此在40℃时,100gKNO3饱和溶液中含有KNO3的质量小于63.9g,故C选项错误;
D、60℃时,硝酸钾的溶解度为110.0g,即在60℃时,100g水中溶解110.0g硝酸钾形成210.0g饱和溶液;20℃,硝酸钾的溶解度为31.6g,即20℃时,100g水中溶解31.6g硝酸钾形成131.6g饱和溶液,所以将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体的质量为:,故D选项正确;
故选D。
7.C
8.C
【解析】
乳化是指能够把油或难溶于水的有机物以小液滴的形式分散在水中,形成乳浊液。乳化剂所起的作用叫乳化作用。
①洗衣粉含有乳化剂,洗去衣服上的油渍是乳化作用,正确;
②用汽油去除衣服上的油渍,是由于相似相容原理,与乳化无关,错误;
③有些农药是以乳液形式,在合成或使用过程中需利用乳化作用原理制得乳液,农药、医药制剂的配制与乳化有关,正确;
④酒精可以溶解碘,故用酒精洗去衣服上的碘渍与乳化无关,错误;
⑤洗发精中有乳化剂,能将大的油污变成细小的油滴,故用洗发精洗去头发上的油渍与乳化有关,正确;
⑥化妆品一般是乳液形式,在配制时需利用乳化作用原理制得乳液,与乳化有关;
故选:C。
9.D
【解析】
A、在比较物质的溶解度时,需要指明温度,故A错误;
B、将a的溶液由t2℃降温到t1℃,溶液的状态不能确定,所以不一定有晶体析出,故B错误;
C、t2℃时,a物质的溶解度是50g,根据溶解度概念可知,100g水最多溶解50ga,50g水 最多溶解25ga,溶液的质量分数=×100%=33.3%,故C错误;
D、c的饱和溶液由t2℃降温到t1℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液的质量分数不变,故D正确。
故选D。
10.D
【解析】
A、将200g溶有物质M的溶液从95℃降低到90℃,没有晶体析出,说明95℃时该溶液为不饱和溶液,故选项说法错误。
B、将200g溶有物质M的溶液从95℃降低到10℃的过程中,逐渐析出晶体,说明M的溶解度随温度的升高而增大,随温度的降低而减小,故选项说法错误。
C、30℃时析出100gM,所得溶液的质量为100g,不是水的质量,故选项说法错误。
D、M的溶解度随温度的降低而减小,从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法,故选项说法正确。
故选:D。
11.D
【解析】
A、氢氧化钠溶解放热,M饱和溶液变浑浊,说明M温度越高溶解度越小,为b,A错误。
B、硝酸铵溶解吸热,N的饱和溶液变浑浊,说明N温度越低溶解度越小,为a,升温N溶解度变大,变为不饱和溶液,不会变浑浊,B错误。
C、M的饱和溶液即为b的饱和溶液,从t2℃降温到t1℃时,溶解度变大,溶质质量不变,溶剂质量不变,溶质质量分数不变,C错误。
D、如果t2℃时,M、N的饱和溶液质量相等,因为M(b)溶解度小于N(a)溶解度,则溶剂质量M>N,D正确。
故选:D。
12.B
【解析】
A、由图甲可知,t2℃时,NH4Cl的溶解度小于60g,而烧杯②中在t2℃时,100g水中溶解了60gR,所以R是KNO3,故A选项错误;
B、由图甲可知,t1℃时,KNO3的溶解度大于40g。t1℃时, 200g水中加入60g KNO3得到烧杯①中的溶液是不饱和溶液,而烧杯③中的溶液是t1℃时KNO3的饱和溶液,所以烧杯①溶液的溶质质量分数小于烧杯③,故B选项正确;
C、因为KNO3的溶解度随温度的升高而增大,若使烧杯③中的固体溶解可以采用加水或升高温度的方法,故C选项错误;
D、由图甲可知,t2℃时,KNO3的溶解度为60g,所以烧杯②中的溶液也是饱和溶液。烧杯①、②、③中,烧杯②、③中的溶液是饱和溶液,故D选项错误。
故选B。
13. 升高 降低 升高 降低
【解析】
物质在溶解过程中发生了两种变化,即溶质的分子(或离子)扩散过程和溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子)的水合过程。若溶质溶解时,扩散过程吸收的热量小于水合过程放出的热量,此时所得溶液温度升高,反之则溶液的温度降低。如浓硫酸、氢氧化钠溶于水时溶液温度升高,硝酸钾、硝酸铵溶于水时溶液温度降低。
14. 饱和 不饱和溶液 不一定
【解析】
甲溶液中有固体有剩余,说明溶液饱和;乙溶液还能溶解溶质,说明乙是不饱和溶液;因不知甲固体的溶解度受温度的影响情况,若甲固体的溶解度随温度升高而降低,则升温将有固体析出,故填:饱和、不饱和溶液、不一定。
15. 降温 增多
【解析】
由函数图像看出木块排开水的体积增大,根据F浮=m=ρgV排可知,溶液的密度减小,密度减小的原因是溶液中的溶质减少,当温度降低时,KNO3饱和溶液会析出溶质,同时溶液中的固体增多。
(1)由此推测出温度的改变是降温;
(2)同时观察到烧杯底部晶体增多。
16.②④⑦⑧
【解析】
①、有些溶液是有颜色的,如硫酸铜溶液为蓝色,故错误;
②、溶液是均一稳定的,溶液中各部分都是均一的,故正确;
③、水是最常用的溶剂,其他物质如汽油、酒精等也可以作溶剂,故错误;
④、溶质可以是固体,也可以是液体或气体.例如盐酸中的溶质氯化氢是气体,酒精溶液中的溶质酒精是液体,蔗糖溶液中的溶质蔗糖是固体,故正确;
⑤、当外界条件不变时,溶液因具有均一性和稳定性不会发生变化,但如果外界条件改变,溶液也会发生变化,如温度降低,溶液中可能会有溶质析出等,故错误;
⑥、两种液体互溶时,量少的不一定是溶质,如75%酒精中,水是溶剂,故错误;
⑦、因为溶液中各物质个离子、分子、原子的接触面积很大,几乎一个离子对应一个离子或者分子原子来进行反应,自然反应速度会很快,故正确;
⑧、食物里的养料经消化变成溶液才能被吸收,故正确。
故选:②④⑦⑧。
17.(1)c
(2)b
(3)不饱和
(4)A
(5)降温结晶
【解析】
(1)
通过分析溶解度曲线可知,三种物质的溶解度随着温度升高而减小的是c,故填:c。
(2)
由图可知,t2℃时,a、b的溶解度曲线相交,说明该温度下,物质a的溶解度与物质b的溶解度相等,故填:b。
(3)
t3℃时,a物质的溶解度是50g,即该温度下,100g水中最多能溶解度50ga物质,200g水可以溶解a物质100g,所以把80g物质a加入到200g水中充分搅拌、静置,形成溶液的质量是280g,形成的是不饱和溶液,故填:不饱和。
(4)
t3℃时,a物质的溶解度大于b,将等质量a和b的饱和溶液降到t1℃时,a物质的溶解度小于b,所以析出晶体的质量关系正确的是a>b,故选A。
(5)
a物质溶解度随温度变化较大,如果a中混有少量固体b,若提纯a,一般采用降温结晶的方法,故填:降温结晶。
18.(1)12
(2)硝酸钾
(3) ②③④ 将烧杯②与④混合后溶剂水的质量为100+100=200g,最多溶解硝酸钾、硝酸钠的质量分别为60g、176g,60g>50g、176g>100g,故所得溶液呈不饱和状态
【解析】
(1)
由图可知,0℃时,硝酸钾的溶解度为12g左右。
(2)
0℃时,硝酸钾的溶解度小于硝酸钠,溶解等质量的硝酸钾和硝酸钠,硝酸钾需要更多的水,故需要水较多的是硝酸钾。
(3)
由图可知,20℃时,硝酸钾、硝酸钠溶解度分别为30g、88g左右;20℃时,向4只盛有100g水的烧杯中,分别加入20g<30g的硝酸钾、50g>30g的硝酸钾、60g>30g的硝酸钾、100g>88g的硝酸钠,则上述4只烧杯中,溶液呈饱和状态的有②③④;
将烧杯②与④混合后溶剂水的质量为100+100=200g,最多溶解硝酸钾、硝酸钠的质量分别为60g、176g,60g>50g、176g>100g,故所得溶液呈不饱和状态。
19.(1)Zn+H2SO4=ZnSO4+H2↑
(2) H2SO4 9.8g 水 H2O 90.2g
(3) 硫酸锌 ZnSO4 16.1g 水 H2O 90.2g 106.3g
【解析】
6.5g 锌和 100g 某稀硫酸恰好完全反应,设参加反应的H2SO4的质量为x,生成ZnSO4的质量为y,根据Zn和H2SO4反应的化学方程式进行计算,则
(1)
锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;
(2)
100g稀硫酸中,溶质为硫酸,化学式为H2SO4,根据计算,H2SO4的质量为9.8g,溶剂为水,水的质量为100g-9.8g=90.2g;
(3)
反应后的溶液为硫酸锌溶液,溶质为硫酸锌,根据计算,硫酸锌的质量为16.1g,溶剂仍然为水,且由于水未参加反应,其质量仍然为90.2g,反应后溶液的总质量为16.1g+90.2g=106.3g。
20.(1)0.4
(2)54.5%
(3)解:设50g稀硫酸中硫酸的质量为
=9.8g
所用稀硫酸中溶质的质量分数为×100%=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
【解析】
(1)
由表格数据可知,第1次加入稀硫酸50g,产生0.2g气体,第3次共加入稀硫酸150g,共产生0.6g气体,即每50g稀硫酸对应生成0.2g气体,所以m= 0.4;
(2)
黄铜(铜、锌合金)样品中,锌与稀硫酸反应生成硫酸锌和氢气,由表格可知,最终共生成氢气的质量为0.7g。
解:设样品中锌的质量为
=22.75g
则黄铜样品中铜的质量为50g-22.75g=27.25g
黄铜样品中铜的质量分数为×100%=54.5%。
(3)
见答案。
21.(1)0.8g
(2)5%
解:设过氧化氢溶液溶质质量分数为x。
x=5%
答:溶质质量分数5%。
【解析】
(1)
反应生成氧气的质量为34.0g+0.5g-33.7g=0.8g,故填:0.8g。
(2)
见答案
答案第1页,共2页
答案第1页,共2页
同课章节目录
