第九单元溶液测试题-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第九单元溶液测试题-2021-2022学年九年级化学人教版下册(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 164.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-13 00:00:00 | ||
图片预览


文档简介
第九单元《溶液》测试题
一、单选题
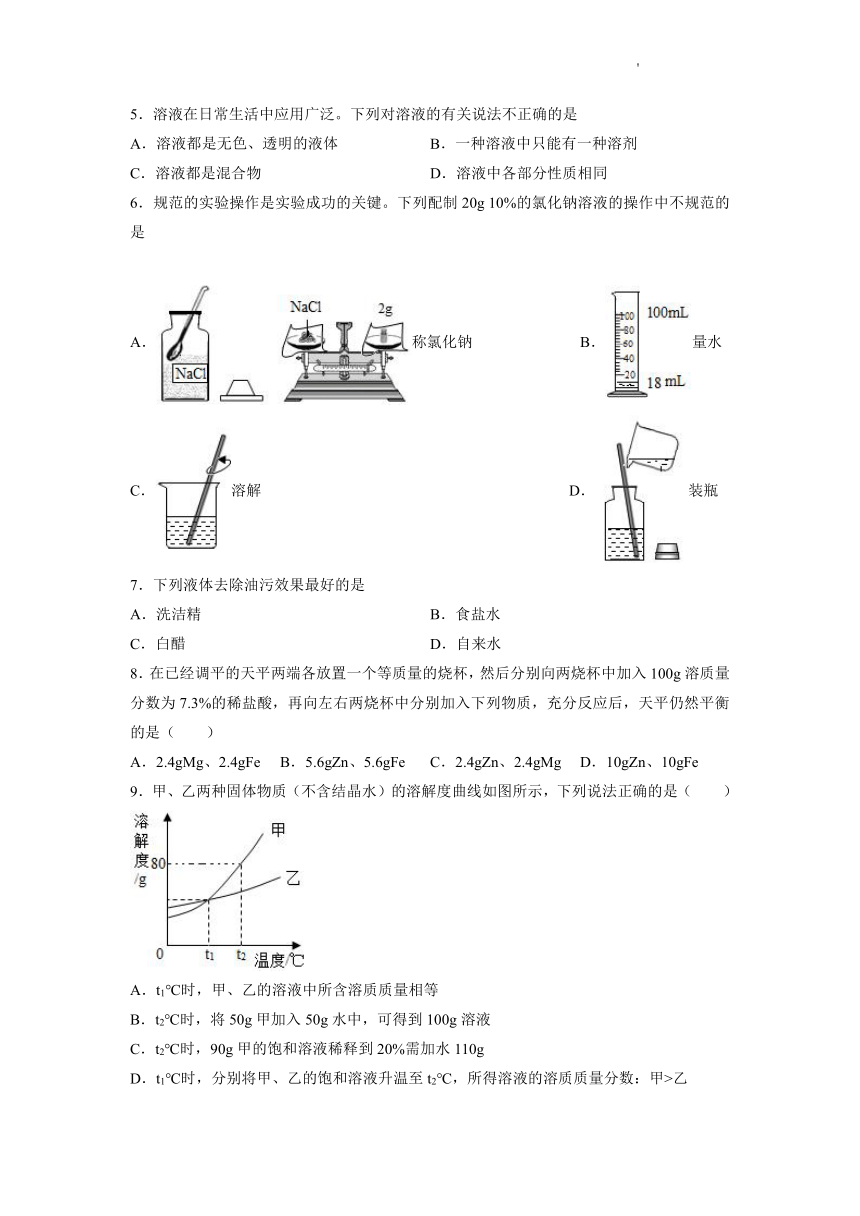
1.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
2.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
3.下列有关实验现象的描述,正确的是
A.打开浓盐酸的瓶盖,瓶口冒白烟 B.高锰酸钾溶于汽油形成紫红色溶液
C.铁溶解在稀盐酸中,溶液颜色变成浅绿色 D.电解水时负极产生的气体能使带火星的木条复燃
4.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
5.溶液在日常生活中应用广泛。下列对溶液的有关说法不正确的是
A.溶液都是无色、透明的液体 B.一种溶液中只能有一种溶剂
C.溶液都是混合物 D.溶液中各部分性质相同
6.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠 B.量水
C.溶解 D.装瓶
7.下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
8.在已经调平的天平两端各放置一个等质量的烧杯,然后分别向两烧杯中加入100g溶质量分数为7.3%的稀盐酸,再向左右两烧杯中分别加入下列物质,充分反应后,天平仍然平衡的是( )
A.2.4gMg、2.4gFe B.5.6gZn、5.6gFe C.2.4gZn、2.4gMg D.10gZn、10gFe
9.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲、乙的溶液中所含溶质质量相等
B.t2℃时,将50g甲加入50g水中,可得到100g溶液
C.t2℃时,90g甲的饱和溶液稀释到20%需加水110g
D.t1℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数:甲>乙
10.某溶液的溶质质量分数为15%,下列有关说法正确的是( )
①在100份质量的溶液中含有15份质量的溶质
②在115份质量的溶液中含有15份质量的溶质
③在100份质量的溶剂中溶入15份质量的溶质
④在85份质量的溶剂中溶入15份质量的溶质
A.①② B.③④ C.②③ D.①④
11.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.t1℃时甲、乙饱和溶液,升温到t2℃时仍为饱和溶液
B.t1℃时,甲和乙各30g分别加入10水中,均形成饱和溶液
C.t2℃时,在100g水中加入60g甲,形成不饱和溶液
D.当甲中混有少量的乙,可以用蒸发结晶提纯甲
12.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
二、简答题
13、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是__ 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__ 物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__ (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__ 乙(填“大于”、“等于”、“小于”)。
14、20 ℃时,氯化钠的溶解度为36.0 g,对这句话的理解错误的是 (填序号)。
①100 g水中最多能溶解氯化钠固体36.0 g
②20 ℃时,36.0 g氯化钠固体全部溶解至少需要100 g水
③20 ℃时,100 g氯化钠饱和溶液中含有氯化钠36.0 g
④20 ℃时,从足量的氯化钠饱和溶液中蒸发100 g水,能析出36.0 g氯化钠晶体
⑤20 ℃时,氯化钠的饱和溶液中水与氯化钠的质量比为100∶36
⑥20 ℃时,将氯化钠与水以36∶100的质量比混合,可得该温度下氯化钠的饱和溶液
三、实验题
15.配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠________g, 水_______g。
(2)溶解过程中玻璃棒的作用是___________________。
(3)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有____。(填序号)
A 称量时,药品与砝码放反了
B 量取水的体积时,仰视读数
C 装瓶时,有少量溶液洒出
16.正确的方案设计和规范的实验操作有助于达到实验目的,请分析或改进以下实验。
实验目的 实验过程及现象 分析或改进
铁丝在氧气中燃烧 画图表示你的改进方法:_____。
探究物质溶解性的影响因素 为达到实验目的,你的改进方法是_____。
通过氢气在氧气中燃烧证明水的组成 现象:氢气燃烧,发出_____色火焰, 瓶壁发热。 该实验不能达到实验目的的原因是_____。
参考答案:
1.D
2.C
3.C
4.D
5.A
6.B
7.A
8.D
9.C
10.D
11.B
12.D
13、 升高温度 甲 降温结晶 小于
14、①③
15(1)充分反应后,最后剩余固体的质量为2g,说明10g样品中杂质的质量为2g,10g石灰石样品中碳酸钙的质量分数是。
(2)比较第一、二次的数据可知:20g盐酸完全反应可以消耗碳酸钙的质量为10g-8g=2g,设20g稀盐酸中溶质的质量为x
稀盐酸中溶质质量分数。
答:稀盐酸的溶质质量分数为7.3%。
16.D
一、单选题
1.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
2.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
3.下列有关实验现象的描述,正确的是
A.打开浓盐酸的瓶盖,瓶口冒白烟 B.高锰酸钾溶于汽油形成紫红色溶液
C.铁溶解在稀盐酸中,溶液颜色变成浅绿色 D.电解水时负极产生的气体能使带火星的木条复燃
4.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
5.溶液在日常生活中应用广泛。下列对溶液的有关说法不正确的是
A.溶液都是无色、透明的液体 B.一种溶液中只能有一种溶剂
C.溶液都是混合物 D.溶液中各部分性质相同
6.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠 B.量水
C.溶解 D.装瓶
7.下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
8.在已经调平的天平两端各放置一个等质量的烧杯,然后分别向两烧杯中加入100g溶质量分数为7.3%的稀盐酸,再向左右两烧杯中分别加入下列物质,充分反应后,天平仍然平衡的是( )
A.2.4gMg、2.4gFe B.5.6gZn、5.6gFe C.2.4gZn、2.4gMg D.10gZn、10gFe
9.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲、乙的溶液中所含溶质质量相等
B.t2℃时,将50g甲加入50g水中,可得到100g溶液
C.t2℃时,90g甲的饱和溶液稀释到20%需加水110g
D.t1℃时,分别将甲、乙的饱和溶液升温至t2℃,所得溶液的溶质质量分数:甲>乙
10.某溶液的溶质质量分数为15%,下列有关说法正确的是( )
①在100份质量的溶液中含有15份质量的溶质
②在115份质量的溶液中含有15份质量的溶质
③在100份质量的溶剂中溶入15份质量的溶质
④在85份质量的溶剂中溶入15份质量的溶质
A.①② B.③④ C.②③ D.①④
11.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.t1℃时甲、乙饱和溶液,升温到t2℃时仍为饱和溶液
B.t1℃时,甲和乙各30g分别加入10水中,均形成饱和溶液
C.t2℃时,在100g水中加入60g甲,形成不饱和溶液
D.当甲中混有少量的乙,可以用蒸发结晶提纯甲
12.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
二、简答题
13、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是__ 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__ 物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__ (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__ 乙(填“大于”、“等于”、“小于”)。
14、20 ℃时,氯化钠的溶解度为36.0 g,对这句话的理解错误的是 (填序号)。
①100 g水中最多能溶解氯化钠固体36.0 g
②20 ℃时,36.0 g氯化钠固体全部溶解至少需要100 g水
③20 ℃时,100 g氯化钠饱和溶液中含有氯化钠36.0 g
④20 ℃时,从足量的氯化钠饱和溶液中蒸发100 g水,能析出36.0 g氯化钠晶体
⑤20 ℃时,氯化钠的饱和溶液中水与氯化钠的质量比为100∶36
⑥20 ℃时,将氯化钠与水以36∶100的质量比混合,可得该温度下氯化钠的饱和溶液
三、实验题
15.配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠________g, 水_______g。
(2)溶解过程中玻璃棒的作用是___________________。
(3)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有____。(填序号)
A 称量时,药品与砝码放反了
B 量取水的体积时,仰视读数
C 装瓶时,有少量溶液洒出
16.正确的方案设计和规范的实验操作有助于达到实验目的,请分析或改进以下实验。
实验目的 实验过程及现象 分析或改进
铁丝在氧气中燃烧 画图表示你的改进方法:_____。
探究物质溶解性的影响因素 为达到实验目的,你的改进方法是_____。
通过氢气在氧气中燃烧证明水的组成 现象:氢气燃烧,发出_____色火焰, 瓶壁发热。 该实验不能达到实验目的的原因是_____。
参考答案:
1.D
2.C
3.C
4.D
5.A
6.B
7.A
8.D
9.C
10.D
11.B
12.D
13、 升高温度 甲 降温结晶 小于
14、①③
15(1)充分反应后,最后剩余固体的质量为2g,说明10g样品中杂质的质量为2g,10g石灰石样品中碳酸钙的质量分数是。
(2)比较第一、二次的数据可知:20g盐酸完全反应可以消耗碳酸钙的质量为10g-8g=2g,设20g稀盐酸中溶质的质量为x
稀盐酸中溶质质量分数。
答:稀盐酸的溶质质量分数为7.3%。
16.D
同课章节目录
