第九单元溶液测试题-2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液测试题-2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 140.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-14 07:07:43 | ||
图片预览

文档简介
第九单元《溶液》测试题
一、单选题
1.下列关于溶液的说法,正确的是( )
A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动
B.—定温度下的不饱和溶液还能溶解溶质,则一定温度下的饱和溶液不能溶解任何物质
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.—定质量的溶液,加水稀释前后,溶质质量分数不变
2、将下列物质分别加入适量水中,充分搅拌,不能得到溶液的是( )
A.硝酸钾 B.蔗糖 C.花生油 D.酒精
3、日常生活中除去油污的方法很多,下列现象不属于乳化的是( )
A.修车工用汽油洗去手上的油污
B.用洗发剂洗去头发上的油脂
C.用洗面奶洗去皮肤上的油脂
D.用洗洁精洗去餐具上的油污
4、下列说法正确的是( )
A.均一稳定的液体一定是溶液
B.饱和溶液一定是浓溶液
C.汽油洗涤油污属于乳化现象
D.将氢氧化钠溶于水,所得溶液温度升高
5.向液体X中加入固体Y,观察到U形管内红墨水左侧液面上升。下列液体X和固体Y的组合,符合题意的是
A.X是水,Y是氧化钙
B.X是水,Y是氢氧化钠
C.X是水,Y是硝酸铵
D.X是水,Y是氯化钠
6.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
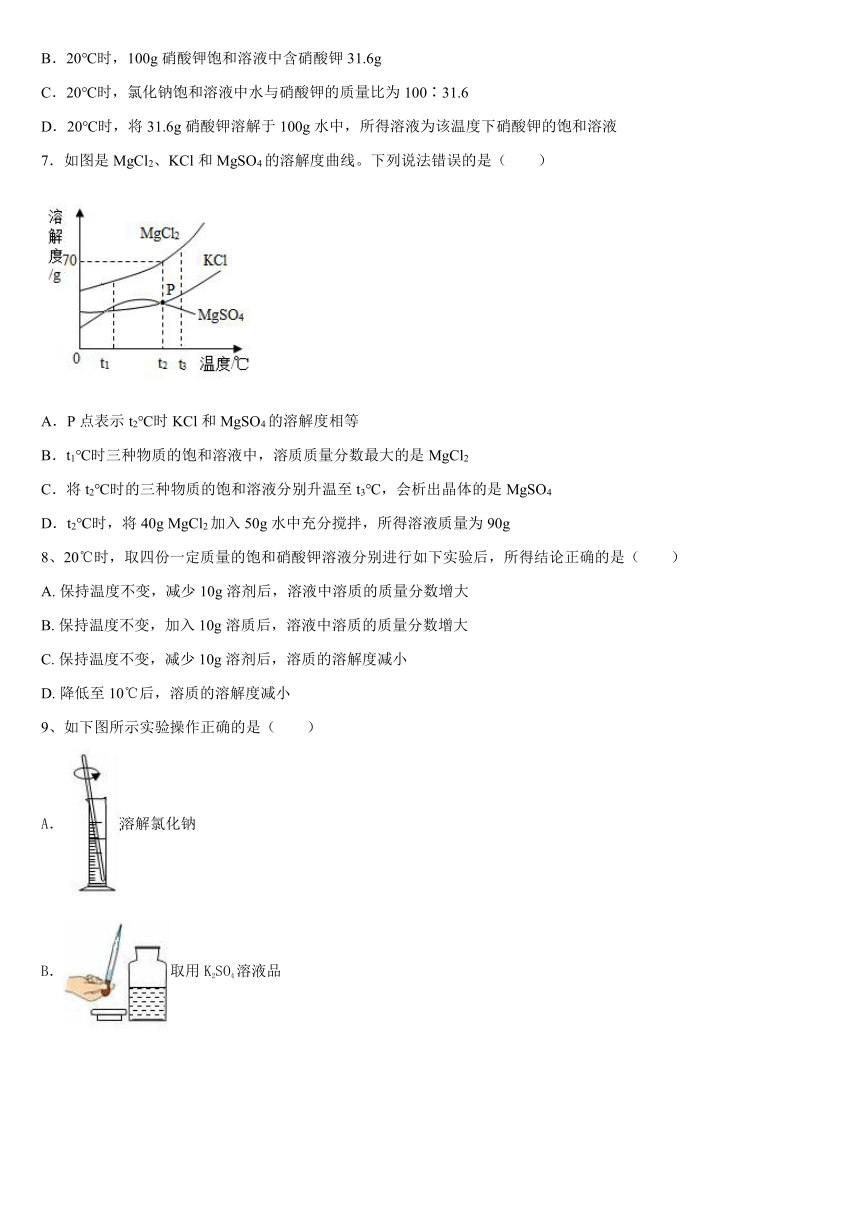
7.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
8、20℃时,取四份一定质量的饱和硝酸钾溶液分别进行如下实验后,所得结论正确的是( )
A. 保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B. 保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C. 保持温度不变,减少10g溶剂后,溶质的溶解度减小
D. 降低至10℃后,溶质的溶解度减小
9、如下图所示实验操作正确的是( )
A.溶解氯化钠
B.取用K2SO4溶液品
C.称量16gNaCl固体
D. O2的检验
10、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
11.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
12.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
二、简答题
13.根据下列实验报告回答问题。
活动与探究:氢氧化钠溶于水后液体温度的变化
探究目的 了解物质溶解前后液体温度变化情况;学习测量液体温度的方法
实验用品 药匙、烧杯、玻璃棒、温度计、氢氧化钠固体、水
操作过程(如图所示)
(1)图示③中的操作存在一处错误,应改正为_________。
(2)图示③中错误操作改正后,上述实验能否测 得氢氧化钠固体溶解前后液体温度的变化范围?为什么? _________。
14.海洋是地球上最大的储水库,蕴含着丰富的化学资源.海水晒盐能够得到粗盐和卤水. ①卤水中含有MgCl2、KCl和MgSO4等物质,如图是三种物质的溶解度曲线.t2℃时,三种物质的饱和溶液中,溶质质量分数最小的是________.
②将t2℃时三种物质的饱和溶液加热到t3℃以上时,仍然为饱和溶液的是________.
③将饱和氯化镁溶液由t3℃冷却至t1℃,下列四种叙述中,正确的是________(填序号).
Ⅰ.溶液的质量不变Ⅱ.氯化镁的溶解度变小
Ⅲ.溶液中溶质质量不变Ⅳ.溶液中溶质质量分数变小
④在t3℃时,60克KCl的饱和溶液与60克MgCl2的饱和溶液中,溶质MgCl2与KCl的质量比为3:1,则t3℃时MgCl2的溶解度为________.
三、实验
15.如图是配制50g质量分数为5%的氯化钠溶液的操作,试回答:
(1)正确的操作顺序是_______(填序号)。
(2)操作⑤中称量氯化钠时,若指针左偏,应进行的操作_______。
(3)操作②应选用_______量筒(50mL或100mL);量水时,若仰视读数,配得溶液的质量分数会_______(“偏大”或“偏小”)。
(4)操作③中玻璃棒的作用是_______。
(5)若用已配好的50g溶质质量分数为5%的氯化钠溶液配制溶质质量分数为2%的氯化钠溶液,需要加水的质量为_______。
16.如图1是A、B、C三种物质的溶解度曲线图。请回答:
(1)t1℃时,A、B、C三种物质的饱和溶液中溶质质量分数最大的是______。
(2)t2℃时,将30gA物质放入50g水中,充分溶解后所得溶液的质量是______g。
(3)A物质中混有少量的B物质,若提纯A物质,可采用的结晶方法是____。
(4)t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的氢氧化钠固体溶解后,A、C溶液的溶质质量分数的大小关系是______。
参考答案:
1.C
2.C
3.A
4.D
5.C
6.B
7.B
8.D
9.C
10.D
11.A
12.A
13. 用玻璃棒搅拌 )不能,因为没有测量加入氢氧化钠固体前水的温度
14. KCl; MgSO4; Ⅱ、Ⅳ; 100g
15.(1)④⑤①②③
(2)取出氯化钠直至天平平衡
(3) 50mL 偏小
(4)搅拌,加快溶解速率
(5)75g
16. B 75 降温结晶 A>C
一、单选题
1.下列关于溶液的说法,正确的是( )
A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动
B.—定温度下的不饱和溶液还能溶解溶质,则一定温度下的饱和溶液不能溶解任何物质
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.—定质量的溶液,加水稀释前后,溶质质量分数不变
2、将下列物质分别加入适量水中,充分搅拌,不能得到溶液的是( )
A.硝酸钾 B.蔗糖 C.花生油 D.酒精
3、日常生活中除去油污的方法很多,下列现象不属于乳化的是( )
A.修车工用汽油洗去手上的油污
B.用洗发剂洗去头发上的油脂
C.用洗面奶洗去皮肤上的油脂
D.用洗洁精洗去餐具上的油污
4、下列说法正确的是( )
A.均一稳定的液体一定是溶液
B.饱和溶液一定是浓溶液
C.汽油洗涤油污属于乳化现象
D.将氢氧化钠溶于水,所得溶液温度升高
5.向液体X中加入固体Y,观察到U形管内红墨水左侧液面上升。下列液体X和固体Y的组合,符合题意的是
A.X是水,Y是氧化钙
B.X是水,Y是氢氧化钠
C.X是水,Y是硝酸铵
D.X是水,Y是氯化钠
6.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
7.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
8、20℃时,取四份一定质量的饱和硝酸钾溶液分别进行如下实验后,所得结论正确的是( )
A. 保持温度不变,减少10g溶剂后,溶液中溶质的质量分数增大
B. 保持温度不变,加入10g溶质后,溶液中溶质的质量分数增大
C. 保持温度不变,减少10g溶剂后,溶质的溶解度减小
D. 降低至10℃后,溶质的溶解度减小
9、如下图所示实验操作正确的是( )
A.溶解氯化钠
B.取用K2SO4溶液品
C.称量16gNaCl固体
D. O2的检验
10、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
11.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
12.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
二、简答题
13.根据下列实验报告回答问题。
活动与探究:氢氧化钠溶于水后液体温度的变化
探究目的 了解物质溶解前后液体温度变化情况;学习测量液体温度的方法
实验用品 药匙、烧杯、玻璃棒、温度计、氢氧化钠固体、水
操作过程(如图所示)
(1)图示③中的操作存在一处错误,应改正为_________。
(2)图示③中错误操作改正后,上述实验能否测 得氢氧化钠固体溶解前后液体温度的变化范围?为什么? _________。
14.海洋是地球上最大的储水库,蕴含着丰富的化学资源.海水晒盐能够得到粗盐和卤水. ①卤水中含有MgCl2、KCl和MgSO4等物质,如图是三种物质的溶解度曲线.t2℃时,三种物质的饱和溶液中,溶质质量分数最小的是________.
②将t2℃时三种物质的饱和溶液加热到t3℃以上时,仍然为饱和溶液的是________.
③将饱和氯化镁溶液由t3℃冷却至t1℃,下列四种叙述中,正确的是________(填序号).
Ⅰ.溶液的质量不变Ⅱ.氯化镁的溶解度变小
Ⅲ.溶液中溶质质量不变Ⅳ.溶液中溶质质量分数变小
④在t3℃时,60克KCl的饱和溶液与60克MgCl2的饱和溶液中,溶质MgCl2与KCl的质量比为3:1,则t3℃时MgCl2的溶解度为________.
三、实验
15.如图是配制50g质量分数为5%的氯化钠溶液的操作,试回答:
(1)正确的操作顺序是_______(填序号)。
(2)操作⑤中称量氯化钠时,若指针左偏,应进行的操作_______。
(3)操作②应选用_______量筒(50mL或100mL);量水时,若仰视读数,配得溶液的质量分数会_______(“偏大”或“偏小”)。
(4)操作③中玻璃棒的作用是_______。
(5)若用已配好的50g溶质质量分数为5%的氯化钠溶液配制溶质质量分数为2%的氯化钠溶液,需要加水的质量为_______。
16.如图1是A、B、C三种物质的溶解度曲线图。请回答:
(1)t1℃时,A、B、C三种物质的饱和溶液中溶质质量分数最大的是______。
(2)t2℃时,将30gA物质放入50g水中,充分溶解后所得溶液的质量是______g。
(3)A物质中混有少量的B物质,若提纯A物质,可采用的结晶方法是____。
(4)t1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的氢氧化钠固体溶解后,A、C溶液的溶质质量分数的大小关系是______。
参考答案:
1.C
2.C
3.A
4.D
5.C
6.B
7.B
8.D
9.C
10.D
11.A
12.A
13. 用玻璃棒搅拌 )不能,因为没有测量加入氢氧化钠固体前水的温度
14. KCl; MgSO4; Ⅱ、Ⅳ; 100g
15.(1)④⑤①②③
(2)取出氯化钠直至天平平衡
(3) 50mL 偏小
(4)搅拌,加快溶解速率
(5)75g
16. B 75 降温结晶 A>C
同课章节目录
