化学专题2 各单元 综合练习(有答案)
图片预览


文档简介
化学专题2 第一单元练习
班别∶ 姓名∶ 座号∶ 分数∶
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
单项选择题,每小题5分,满分共1 0 0分,请把正确答案编号填入上表。
1、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是( )
A、Cl2 B、O2
C、H2 D、HCl
2、若上题中电解的是未精制的饱和食盐水,结果很快在某一电极附近出现浑浊现象。造成浑浊的难溶物主要是 ( )
A、碳酸镁 B、硫酸钡
C、氢氧化镁 D、碳酸钡
3、2.4克某金属和足量的氯气充分反应,所得固体比原金属增重7.1克,若该固体为单一价态的氯化物,则其化学式为 ( )
A、NaCl B、MgCl2 C、FeCl3 D、CuCl2
4、下列关于液氯和氯水的叙述中正确的是( )
A、液氯是纯净物,而氯水是混合物 B、液氯和氯水都有酸性
C、液氯和氯水都有漂白性 D、液氯无色,氯水呈黄绿色
5、下列关于氯水的叙述,正确的是( )
A、新制氯水中只含Cl2和H2O分子
B、新制氯水可使蓝色石蕊试纸先变红后褪色
C、光照氯水有气泡逸出,该气体是Cl2
D、氯水放置数天后酸性减弱
6、市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
A、Cl2 B、H2SO4 C、NaClO D、KMnO4
7、将Cl2制成漂白粉的主要目的是( )
A、增强漂白和消毒作用 B、使它转化为较稳定物质,便于保存和运输
C、使它转化为较易溶于水的物质 D、增加氯的百分含量,有利于漂白、消毒
8、在常温常压下,将盛满氯气的一支试管倒立在水槽中,当日光照射一段时间至不再反应为止,试管中最后残留气体体积占整个试管体积的 ( )
A、 B、 C、 D、
9、从1897年英国首次使用氯气对给水管网消毒以来,氯气用于自来水消毒已经经历了100多年的历史。目前,我国大多数城市仍然采用氯气消毒法对自来水进行净化、消毒。氯气之所以长期用于自来水消毒,原因是 ( )
A、氯气有毒,可以毒死细菌、病毒
B、氯气具有刺激性气味,可以熏死细菌、病毒
C、氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒
D、氯气用于自来水消毒的工艺简单,易于操作,且成本低并能保护人体健康无副作用
10、为了防止储存氯气的钢瓶被腐蚀,钢瓶在装入氯气前必须 ( )
A、在钢瓶中充入稀有气体 B、彻底干燥钢瓶内壁
C、用盐酸彻底清洁钢瓶 D、除去钢瓶表层的铁锈
11、下列溶液中不存在氯离子的是
A、氯水 B、氯化氢溶液 C、漂白粉溶液 D、氯酸钾溶液
12、下列关于物质的保存不正确的是 ( )
A、AgNO3溶液应保存在棕色瓶中 B、氯水保存在无色广口瓶中
C、液氯可以保存在干燥的钢瓶中 D、漂白粉不能露置于空气中
13、用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是 ( )
A、漂白粉被氧化了
B、有色布条被空气中的氧气氧化了 C、漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO D、漂白粉溶液蒸发掉部分水,其浓度增大
14、如今人们把食品分为绿色食品、蓝色食品、白色食品等类型。绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品。下面属于蓝色食品的是 ( )
A、食醋 B、面粉 C、海带 D、白酒
15、医生建议患甲状腺肿大的病人多吃海带,这是由于海带中含较丰富的( )
A、碘元素 B、铁元素 C、钾元素 D、锌元素
16、实验室从海带中提取碘有如下化学反应:2NaI+Cl2=2NaCl+I2 这一反应所属类型( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
17、向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A、KCl B、NaCl和KCl C、NaCl和KBr D、NaCl、KCl和I2
18、下列物质与其用途相符合的是( )
①Cl2——做消毒剂 ②AgBr——制胶卷,感光纸 ③AgI——人工降雨 ④碘——预防甲状腺肿大 ⑤淀粉——检验I2的存在 ⑥NaClO——漂白纺织物
A、②③④⑤⑥ B、①②③④⑤ C、②③④⑤ D、全部
19、痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是 ( )
A、①AgNO3 ②NaBr ③AgBr B、①AgNO3 ②NaCl ③AgCl
C、①AgCl ②AgNO3 ③NaCl D、①AgNO3 ②NaI ③AgI
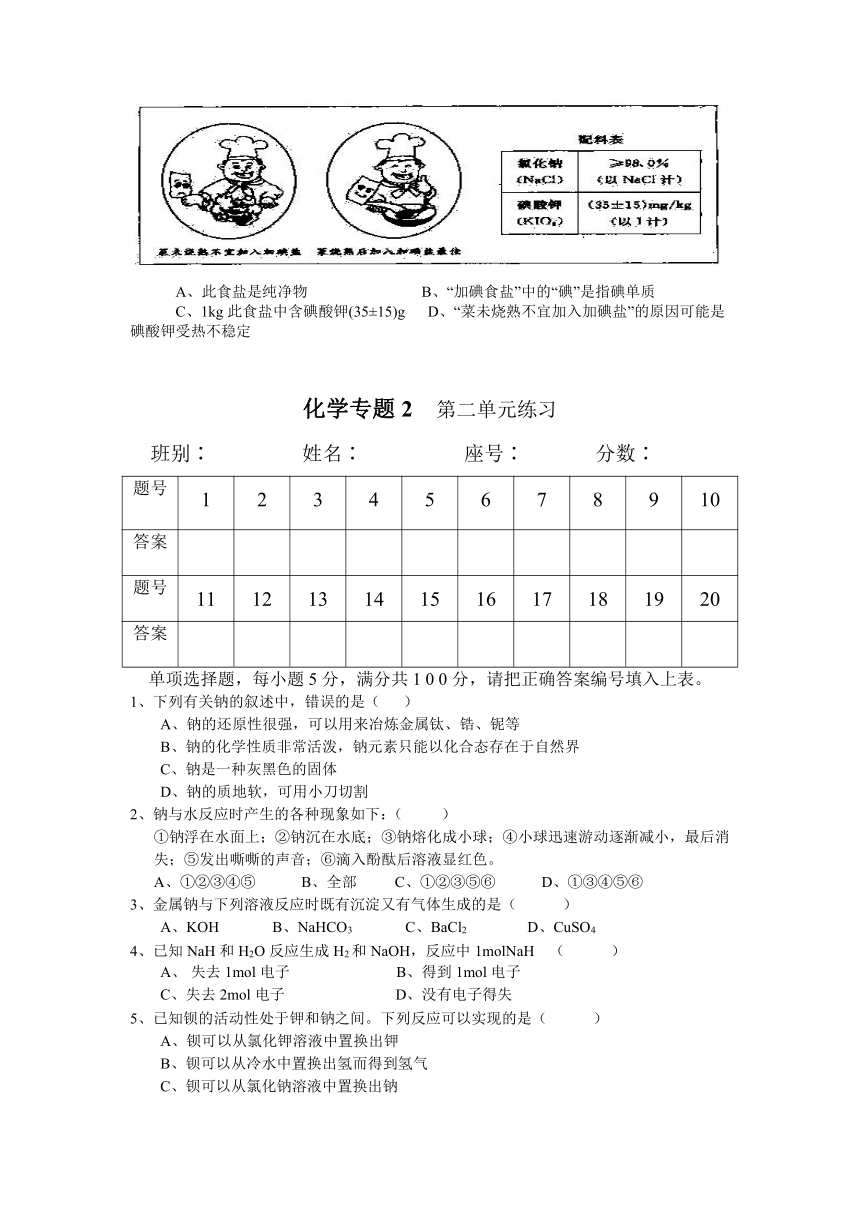
20、下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是 ( ) (相对原子质量:O—16;K—39;I—127)
A、此食盐是纯净物 B、“加碘食盐”中的“碘”是指碘单质
C、1kg此食盐中含碘酸钾(35±15)g D、“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
化学专题2 第二单元练习
班别∶ 姓名∶ 座号∶ 分数∶
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
单项选择题,每小题5分,满分共1 0 0分,请把正确答案编号填入上表。
1、下列有关钠的叙述中,错误的是( )
A、钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B、钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C、钠是一种灰黑色的固体
D、钠的质地软,可用小刀切割
2、钠与水反应时产生的各种现象如下:( )
①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
A、①②③④⑤ B、全部 C、①②③⑤⑥ D、①③④⑤⑥
3、金属钠与下列溶液反应时既有沉淀又有气体生成的是( )
A、KOH B、NaHCO3 C、BaCl2 D、CuSO4
4、已知NaH和H2O反应生成H2和NaOH,反应中1molNaH ( )
失去1mol电子 B、得到1mol电子
C、失去2mol电子 D、没有电子得失
5、已知钡的活动性处于钾和钠之间。下列反应可以实现的是( )
A、钡可以从氯化钾溶液中置换出钾
B、钡可以从冷水中置换出氢而得到氢气
C、钡可以从氯化钠溶液中置换出钠
D、在溶液中钡离子可以氧化金属锌
6、除去Na2CO3固体中混有的少量NaHCO3的最佳方法是( )
A、加入适量盐酸 B、加入NaOH溶液
C、加热灼烧 D、配成溶液后通入CO2
7、下列实验操作最终可得无色透明溶液的是( )
A、过量CO2通入饱和Na2CO3溶液中 B、将少量CO2通入澄清石灰水中
C、将少量的钠投入到饱和的NaHCO3溶液中 D、少量的钠投入到MgCl2溶液中
8、少量钠着火时,可用来灭火的物质或器材是( )
A、煤油 B、泡沫灭火器
C、砂 D、水
9、Na、Mg、Al各1mol分别与50ml 2mol/L的硫酸溶液反应,下列说法正确的是( )
A、镁比铝产生的氢气多 B、钠放出氢气最多
C、铝最终产生氢气最多 D、产生氢气的量无法比较
10、镁着火时,可用于灭火的物质是( )
A、干冰 B、氮气 C、水 D、黄沙
11、有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
A、Mg和Al B、Mg和Zn C、Fe和Zn D、Cu和Fe
12、下列各组物质属于电解质的一组是( )
A、空气、烧碱 B、苛性钠、小苏打 C、乙醇、干冰 D、硫酸镁、乙烯
13、用氢气作还原剂和金属作还原剂相比,可得金属的纯度的说法正确的是( )
A、用氢气的高 B、用金属的高 C、二者相同 D、无法比较
14、下列各种冶炼方法中,可制得相应金属的为( )
A、加热氧化镁 B、加热碳酸钙
C、电解熔融氯化钠 D、氯化钠与铝粉高温共热
15、下列科学家中,为我国化学工业作出重大贡献的是( )
A、邓稼先 B、李四光 C、华罗庚 D、侯德榜
16、不能使湿润的碘化钾淀粉试纸变蓝的是( )
A、氯水 B、碘水 C、稀硝酸 D、氯化钾溶液
17. 钠的下列用途与钠的化学性质无关的是( )
A.制取过氧化钠 B.作原子反应堆的导热剂 C.冶炼金属钛 D、制得氢氧化钠
18、下列物质既能与酸反应又能与碱反应的是( )
A、Na2CO3 B、NaOH C、BaCl2 D、NaHCO3
19、把金属钠投入到下列物质的溶液中,溶液质量减轻且生成红褐色沉淀的是( )
A、HCl B、Na2SO4 C、FeCl3 D、CuSO4
20、下列物质中能跟镁反应并生成氢气的是∶
A、醋酸 B、氢氧化钠溶液 C、冷水 D、二氧化碳气体
化学专题2 氧化还原及离子反应练习
班别∶ 姓名∶ 座号∶ 分数∶
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
单项选择题,每小题5分,满分共1 0 0分,请把正确答案编号填入上表。
1、氧化还原反应的实质是( )
A、元素化合价发生变化 B、反应中有氧原子的得失
C、反应中有电子得失或电子对的偏移 D、反应后生成新物质
2、下列反应一定是氧化还原反应的是( )
A、化合反应 B、分解反应 C、复分解反应 D、置换反应
3、下列反应中,不属于氧化还原反应的是( )
A、3Cl2+6KOH==5KCl+KClO3+3H2O B、2FeBr2+3Cl2==2FeCl3+2Br2
C、SnCl4+2H2O==SnO2+4HCl D、C6H12O6+O2=6CO2+6H2O
4、下列反应中,水作还原剂的是( )
A、2Na+2H2O==2NaOH+H2↑ B、Cl2+H2OHCl+HClO
C、2F2+2H2O==4HF+O2 D、SO2+H2OH2SO3
5、从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )
A、溴离子具有氧化性 B、氯气是还原剂
C、该反应属于复分解反应 D、氯气是氧化剂
6、在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氧化剂与还原剂物质的量之比为( )
A、1︰2 B、1︰1 C、 2︰1 D、 3︰2
7、在下列各反应中,盐酸既表现出酸性又表现出氧化性的是
HCI+NaOH=NaCl+H2O B、Zn+2HCl=ZnCl2+H2↑
C、HCl+AgNO3=AgCl↓+HNO3 D、MnO2+4HCI(浓)=MnCl2+C12↑+2H2O
8、下列物质的用途,利用氧化还原反应的是( )
A、用氯气消毒自来水 B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3)
C、用食盐腌渍食物 D、用小苏打治疗胃酸过多
9、在pH=1的溶液中,可以大量共存的离子是( )
A、K+、Na+、SO42—、SO32— B、NH4+、Mg2+、SO42—、Cl—
C、Na+、K+、HCO3—、Cl— D、K+、Na+、OH—、NO3—
10、能用离子方程式H++OH-=H2O表示的反应是( )
A、稀醋酸和稀氨水反应 B、稀硫酸和烧碱溶液反应
C、稀盐酸和氢氧化铜反应 D、稀硫酸和氢氧化钡溶液反应
11、下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A、H+、I-、Br2、Na+ B、Ag+、NO3-、Cl-、K+
C、K+、Ba2+、OH-、SO42- D、Cu2+、NH4+、Br-、OH-
12、下列反应的离子方程式错误的是( )
A、向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B、盐酸溶液与氨水混合
H++NH3·H2O=NH4++H2O
C、氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O
D、过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O
13、下列离子方程式正确的是 ( )
A、碳酸氢钠溶液与少量石灰水反应 HCO3-+ Ca2+ + OH- = CaCO3↓ + H2O
B、氯化铵与氢氧化钠两种浓溶液混合加热OH- + NH4+△ H2O + NH3↑
C、氢氧化镁与稀硫酸反应 H+ + OH- = H2O
D、碳酸钠溶液与盐酸反应Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
14、能正确表示下列化学反应的离子方程式的是 ( )
A、氢氧化钡溶液与盐酸的反应 Ba2+ +2OH-+2H+ +2Cl- =BaCl2↓+2 H2O
B、澄清的石灰水与稀盐酸反应 Ca (OH)2 + 2H+ = Ca2++ 2H2O
C、铜片插入硝酸银溶液中 Cu +Ag+ = Cu2+ + Ag
D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2(
15、在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是( )
A、Mg2+、Na+、Cl-、CO32- B、Ba2+、K+、OH-、NO3-
C、H+、Al3+、NH4+、SO42- D、Na+、Ca2+、Cl-、HCO3-
16、只能表示一个化学反应的离子方程式为( )
A、BaCO3+2CH3COOH==Ba2++CO2↑+H2O+2CH3COO-
B、Ba2++SO42-==BaSO4↓
C、CH3COOH+OH-==CH3COO-+ H2O
D、Fe3++3NH3?H2O==Fe(OH)3↓+3NH4+
17、离子方程式BaCO3+2H+== CO2↑+H2O+ Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A、①③ B、①④⑤ C、②④⑤ D、①⑤
18、下列反应属于离子反应的是( )
A、H2和O2反应生成水 B、锌片投入稀硫酸中
C、KClO3和MnO2混合共热制O2 D、CuSO4·5H2O=CuSO4+5H2O
19、在强酸性溶液中可发生如下反应:2Mn2++5R2O8x-+8H2O==16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的是( )
A、Mn2+ B、R2O8x- C、H2O D、MnO4-
20、据所给的4个反应,判断下列四种物质的氧化性由强到弱的正确顺序是( )
(1)Cl2+2KI=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2 (4)H2S +I2=2HI+S↓
A、S﹥I2﹥Fe3+﹥Cl2 B、Cl2﹥Fe3+﹥I2﹥S
C、Fe3+﹥Cl2﹥S﹥I2 D、 Cl2﹥I2﹥Fe3+﹥S
第一单元练习参考答案
1、A 2、C 3、B 4、A 5、B 6、C 7、B 8、A 9、C 10、B 11、D 12、B 13、C 14、C 15A 16C 17、B 18、D 19、B 20、D
第二单元练习参考答案∶
1、C 2、D 3、D 4、A 5、B 6、C 7、C 8、C 9、B 10、D
11、B 12、B 13、A 14、C 15、D 16、D 17、B 18、D 19、C 20、A
专题2 氧化还原及离子反应练习参考答案∶
1、C 2、D 3、C 4、C 5、D 6、B 7、B 8、A 9、B 10、B
11、A 12、D 13、B 14、D 15、D 16、A 17、C 18、B 19、B 20、B
班别∶ 姓名∶ 座号∶ 分数∶
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
单项选择题,每小题5分,满分共1 0 0分,请把正确答案编号填入上表。
1、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是( )
A、Cl2 B、O2
C、H2 D、HCl
2、若上题中电解的是未精制的饱和食盐水,结果很快在某一电极附近出现浑浊现象。造成浑浊的难溶物主要是 ( )
A、碳酸镁 B、硫酸钡
C、氢氧化镁 D、碳酸钡
3、2.4克某金属和足量的氯气充分反应,所得固体比原金属增重7.1克,若该固体为单一价态的氯化物,则其化学式为 ( )
A、NaCl B、MgCl2 C、FeCl3 D、CuCl2
4、下列关于液氯和氯水的叙述中正确的是( )
A、液氯是纯净物,而氯水是混合物 B、液氯和氯水都有酸性
C、液氯和氯水都有漂白性 D、液氯无色,氯水呈黄绿色
5、下列关于氯水的叙述,正确的是( )
A、新制氯水中只含Cl2和H2O分子
B、新制氯水可使蓝色石蕊试纸先变红后褪色
C、光照氯水有气泡逸出,该气体是Cl2
D、氯水放置数天后酸性减弱
6、市场上销售的“84”消毒液,其商品标识上注明;①本品为无色液体呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
A、Cl2 B、H2SO4 C、NaClO D、KMnO4
7、将Cl2制成漂白粉的主要目的是( )
A、增强漂白和消毒作用 B、使它转化为较稳定物质,便于保存和运输
C、使它转化为较易溶于水的物质 D、增加氯的百分含量,有利于漂白、消毒
8、在常温常压下,将盛满氯气的一支试管倒立在水槽中,当日光照射一段时间至不再反应为止,试管中最后残留气体体积占整个试管体积的 ( )
A、 B、 C、 D、
9、从1897年英国首次使用氯气对给水管网消毒以来,氯气用于自来水消毒已经经历了100多年的历史。目前,我国大多数城市仍然采用氯气消毒法对自来水进行净化、消毒。氯气之所以长期用于自来水消毒,原因是 ( )
A、氯气有毒,可以毒死细菌、病毒
B、氯气具有刺激性气味,可以熏死细菌、病毒
C、氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒
D、氯气用于自来水消毒的工艺简单,易于操作,且成本低并能保护人体健康无副作用
10、为了防止储存氯气的钢瓶被腐蚀,钢瓶在装入氯气前必须 ( )
A、在钢瓶中充入稀有气体 B、彻底干燥钢瓶内壁
C、用盐酸彻底清洁钢瓶 D、除去钢瓶表层的铁锈
11、下列溶液中不存在氯离子的是
A、氯水 B、氯化氢溶液 C、漂白粉溶液 D、氯酸钾溶液
12、下列关于物质的保存不正确的是 ( )
A、AgNO3溶液应保存在棕色瓶中 B、氯水保存在无色广口瓶中
C、液氯可以保存在干燥的钢瓶中 D、漂白粉不能露置于空气中
13、用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是 ( )
A、漂白粉被氧化了
B、有色布条被空气中的氧气氧化了 C、漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO D、漂白粉溶液蒸发掉部分水,其浓度增大
14、如今人们把食品分为绿色食品、蓝色食品、白色食品等类型。绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品。下面属于蓝色食品的是 ( )
A、食醋 B、面粉 C、海带 D、白酒
15、医生建议患甲状腺肿大的病人多吃海带,这是由于海带中含较丰富的( )
A、碘元素 B、铁元素 C、钾元素 D、锌元素
16、实验室从海带中提取碘有如下化学反应:2NaI+Cl2=2NaCl+I2 这一反应所属类型( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
17、向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A、KCl B、NaCl和KCl C、NaCl和KBr D、NaCl、KCl和I2
18、下列物质与其用途相符合的是( )
①Cl2——做消毒剂 ②AgBr——制胶卷,感光纸 ③AgI——人工降雨 ④碘——预防甲状腺肿大 ⑤淀粉——检验I2的存在 ⑥NaClO——漂白纺织物
A、②③④⑤⑥ B、①②③④⑤ C、②③④⑤ D、全部
19、痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是 ( )
A、①AgNO3 ②NaBr ③AgBr B、①AgNO3 ②NaCl ③AgCl
C、①AgCl ②AgNO3 ③NaCl D、①AgNO3 ②NaI ③AgI
20、下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是 ( ) (相对原子质量:O—16;K—39;I—127)
A、此食盐是纯净物 B、“加碘食盐”中的“碘”是指碘单质
C、1kg此食盐中含碘酸钾(35±15)g D、“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
化学专题2 第二单元练习
班别∶ 姓名∶ 座号∶ 分数∶
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
单项选择题,每小题5分,满分共1 0 0分,请把正确答案编号填入上表。
1、下列有关钠的叙述中,错误的是( )
A、钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B、钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C、钠是一种灰黑色的固体
D、钠的质地软,可用小刀切割
2、钠与水反应时产生的各种现象如下:( )
①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
A、①②③④⑤ B、全部 C、①②③⑤⑥ D、①③④⑤⑥
3、金属钠与下列溶液反应时既有沉淀又有气体生成的是( )
A、KOH B、NaHCO3 C、BaCl2 D、CuSO4
4、已知NaH和H2O反应生成H2和NaOH,反应中1molNaH ( )
失去1mol电子 B、得到1mol电子
C、失去2mol电子 D、没有电子得失
5、已知钡的活动性处于钾和钠之间。下列反应可以实现的是( )
A、钡可以从氯化钾溶液中置换出钾
B、钡可以从冷水中置换出氢而得到氢气
C、钡可以从氯化钠溶液中置换出钠
D、在溶液中钡离子可以氧化金属锌
6、除去Na2CO3固体中混有的少量NaHCO3的最佳方法是( )
A、加入适量盐酸 B、加入NaOH溶液
C、加热灼烧 D、配成溶液后通入CO2
7、下列实验操作最终可得无色透明溶液的是( )
A、过量CO2通入饱和Na2CO3溶液中 B、将少量CO2通入澄清石灰水中
C、将少量的钠投入到饱和的NaHCO3溶液中 D、少量的钠投入到MgCl2溶液中
8、少量钠着火时,可用来灭火的物质或器材是( )
A、煤油 B、泡沫灭火器
C、砂 D、水
9、Na、Mg、Al各1mol分别与50ml 2mol/L的硫酸溶液反应,下列说法正确的是( )
A、镁比铝产生的氢气多 B、钠放出氢气最多
C、铝最终产生氢气最多 D、产生氢气的量无法比较
10、镁着火时,可用于灭火的物质是( )
A、干冰 B、氮气 C、水 D、黄沙
11、有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
A、Mg和Al B、Mg和Zn C、Fe和Zn D、Cu和Fe
12、下列各组物质属于电解质的一组是( )
A、空气、烧碱 B、苛性钠、小苏打 C、乙醇、干冰 D、硫酸镁、乙烯
13、用氢气作还原剂和金属作还原剂相比,可得金属的纯度的说法正确的是( )
A、用氢气的高 B、用金属的高 C、二者相同 D、无法比较
14、下列各种冶炼方法中,可制得相应金属的为( )
A、加热氧化镁 B、加热碳酸钙
C、电解熔融氯化钠 D、氯化钠与铝粉高温共热
15、下列科学家中,为我国化学工业作出重大贡献的是( )
A、邓稼先 B、李四光 C、华罗庚 D、侯德榜
16、不能使湿润的碘化钾淀粉试纸变蓝的是( )
A、氯水 B、碘水 C、稀硝酸 D、氯化钾溶液
17. 钠的下列用途与钠的化学性质无关的是( )
A.制取过氧化钠 B.作原子反应堆的导热剂 C.冶炼金属钛 D、制得氢氧化钠
18、下列物质既能与酸反应又能与碱反应的是( )
A、Na2CO3 B、NaOH C、BaCl2 D、NaHCO3
19、把金属钠投入到下列物质的溶液中,溶液质量减轻且生成红褐色沉淀的是( )
A、HCl B、Na2SO4 C、FeCl3 D、CuSO4
20、下列物质中能跟镁反应并生成氢气的是∶
A、醋酸 B、氢氧化钠溶液 C、冷水 D、二氧化碳气体
化学专题2 氧化还原及离子反应练习
班别∶ 姓名∶ 座号∶ 分数∶
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
单项选择题,每小题5分,满分共1 0 0分,请把正确答案编号填入上表。
1、氧化还原反应的实质是( )
A、元素化合价发生变化 B、反应中有氧原子的得失
C、反应中有电子得失或电子对的偏移 D、反应后生成新物质
2、下列反应一定是氧化还原反应的是( )
A、化合反应 B、分解反应 C、复分解反应 D、置换反应
3、下列反应中,不属于氧化还原反应的是( )
A、3Cl2+6KOH==5KCl+KClO3+3H2O B、2FeBr2+3Cl2==2FeCl3+2Br2
C、SnCl4+2H2O==SnO2+4HCl D、C6H12O6+O2=6CO2+6H2O
4、下列反应中,水作还原剂的是( )
A、2Na+2H2O==2NaOH+H2↑ B、Cl2+H2OHCl+HClO
C、2F2+2H2O==4HF+O2 D、SO2+H2OH2SO3
5、从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )
A、溴离子具有氧化性 B、氯气是还原剂
C、该反应属于复分解反应 D、氯气是氧化剂
6、在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氧化剂与还原剂物质的量之比为( )
A、1︰2 B、1︰1 C、 2︰1 D、 3︰2
7、在下列各反应中,盐酸既表现出酸性又表现出氧化性的是
HCI+NaOH=NaCl+H2O B、Zn+2HCl=ZnCl2+H2↑
C、HCl+AgNO3=AgCl↓+HNO3 D、MnO2+4HCI(浓)=MnCl2+C12↑+2H2O
8、下列物质的用途,利用氧化还原反应的是( )
A、用氯气消毒自来水 B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3)
C、用食盐腌渍食物 D、用小苏打治疗胃酸过多
9、在pH=1的溶液中,可以大量共存的离子是( )
A、K+、Na+、SO42—、SO32— B、NH4+、Mg2+、SO42—、Cl—
C、Na+、K+、HCO3—、Cl— D、K+、Na+、OH—、NO3—
10、能用离子方程式H++OH-=H2O表示的反应是( )
A、稀醋酸和稀氨水反应 B、稀硫酸和烧碱溶液反应
C、稀盐酸和氢氧化铜反应 D、稀硫酸和氢氧化钡溶液反应
11、下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A、H+、I-、Br2、Na+ B、Ag+、NO3-、Cl-、K+
C、K+、Ba2+、OH-、SO42- D、Cu2+、NH4+、Br-、OH-
12、下列反应的离子方程式错误的是( )
A、向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B、盐酸溶液与氨水混合
H++NH3·H2O=NH4++H2O
C、氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O
D、过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O
13、下列离子方程式正确的是 ( )
A、碳酸氢钠溶液与少量石灰水反应 HCO3-+ Ca2+ + OH- = CaCO3↓ + H2O
B、氯化铵与氢氧化钠两种浓溶液混合加热OH- + NH4+△ H2O + NH3↑
C、氢氧化镁与稀硫酸反应 H+ + OH- = H2O
D、碳酸钠溶液与盐酸反应Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
14、能正确表示下列化学反应的离子方程式的是 ( )
A、氢氧化钡溶液与盐酸的反应 Ba2+ +2OH-+2H+ +2Cl- =BaCl2↓+2 H2O
B、澄清的石灰水与稀盐酸反应 Ca (OH)2 + 2H+ = Ca2++ 2H2O
C、铜片插入硝酸银溶液中 Cu +Ag+ = Cu2+ + Ag
D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2(
15、在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是( )
A、Mg2+、Na+、Cl-、CO32- B、Ba2+、K+、OH-、NO3-
C、H+、Al3+、NH4+、SO42- D、Na+、Ca2+、Cl-、HCO3-
16、只能表示一个化学反应的离子方程式为( )
A、BaCO3+2CH3COOH==Ba2++CO2↑+H2O+2CH3COO-
B、Ba2++SO42-==BaSO4↓
C、CH3COOH+OH-==CH3COO-+ H2O
D、Fe3++3NH3?H2O==Fe(OH)3↓+3NH4+
17、离子方程式BaCO3+2H+== CO2↑+H2O+ Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A、①③ B、①④⑤ C、②④⑤ D、①⑤
18、下列反应属于离子反应的是( )
A、H2和O2反应生成水 B、锌片投入稀硫酸中
C、KClO3和MnO2混合共热制O2 D、CuSO4·5H2O=CuSO4+5H2O
19、在强酸性溶液中可发生如下反应:2Mn2++5R2O8x-+8H2O==16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在。在反应中充当氧化剂的是( )
A、Mn2+ B、R2O8x- C、H2O D、MnO4-
20、据所给的4个反应,判断下列四种物质的氧化性由强到弱的正确顺序是( )
(1)Cl2+2KI=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+2HCl+I2 (4)H2S +I2=2HI+S↓
A、S﹥I2﹥Fe3+﹥Cl2 B、Cl2﹥Fe3+﹥I2﹥S
C、Fe3+﹥Cl2﹥S﹥I2 D、 Cl2﹥I2﹥Fe3+﹥S
第一单元练习参考答案
1、A 2、C 3、B 4、A 5、B 6、C 7、B 8、A 9、C 10、B 11、D 12、B 13、C 14、C 15A 16C 17、B 18、D 19、B 20、D
第二单元练习参考答案∶
1、C 2、D 3、D 4、A 5、B 6、C 7、C 8、C 9、B 10、D
11、B 12、B 13、A 14、C 15、D 16、D 17、B 18、D 19、C 20、A
专题2 氧化还原及离子反应练习参考答案∶
1、C 2、D 3、C 4、C 5、D 6、B 7、B 8、A 9、B 10、B
11、A 12、D 13、B 14、D 15、D 16、A 17、C 18、B 19、B 20、B
