原子核外电子的排布_1
图片预览




文档简介
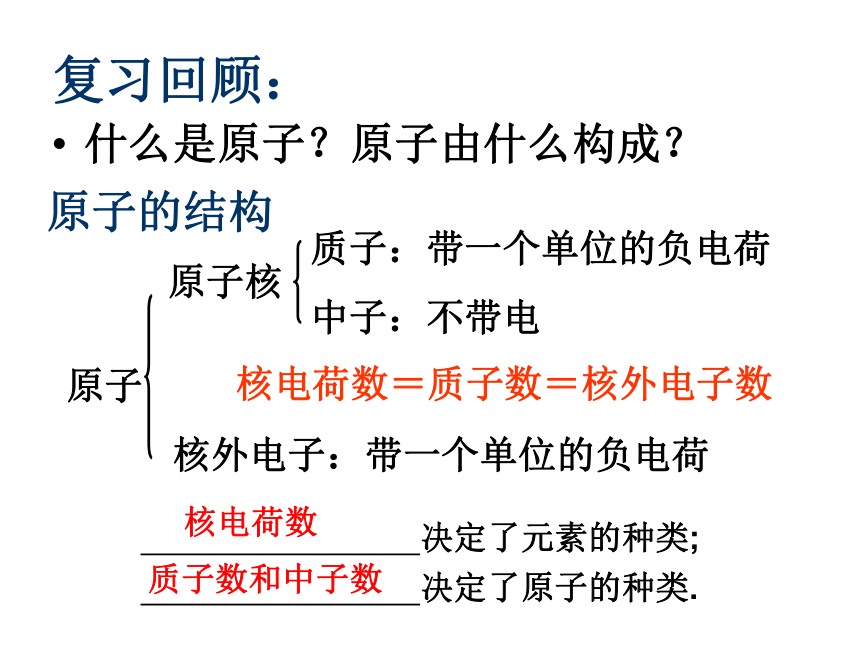
课件18张PPT。专题1 微观结构与物质的多样性第一单元 核外电子排布与周期性复习回顾:什么是原子?原子由什么构成?原子的结构核电荷数=质子数=核外电子数 决定了元素的种类;
决定了原子的种类.核电荷数质子数和中子数思考:电子的运动与宏观物体相比,
有何不同?
核外电子的运动有何特点?
设疑:电子绕核运动有没有什么规律呢?
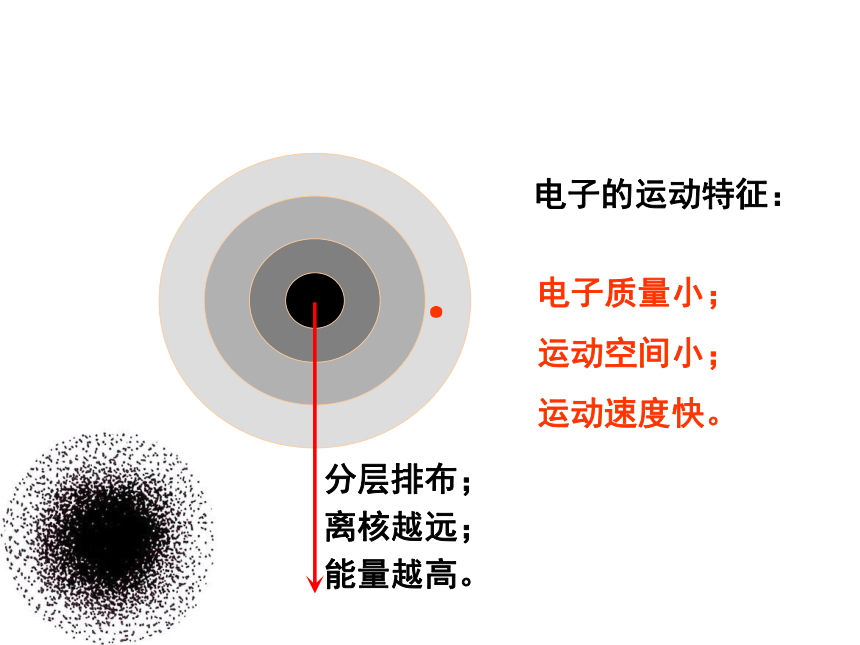
电子的运动特征:电子质量小;
运动空间小;
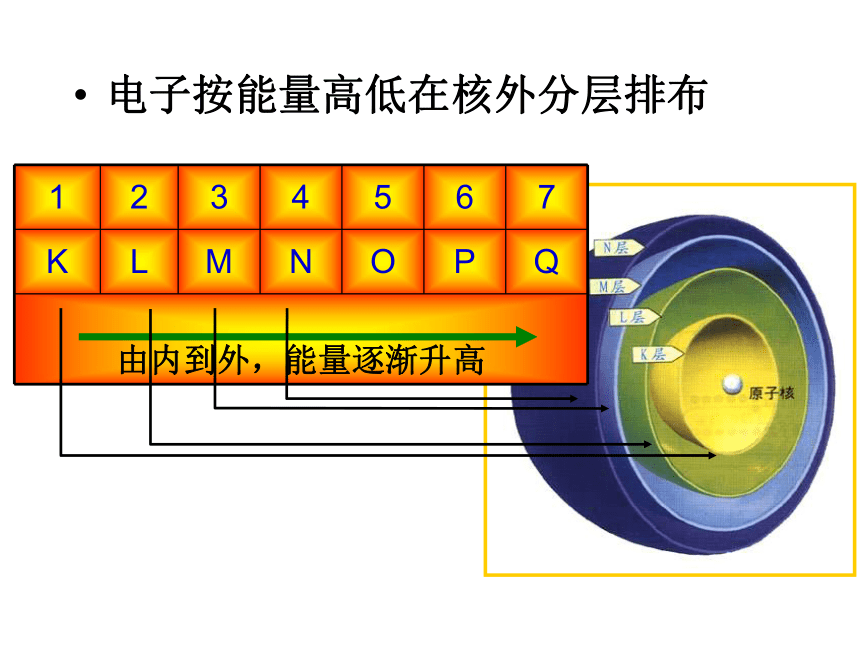
运动速度快。能量越高。离核越远;分层排布;一、原子核外电子的分层排布 1、原子结构示意图为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高2、原子核外电子运动区域与电子能量的关系 电子按能量高低在核外分层排布表1-1稀有气体元素原子电子层排布2 8 18 322
8
8
8
8
8讨论
1.根据表1-1和在初中学习的部分元素原子结构示意图的知识,
讨论核电荷数1~18的元素原子核外电子排布的情形以及核外电子
排布的一般规律,并将讨论的结果分别填入表1-2和表1-3中。表1-3? 核外电子分层排布的一般规律2
8
18
32
2n23、原子核外电子排布规律①?电子总是先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐渐升高的电子层里(能量最低原理)先排K层,排满K层后再排L层,排满L层后再排M层,依此类推②每个电子层最多只能容纳2n2个电子③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个
倒数第三层最多只能容纳32个电子4、原子结构与元素性质的关系(结构决定性质)(1)稳定结构:最外电子层上为8(只有一个电子层时为2)个电子(如He、Ne、Ar等)(2)不稳定结构:原子容易失去电子转化或容易得到电子转化最外电子层上为8(只有一个电子层时为2)个电子的稳定结构(如,失去:Na、Mg、Al 得到:F、O、Cl)(3) 元素原子的最外层电子
数目和元素性质的关系 最外层
电子数得失电子元素性质金属性
非金属性
稳定性易失
易得
稳定金属元素
非金属元素
稀有气体元素一般<4
一般≥4
8或2(He)类型项目1. 下列微粒结构示意图表示的各是什么微粒?
2. 下列微粒结构示意图是否正确?如有错误,指出错误的原因。
课堂练习1课堂练习2根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;_____
(3)C元素的次外层电子数是最外层电子数的1/4;________
硫硼氖课堂练习3A元素原子M层上有6个电子,B元素原子的核外电子总数比A元素原子的少5个,
(1)画出A元素的原子结构示意图;
(2)A、B两元素形成化合物的化学式。Na2S补充练习11.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为:
A.6 B.8 C.12 D.16
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中。满足上述关系的元素共有:
A.1对 B.2对 C.3对 D.4对
3.A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为:
A. A2B3 B. BA2 C. AB4 D.B3A2ACB D 宏观、微观运动的不同原子核外电子运动的特征⑴ 运动微粒(电子)的质量很小⑵ 运动速度极高⑶ 运动范围极小无法描述电子运动的轨迹2200km/s (约为光速的1%)9.11×10-31 kg ,只有质子质量的1/1836n×10-10 m不能测定或计算它在某一时刻所在的位置汽车 0.03炮弹 2.00人造卫星 7.8宇宙飞船 11.2
决定了原子的种类.核电荷数质子数和中子数思考:电子的运动与宏观物体相比,
有何不同?
核外电子的运动有何特点?
设疑:电子绕核运动有没有什么规律呢?
电子的运动特征:电子质量小;
运动空间小;
运动速度快。能量越高。离核越远;分层排布;一、原子核外电子的分层排布 1、原子结构示意图为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…,n值越大,说明电子离核越远,能量也就越高2、原子核外电子运动区域与电子能量的关系 电子按能量高低在核外分层排布表1-1稀有气体元素原子电子层排布2 8 18 322
8
8
8
8
8讨论
1.根据表1-1和在初中学习的部分元素原子结构示意图的知识,
讨论核电荷数1~18的元素原子核外电子排布的情形以及核外电子
排布的一般规律,并将讨论的结果分别填入表1-2和表1-3中。表1-3? 核外电子分层排布的一般规律2
8
18
32
2n23、原子核外电子排布规律①?电子总是先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐渐升高的电子层里(能量最低原理)先排K层,排满K层后再排L层,排满L层后再排M层,依此类推②每个电子层最多只能容纳2n2个电子③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个
倒数第三层最多只能容纳32个电子4、原子结构与元素性质的关系(结构决定性质)(1)稳定结构:最外电子层上为8(只有一个电子层时为2)个电子(如He、Ne、Ar等)(2)不稳定结构:原子容易失去电子转化或容易得到电子转化最外电子层上为8(只有一个电子层时为2)个电子的稳定结构(如,失去:Na、Mg、Al 得到:F、O、Cl)(3) 元素原子的最外层电子
数目和元素性质的关系 最外层
电子数得失电子元素性质金属性
非金属性
稳定性易失
易得
稳定金属元素
非金属元素
稀有气体元素一般<4
一般≥4
8或2(He)类型项目1. 下列微粒结构示意图表示的各是什么微粒?
2. 下列微粒结构示意图是否正确?如有错误,指出错误的原因。
课堂练习1课堂练习2根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;_____
(3)C元素的次外层电子数是最外层电子数的1/4;________
硫硼氖课堂练习3A元素原子M层上有6个电子,B元素原子的核外电子总数比A元素原子的少5个,
(1)画出A元素的原子结构示意图;
(2)A、B两元素形成化合物的化学式。Na2S补充练习11.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为:
A.6 B.8 C.12 D.16
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中。满足上述关系的元素共有:
A.1对 B.2对 C.3对 D.4对
3.A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为:
A. A2B3 B. BA2 C. AB4 D.B3A2ACB D 宏观、微观运动的不同原子核外电子运动的特征⑴ 运动微粒(电子)的质量很小⑵ 运动速度极高⑶ 运动范围极小无法描述电子运动的轨迹2200km/s (约为光速的1%)9.11×10-31 kg ,只有质子质量的1/1836n×10-10 m不能测定或计算它在某一时刻所在的位置汽车 0.03炮弹 2.00人造卫星 7.8宇宙飞船 11.2
