第5章初识酸和碱检测题--2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
文档属性
| 名称 | 第5章初识酸和碱检测题--2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 184.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-15 08:54:47 | ||
图片预览


文档简介
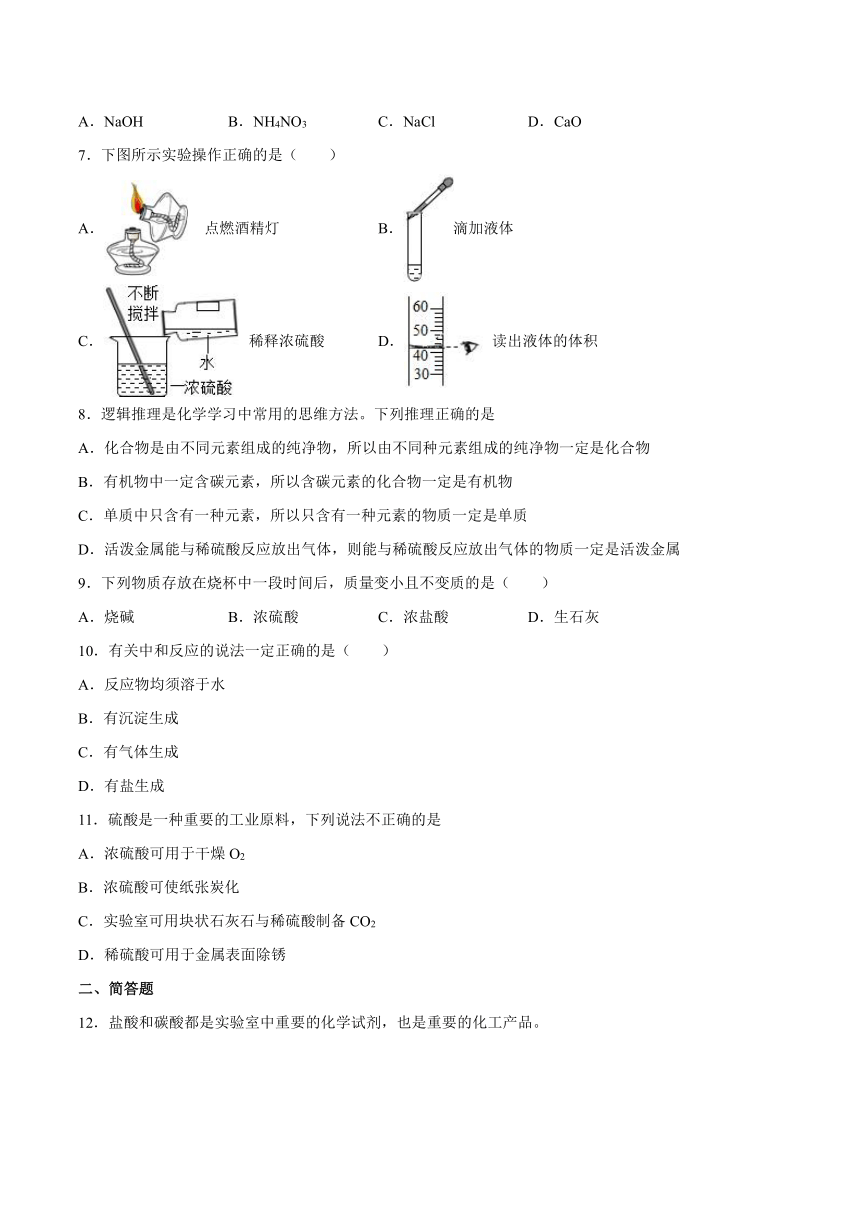
第5章《初识酸和碱》检测题
一、单选题
1.下列有关氢氧化钠性质的说法错误的是( )
A.氢氧化钠有腐蚀性 B.固体氢氧化钠有挥发性
C.氢氧化钠能吸收二氧化碳而变质 D.固体氢氧化钠能吸收水蒸气而潮解
2.下列实验方案设计中,不能达到实验目的的是
A.鉴别碳粉、铁粉、氧化铜三种黑色固体:加入稀硫酸,观察现象
B.鉴别NaOH、CuSO4、NaCl三种固体:加水,观察现象
C.除去NaCl溶液中的少量MgCl2:加入过量的Ba(OH)2溶液,过滤
D.除去CaCl2溶液中的少量HCl:加入过量的碳酸钙固体,过滤
3.下列图示实验操作中,正确的是
A.取用液体 B.稀释浓硫酸
C.收集氧气 D.蒸发结晶
4.下列物质的性质与其用途不匹配的是
A.石墨质软——用作电池的电极材料
B.不锈钢耐腐蚀——制造医疗器械
C.熟石灰显碱性——用来改良酸性土壤
D.干冰易升华——用于人工降雨
5.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
6.下列物质溶于水因发生化学反应放出热量的是
A.NaOH B.NH4NO3 C.NaCl D.CaO
7.下图所示实验操作正确的是( )
A. 点燃酒精灯 B.滴加液体
C. 稀释浓硫酸 D. 读出液体的体积
8.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
B.有机物中一定含碳元素,所以含碳元素的化合物一定是有机物
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
9.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
10.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
11.硫酸是一种重要的工业原料,下列说法不正确的是
A.浓硫酸可用于干燥O2
B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备CO2
D.稀硫酸可用于金属表面除锈
二、简答题
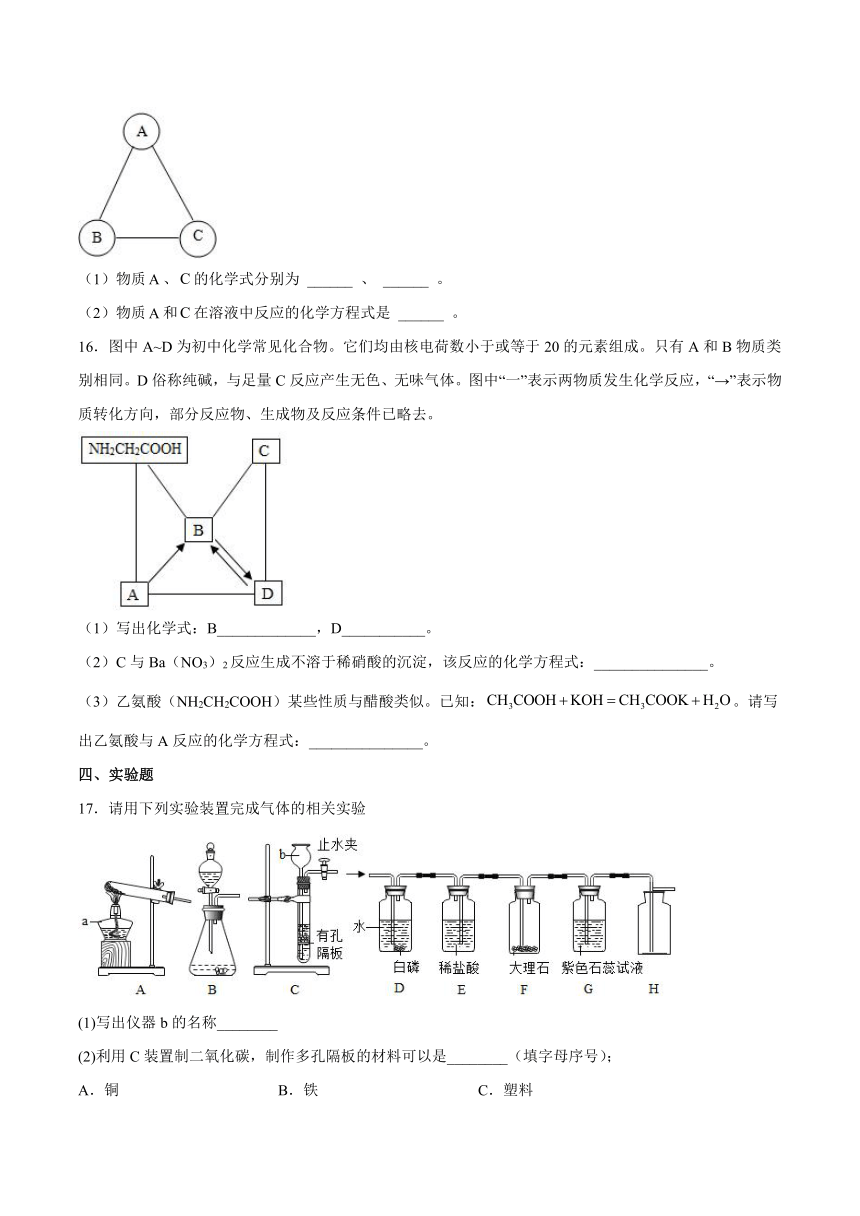
12.盐酸和碳酸都是实验室中重要的化学试剂,也是重要的化工产品。
(1)实验室中打开盛浓盐酸和浓硫酸的试剂瓶,立即就能把它们区分开来,这是为什么?
_______________________
(2)如图所示是某试剂瓶标签上的内容,要把10 g这种浓硫酸稀释为20%的稀硫酸,需要水的质量为 ________ g,稀释浓硫酸时,不可将水倒入浓硫酸中,请解释其原因 _______________________ 。
13.请用微观角度解释下列现象。
(1)春季花开,香飘满园。____________
(2)稀盐酸和稀硫酸具有相似化学性质的原因是什么?____________
三、推断题
14.图中A~J是初中化学常见的物质,且分别由H、C、O、S、Cl、Na、Ca、Cu、Zn中一种或几种元素组成。A、B、E、G均属于单质;C、D、H均由两种元素组成,C中两种元素质量之比为1:4;F、I、J均由三种元素组成,I俗称为纯碱。“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)写出A的名称: _____ ,H的化学式: _____ 。
(2)写出G→B反应的化学方程式: _____ 。
(3)写出F与I反应的化学方程式: _____ 。
15.、、是三种不同类别的含有氧元素的化合物,物质间相互反应的关系如图所示(图中“一”表示相连的两种物质能在溶液中发生反应)。若为碳酸钠, 、间的反应为复分解反应,回答下列问题:
(1)物质、的化学式分别为 ______ 、 ______ 。
(2)物质和在溶液中反应的化学方程式是 ______ 。
16.图中A~D为初中化学常见化合物。它们均由核电荷数小于或等于20的元素组成。只有A和B物质类别相同。D俗称纯碱,与足量C反应产生无色、无味气体。图中“一”表示两物质发生化学反应,“→”表示物质转化方向,部分反应物、生成物及反应条件已略去。
(1)写出化学式:B_____________,D___________。
(2)C与Ba(NO3)2反应生成不溶于稀硝酸的沉淀,该反应的化学方程式:_______________。
(3)乙氨酸(NH2CH2COOH)某些性质与醋酸类似。已知:。请写出乙氨酸与A反应的化学方程式:_______________。
四、实验题
17.请用下列实验装置完成气体的相关实验
(1)写出仪器b的名称________
(2)利用C装置制二氧化碳,制作多孔隔板的材料可以是________(填字母序号);
A.铜 B.铁 C.塑料
(3)用双氧水和二氧化锰混合制氧气的化学方程式_________,为了得到平稳的氧气流,应该选择的发生装置是(填字母序号)_________。
(4)当氧气从D的左边导管通入时,水中的白磷不燃烧,原因是__________,同时可以观察到E中__________,G中导管口有气泡冒出,溶液_______,反应的化学方程式为________
(5)证明H中空气已排尽的方法是_______,下列保护空气的措施合理的是_______
a.使用清洁能源,植树造林、种草
b.在汽车尾气排放系统中安装催化净化装置,使尾气中的氮氧化合物转化成无毒的气体
c.提倡步行、骑自行车等“低碳”出行方式
d..工厂通过加高烟囱直接排放废气
(6)用下图装置X收集氢气,应从______(填“b”或“c” )端通入氢气。
18.实验一:电子天平AB的表面皿中分别盛有浓HCl、浓H2SO4,放置一段时间。
(1)A中的示数变小,原因是____________________________________。
(2)与图C所示变化相一致的是_______________(选填“A”或“B”)
实验二:做对比实验,得出相应结论。
(3)I和II试管中都产生气泡,且I中比II中剧烈。此现象说明物质反应的快慢与_______________有关。
Ⅲ试管中可能的现象是____________________________________。
请用化学方程式解释其原因_________________、___________________。
(4)如图所示,比较金属的活动性大小。实验现象:试管IV比试管V中产生气泡剧烈。得出结论:金属活动性X>Y。我不赞同此结论,理由是____________________________________。完成本实验需要控制的变量是____________________________________。
五、计算题
19.室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到100g硫酸铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含的溶质为(写化学式)_____。
②该反应过程中,观察到的一个明显反应现象是_____。
③当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液的质量(计算结果精确到0.1g)。
20.现有氯化钠和氯化镁混合物12.8g,向其中加入83g水,完全溶解后加入一定质量的氢氧化钠溶液,至恰好完全反应后,过滤,得到5.8g沉淀,所得滤液中溶质的质量分数为10%。计算:
(1)混合物中氯化镁的质量;
(2)氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。
参考答案:
1.B 2.C 3.D 4.A 5.C 6.D 7.D 8.A 9.C 10.D
11.C
12. 浓盐酸具有挥发性,挥发出氯化氢气体,与空气中水蒸气结合形成白雾,所以打开瓶盖后有白雾产生的是浓盐酸,没有现象的是浓硫酸 39 水的密度小于浓硫酸的密度,将水倒入浓硫酸中,水会浮在浓硫酸的表面,且浓硫酸溶于水放出大量的热,使水沸腾,所以会使液体溅出伤人
13. 分子是在不断运动的 稀盐酸和稀硫酸中都含有氢离子
14. 氧气 HCl H2+CuOCu+H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
15. (或) [或] [或或或]
16. NaOH Na2CO3
17.(1)长颈漏斗
(2)AC
(3) B
(4) 温度没有达到白磷的着火点 稀盐酸被压入F中 变红
(5) 在集气瓶口放燃烧的木条,木条熄灭则空气排尽 abc
(6)b
18. 浓盐酸具有挥发性 A B 酸的浓度(或溶质质量分数) 铁锈消失,溶液变黄色,产生气泡 Fe2O3+ 6HCl =2FeCl3+ 3H2O Fe + 2HCl= FeCl2+ H2↑ 酸的浓度不同 金属的大小、盐酸的质量、盐酸的浓度
19.(1)CuSO4、Na2SO4;(2)生成蓝色沉淀;(3)170.2g
20.解:设混合物中氯化镁的质量为x,氢氧化钠溶质质量为z,生成氯化钠质量为y
混合物中氯化钠的质量为12.8g-9.5g=3.3g;
反应后所得氯化钠溶液质量为=150g
所加氢氧化钠溶液的质量为:150g+5.8g-83g-12.8g=60g
氢氧化钠溶液中溶质质量分数×100%≈13.3%;
答:(1)混合物中氯化镁的质量为9.5g;
(2)氢氧化钠溶液中溶质质量分数为13.3%。
一、单选题
1.下列有关氢氧化钠性质的说法错误的是( )
A.氢氧化钠有腐蚀性 B.固体氢氧化钠有挥发性
C.氢氧化钠能吸收二氧化碳而变质 D.固体氢氧化钠能吸收水蒸气而潮解
2.下列实验方案设计中,不能达到实验目的的是
A.鉴别碳粉、铁粉、氧化铜三种黑色固体:加入稀硫酸,观察现象
B.鉴别NaOH、CuSO4、NaCl三种固体:加水,观察现象
C.除去NaCl溶液中的少量MgCl2:加入过量的Ba(OH)2溶液,过滤
D.除去CaCl2溶液中的少量HCl:加入过量的碳酸钙固体,过滤
3.下列图示实验操作中,正确的是
A.取用液体 B.稀释浓硫酸
C.收集氧气 D.蒸发结晶
4.下列物质的性质与其用途不匹配的是
A.石墨质软——用作电池的电极材料
B.不锈钢耐腐蚀——制造医疗器械
C.熟石灰显碱性——用来改良酸性土壤
D.干冰易升华——用于人工降雨
5.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
6.下列物质溶于水因发生化学反应放出热量的是
A.NaOH B.NH4NO3 C.NaCl D.CaO
7.下图所示实验操作正确的是( )
A. 点燃酒精灯 B.滴加液体
C. 稀释浓硫酸 D. 读出液体的体积
8.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
B.有机物中一定含碳元素,所以含碳元素的化合物一定是有机物
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
9.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
10.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
11.硫酸是一种重要的工业原料,下列说法不正确的是
A.浓硫酸可用于干燥O2
B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备CO2
D.稀硫酸可用于金属表面除锈
二、简答题
12.盐酸和碳酸都是实验室中重要的化学试剂,也是重要的化工产品。
(1)实验室中打开盛浓盐酸和浓硫酸的试剂瓶,立即就能把它们区分开来,这是为什么?
_______________________
(2)如图所示是某试剂瓶标签上的内容,要把10 g这种浓硫酸稀释为20%的稀硫酸,需要水的质量为 ________ g,稀释浓硫酸时,不可将水倒入浓硫酸中,请解释其原因 _______________________ 。
13.请用微观角度解释下列现象。
(1)春季花开,香飘满园。____________
(2)稀盐酸和稀硫酸具有相似化学性质的原因是什么?____________
三、推断题
14.图中A~J是初中化学常见的物质,且分别由H、C、O、S、Cl、Na、Ca、Cu、Zn中一种或几种元素组成。A、B、E、G均属于单质;C、D、H均由两种元素组成,C中两种元素质量之比为1:4;F、I、J均由三种元素组成,I俗称为纯碱。“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)写出A的名称: _____ ,H的化学式: _____ 。
(2)写出G→B反应的化学方程式: _____ 。
(3)写出F与I反应的化学方程式: _____ 。
15.、、是三种不同类别的含有氧元素的化合物,物质间相互反应的关系如图所示(图中“一”表示相连的两种物质能在溶液中发生反应)。若为碳酸钠, 、间的反应为复分解反应,回答下列问题:
(1)物质、的化学式分别为 ______ 、 ______ 。
(2)物质和在溶液中反应的化学方程式是 ______ 。
16.图中A~D为初中化学常见化合物。它们均由核电荷数小于或等于20的元素组成。只有A和B物质类别相同。D俗称纯碱,与足量C反应产生无色、无味气体。图中“一”表示两物质发生化学反应,“→”表示物质转化方向,部分反应物、生成物及反应条件已略去。
(1)写出化学式:B_____________,D___________。
(2)C与Ba(NO3)2反应生成不溶于稀硝酸的沉淀,该反应的化学方程式:_______________。
(3)乙氨酸(NH2CH2COOH)某些性质与醋酸类似。已知:。请写出乙氨酸与A反应的化学方程式:_______________。
四、实验题
17.请用下列实验装置完成气体的相关实验
(1)写出仪器b的名称________
(2)利用C装置制二氧化碳,制作多孔隔板的材料可以是________(填字母序号);
A.铜 B.铁 C.塑料
(3)用双氧水和二氧化锰混合制氧气的化学方程式_________,为了得到平稳的氧气流,应该选择的发生装置是(填字母序号)_________。
(4)当氧气从D的左边导管通入时,水中的白磷不燃烧,原因是__________,同时可以观察到E中__________,G中导管口有气泡冒出,溶液_______,反应的化学方程式为________
(5)证明H中空气已排尽的方法是_______,下列保护空气的措施合理的是_______
a.使用清洁能源,植树造林、种草
b.在汽车尾气排放系统中安装催化净化装置,使尾气中的氮氧化合物转化成无毒的气体
c.提倡步行、骑自行车等“低碳”出行方式
d..工厂通过加高烟囱直接排放废气
(6)用下图装置X收集氢气,应从______(填“b”或“c” )端通入氢气。
18.实验一:电子天平AB的表面皿中分别盛有浓HCl、浓H2SO4,放置一段时间。
(1)A中的示数变小,原因是____________________________________。
(2)与图C所示变化相一致的是_______________(选填“A”或“B”)
实验二:做对比实验,得出相应结论。
(3)I和II试管中都产生气泡,且I中比II中剧烈。此现象说明物质反应的快慢与_______________有关。
Ⅲ试管中可能的现象是____________________________________。
请用化学方程式解释其原因_________________、___________________。
(4)如图所示,比较金属的活动性大小。实验现象:试管IV比试管V中产生气泡剧烈。得出结论:金属活动性X>Y。我不赞同此结论,理由是____________________________________。完成本实验需要控制的变量是____________________________________。
五、计算题
19.室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到100g硫酸铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含的溶质为(写化学式)_____。
②该反应过程中,观察到的一个明显反应现象是_____。
③当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液的质量(计算结果精确到0.1g)。
20.现有氯化钠和氯化镁混合物12.8g,向其中加入83g水,完全溶解后加入一定质量的氢氧化钠溶液,至恰好完全反应后,过滤,得到5.8g沉淀,所得滤液中溶质的质量分数为10%。计算:
(1)混合物中氯化镁的质量;
(2)氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。
参考答案:
1.B 2.C 3.D 4.A 5.C 6.D 7.D 8.A 9.C 10.D
11.C
12. 浓盐酸具有挥发性,挥发出氯化氢气体,与空气中水蒸气结合形成白雾,所以打开瓶盖后有白雾产生的是浓盐酸,没有现象的是浓硫酸 39 水的密度小于浓硫酸的密度,将水倒入浓硫酸中,水会浮在浓硫酸的表面,且浓硫酸溶于水放出大量的热,使水沸腾,所以会使液体溅出伤人
13. 分子是在不断运动的 稀盐酸和稀硫酸中都含有氢离子
14. 氧气 HCl H2+CuOCu+H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
15. (或) [或] [或或或]
16. NaOH Na2CO3
17.(1)长颈漏斗
(2)AC
(3) B
(4) 温度没有达到白磷的着火点 稀盐酸被压入F中 变红
(5) 在集气瓶口放燃烧的木条,木条熄灭则空气排尽 abc
(6)b
18. 浓盐酸具有挥发性 A B 酸的浓度(或溶质质量分数) 铁锈消失,溶液变黄色,产生气泡 Fe2O3+ 6HCl =2FeCl3+ 3H2O Fe + 2HCl= FeCl2+ H2↑ 酸的浓度不同 金属的大小、盐酸的质量、盐酸的浓度
19.(1)CuSO4、Na2SO4;(2)生成蓝色沉淀;(3)170.2g
20.解:设混合物中氯化镁的质量为x,氢氧化钠溶质质量为z,生成氯化钠质量为y
混合物中氯化钠的质量为12.8g-9.5g=3.3g;
反应后所得氯化钠溶液质量为=150g
所加氢氧化钠溶液的质量为:150g+5.8g-83g-12.8g=60g
氢氧化钠溶液中溶质质量分数×100%≈13.3%;
答:(1)混合物中氯化镁的质量为9.5g;
(2)氢氧化钠溶液中溶质质量分数为13.3%。
