第6章常用的金属和盐检测题-2021-2022学年九年级化学沪教版(上海)第二学期 (word版 含答案)
文档属性
| 名称 | 第6章常用的金属和盐检测题-2021-2022学年九年级化学沪教版(上海)第二学期 (word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 128.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-15 08:58:04 | ||
图片预览


文档简介
第6章《常用的金属和盐》检测题
一、单选题
1.在下列各组物质中,每组的3种物质两两之间都能发生化学反应的是
①Cu、稀硫酸、CuO ②稀盐酸、Ca(OH)2溶液、Na2CO3溶液 ③C、CO、Fe2O3
A.①② B.①③ C.② D.①②③
2.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
3.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
4.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
5.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
6.下列各组物质用稀硫酸不能区分开的是( )
A.镁粉、氧化铜粉 B.NaOH溶液、KOH溶液
C.铁片、铜片 D.Na2CO3溶液、NaCl溶液
7.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
8.下列物质中,属于钾肥的是
A.NH4H2PO4 B.CO(NH2)2 C.Ca2 (PO4) 3 D.K2SO4
9.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
10.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
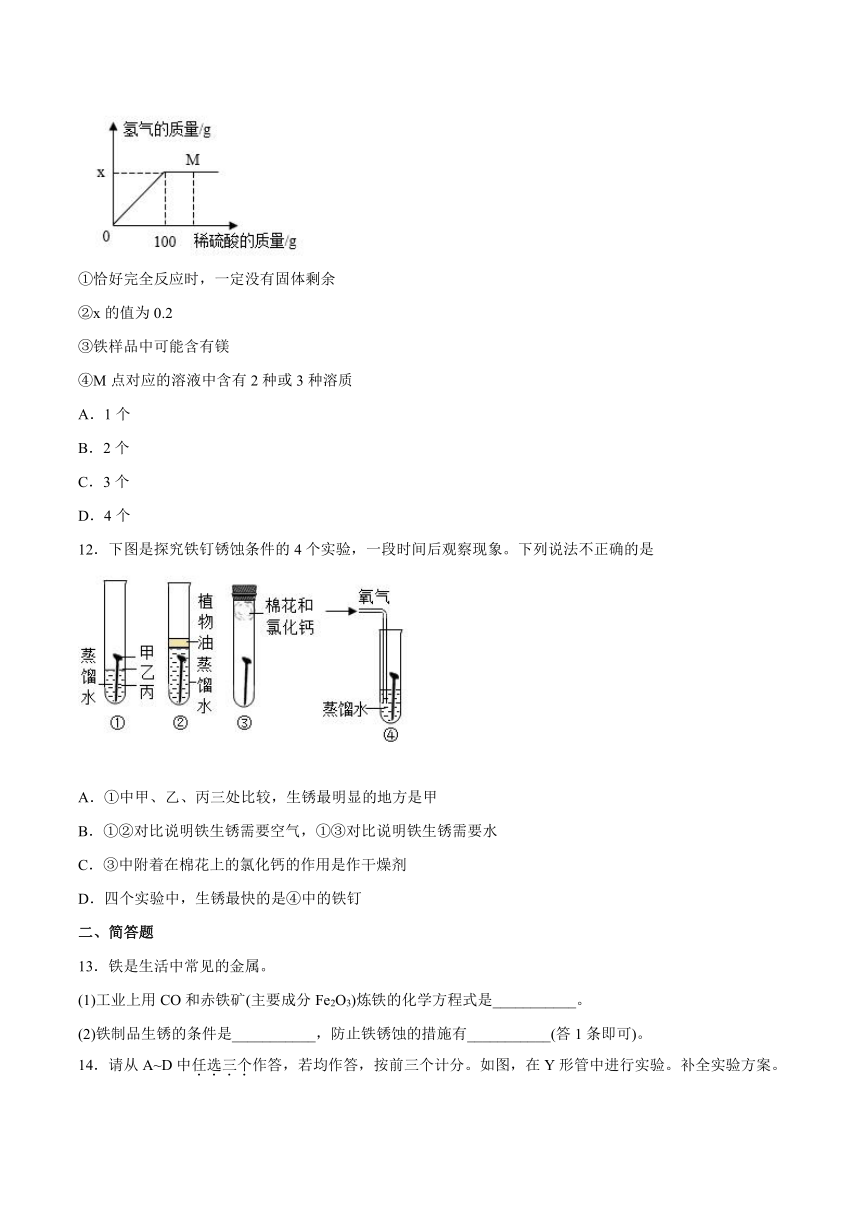
11.现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。则下列结论正确的个数是
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
A.1个
B.2个
C.3个
D.4个
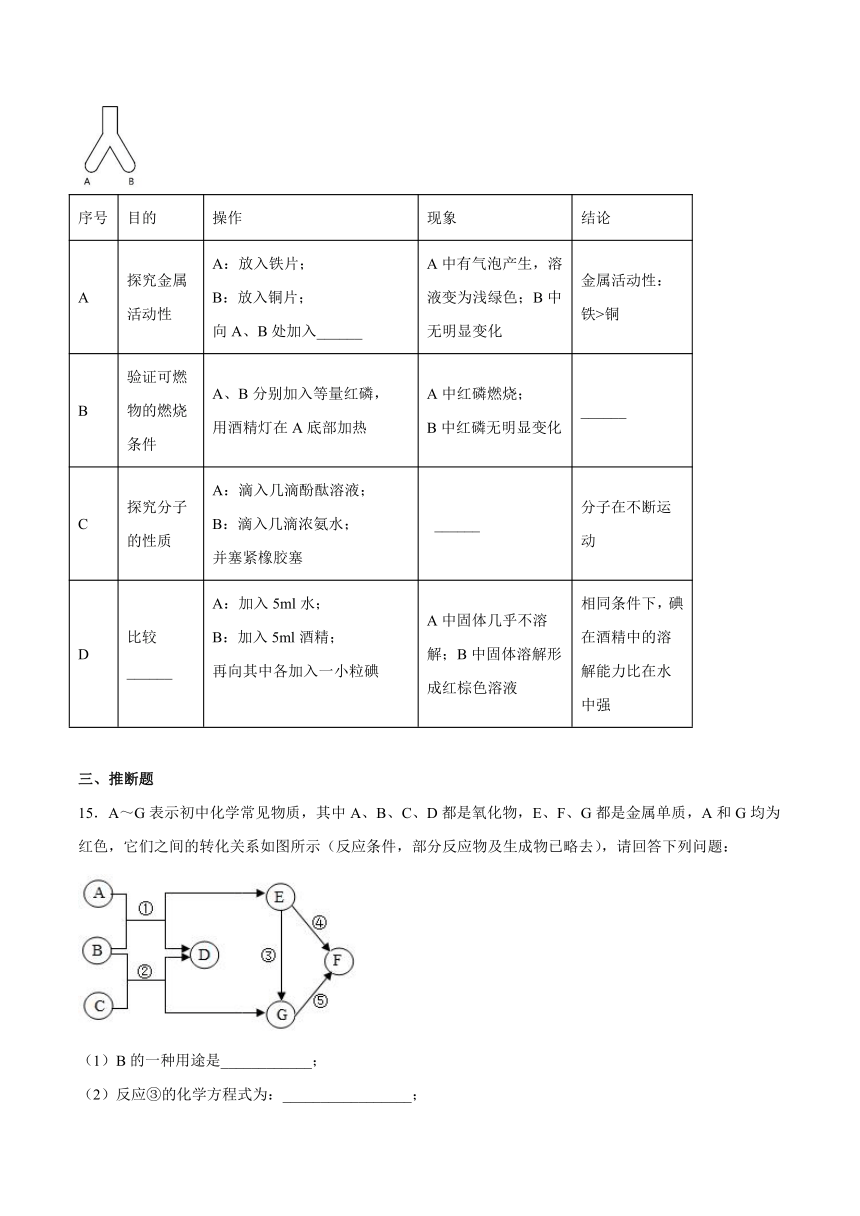
12.下图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
二、简答题
13.铁是生活中常见的金属。
(1)工业上用CO和赤铁矿(主要成分Fe2O3)炼铁的化学方程式是___________。
(2)铁制品生锈的条件是___________,防止铁锈蚀的措施有___________(答1条即可)。
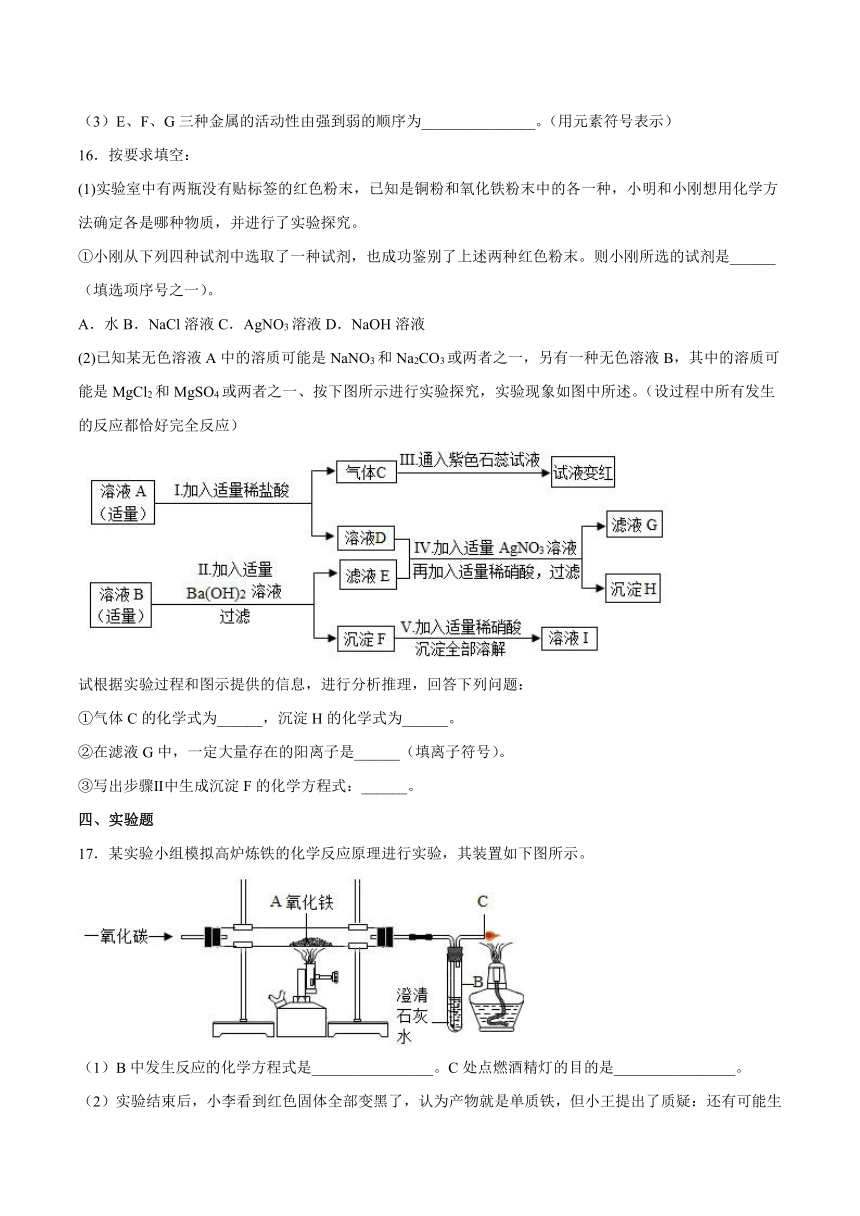
14.请从A~D中任选三个作答,若均作答,按前三个计分。如图,在Y形管中进行实验。补全实验方案。
序号 目的 操作 现象 结论
A 探究金属活动性 A:放入铁片; B:放入铜片; 向A、B处加入______ A中有气泡产生,溶液变为浅绿色;B中无明显变化 金属活动性:铁>铜
B 验证可燃物的燃烧条件 A、B分别加入等量红磷, 用酒精灯在A底部加热 A中红磷燃烧; B中红磷无明显变化 ______
C 探究分子的性质 A:滴入几滴酚酞溶液; B:滴入几滴浓氨水; 并塞紧橡胶塞 ______ 分子在不断运动
D 比较______ A:加入5ml水; B:加入5ml酒精; 再向其中各加入一小粒碘 A中固体几乎不溶解;B中固体溶解形成红棕色溶液 相同条件下,碘在酒精中的溶解能力比在水中强
三、推断题
15.A~G表示初中化学常见物质,其中A、B、C、D都是氧化物,E、F、G都是金属单质,A和G均为红色,它们之间的转化关系如图所示(反应条件,部分反应物及生成物已略去),请回答下列问题:
(1)B的一种用途是____________;
(2)反应③的化学方程式为:_________________;
(3)E、F、G三种金属的活动性由强到弱的顺序为_______________。(用元素符号表示)
16.按要求填空:
(1)实验室中有两瓶没有贴标签的红色粉末,已知是铜粉和氧化铁粉末中的各一种,小明和小刚想用化学方法确定各是哪种物质,并进行了实验探究。
①小刚从下列四种试剂中选取了一种试剂,也成功鉴别了上述两种红色粉末。则小刚所选的试剂是______(填选项序号之一)。
A.水B.NaCl溶液C.AgNO3溶液D.NaOH溶液
(2)已知某无色溶液A中的溶质可能是NaNO3和Na2CO3或两者之一,另有一种无色溶液B,其中的溶质可能是MgCl2和MgSO4或两者之一、按下图所示进行实验探究,实验现象如图中所述。(设过程中所有发生的反应都恰好完全反应)
试根据实验过程和图示提供的信息,进行分析推理,回答下列问题:
①气体C的化学式为______,沉淀H的化学式为______。
②在滤液G中,一定大量存在的阳离子是______(填离子符号)。
③写出步骤Ⅱ中生成沉淀F的化学方程式:______。
四、实验题
17.某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示。
(1)B中发生反应的化学方程式是________________。C处点燃酒精灯的目的是________________。
(2)实验结束后,小李看到红色固体全部变黑了,认为产物就是单质铁,但小王提出了质疑:还有可能生成其它物质。为了进一步验证其固体成分,小王查到下列资料:
铁的氧化物有氧化铁、氧化亚铁、四氧化三铁(该化合物中铁有+2、+3两种化合价),其中氧化铁为红棕色,其余都为黑色;并且只有四氧化三铁能被磁铁吸引。②铁的氧化物都能与酸发生反应而溶解。
根据上述信息,小王又设计了两个实验。
①将黑色固体研磨后,取少量加入________________溶液中,观察到有气泡出现,溶液未变黄色,据此得出的结论是________________。
②再用磁铁吸引余下黑色固体,实验后即可对黑色固体成分进行判断________________。
18.氧气支持生命活动,也是一种重要的化工原料。
(1)实验室用如图所示的装置制取少量氧气。
①仪器a、仪器b的名称分别是______、______。
②锥形瓶内发生反应的化学方程式是______。
(2)工业上有多种制取氧气的方法,如:
方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温、加压条件下,使之转化为液态,储存于钢瓶里。
①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是______。
②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守恒角度分析,该鱼腥气味的气体是______(填化学式或名称)。
(3)氢气和氧气在Pd基催化剂表面可反应生成H2O2,其微观示意图如下:
“解离”时,结构被破坏的分子是______(填化学式)。
(4)为探究双氧水的分解,进行以下两个实验:
①氯化物对双氧水分解的影响。
反应条件:6.0mL30%双氧水,0.1g氯化物,室温;实验时间:1.5h。
实验数据如下表所示:
氯化物 NaCl MgCl2 CuCl2
放出氧气的体积/mL 2.0 4.0 420.0
双氧水的分解率/% 0.30 0.60 63.18
由上表可知,双氧水保存时应绝对避免引入的离子是______(写离子符号)。
②pH对双氧水分解的影响。
反应条件:6.0mL30%双氧水,60℃;用NaOH溶液调pH;实验时间:1.5h。实验结果如图所示:
由如图可知,pH为______(填数字)时,双氧水的分解率最高。
(5)用双氧水可制得“鱼浮灵”、“钙多宝”。
①“鱼浮灵”主要成分是2Na2CO3·3H2O2,可迅速增加水体含氧量,其原因是______。
②“钙多宝”主要成分是CaO2,常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是______(填化学式)、Ca(OH)2。
五、计算题
19.某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
(l)反应至A点时加入氢氧化钠溶液的质量为__________;
(2)反应至B点时锥形瓶内所得溶液的溶质质量分数为_____(计算结果保留至0.1%)
20.早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。现有含1、6kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数。
(2)理论上与硫酸铜反应消耗铁粉的质量。
参考答案:
1.C 2.B 3.D 4.D 5.C 6.B 7.A 8.D 9.D 10.C 11.A 12.A
13. 3CO + Fe2O32Fe + 3CO2 与潮湿的空气接触 刷漆
14. 稀盐酸(或稀硫酸) 可燃物燃烧需要温度达到着火点 B中溶液变红 比较同种溶质在不同种溶剂中的溶解能力
15. 冶炼金属 Fe+CuSO4=FeSO4+Cu 铁>铜>银
16.(1) C
(2) CO2 AgCl H+、Na+、Ba2+
17. CO2+Ca(OH)2= CaCO3↓ + H2O 防止CO污染环境 稀硫酸(或稀盐酸) 有单质铁,无Fe3O4 如果黑色固体被磁铁全部吸引,说明只有单质铁,如果被部分吸引,说明黑色固体为Fe和Fe3O4
18. 铁架台 集气瓶 分子之间的间隔 臭氧(或O3) H2 Cu2+ 9 “鱼浮灵”溶于水生成碳酸钠和过氧化氢,碳酸钠溶液显碱性,能促进过氧化氢分解生成氧气 CaCO3
19.(1)40g(2)10.4%
20.40% 0.56kg
一、单选题
1.在下列各组物质中,每组的3种物质两两之间都能发生化学反应的是
①Cu、稀硫酸、CuO ②稀盐酸、Ca(OH)2溶液、Na2CO3溶液 ③C、CO、Fe2O3
A.①② B.①③ C.② D.①②③
2.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
3.下列应用、对应的化学方程式及基本反应类型都正确的是
A.用一氧化碳还原氧化铁: 置换反应
B.用氢氧化钠溶液吸收二氧化碳: 复分解反应
C.用铁桶盛装农药波尔多液: 置换反应
D.用生石灰制熟石灰: 化合反应
4.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
5.下列有关金属材料的说法错误的是
A.在潮湿的空气中铁易生锈
B.金属的回收利用是保护金属资源的有效途径之一
C.铝和金都有很好的抗腐蚀性,是因为二者的化学性质都很稳定
D.高炉炼铁的原理是在高温条件下,用一氧化碳把铁从铁矿石里还原出来
6.下列各组物质用稀硫酸不能区分开的是( )
A.镁粉、氧化铜粉 B.NaOH溶液、KOH溶液
C.铁片、铜片 D.Na2CO3溶液、NaCl溶液
7.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
8.下列物质中,属于钾肥的是
A.NH4H2PO4 B.CO(NH2)2 C.Ca2 (PO4) 3 D.K2SO4
9.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
10.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
11.现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。则下列结论正确的个数是
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
A.1个
B.2个
C.3个
D.4个
12.下图是探究铁钉锈蚀条件的4个实验,一段时间后观察现象。下列说法不正确的是
A.①中甲、乙、丙三处比较,生锈最明显的地方是甲
B.①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C.③中附着在棉花上的氯化钙的作用是作干燥剂
D.四个实验中,生锈最快的是④中的铁钉
二、简答题
13.铁是生活中常见的金属。
(1)工业上用CO和赤铁矿(主要成分Fe2O3)炼铁的化学方程式是___________。
(2)铁制品生锈的条件是___________,防止铁锈蚀的措施有___________(答1条即可)。
14.请从A~D中任选三个作答,若均作答,按前三个计分。如图,在Y形管中进行实验。补全实验方案。
序号 目的 操作 现象 结论
A 探究金属活动性 A:放入铁片; B:放入铜片; 向A、B处加入______ A中有气泡产生,溶液变为浅绿色;B中无明显变化 金属活动性:铁>铜
B 验证可燃物的燃烧条件 A、B分别加入等量红磷, 用酒精灯在A底部加热 A中红磷燃烧; B中红磷无明显变化 ______
C 探究分子的性质 A:滴入几滴酚酞溶液; B:滴入几滴浓氨水; 并塞紧橡胶塞 ______ 分子在不断运动
D 比较______ A:加入5ml水; B:加入5ml酒精; 再向其中各加入一小粒碘 A中固体几乎不溶解;B中固体溶解形成红棕色溶液 相同条件下,碘在酒精中的溶解能力比在水中强
三、推断题
15.A~G表示初中化学常见物质,其中A、B、C、D都是氧化物,E、F、G都是金属单质,A和G均为红色,它们之间的转化关系如图所示(反应条件,部分反应物及生成物已略去),请回答下列问题:
(1)B的一种用途是____________;
(2)反应③的化学方程式为:_________________;
(3)E、F、G三种金属的活动性由强到弱的顺序为_______________。(用元素符号表示)
16.按要求填空:
(1)实验室中有两瓶没有贴标签的红色粉末,已知是铜粉和氧化铁粉末中的各一种,小明和小刚想用化学方法确定各是哪种物质,并进行了实验探究。
①小刚从下列四种试剂中选取了一种试剂,也成功鉴别了上述两种红色粉末。则小刚所选的试剂是______(填选项序号之一)。
A.水B.NaCl溶液C.AgNO3溶液D.NaOH溶液
(2)已知某无色溶液A中的溶质可能是NaNO3和Na2CO3或两者之一,另有一种无色溶液B,其中的溶质可能是MgCl2和MgSO4或两者之一、按下图所示进行实验探究,实验现象如图中所述。(设过程中所有发生的反应都恰好完全反应)
试根据实验过程和图示提供的信息,进行分析推理,回答下列问题:
①气体C的化学式为______,沉淀H的化学式为______。
②在滤液G中,一定大量存在的阳离子是______(填离子符号)。
③写出步骤Ⅱ中生成沉淀F的化学方程式:______。
四、实验题
17.某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示。
(1)B中发生反应的化学方程式是________________。C处点燃酒精灯的目的是________________。
(2)实验结束后,小李看到红色固体全部变黑了,认为产物就是单质铁,但小王提出了质疑:还有可能生成其它物质。为了进一步验证其固体成分,小王查到下列资料:
铁的氧化物有氧化铁、氧化亚铁、四氧化三铁(该化合物中铁有+2、+3两种化合价),其中氧化铁为红棕色,其余都为黑色;并且只有四氧化三铁能被磁铁吸引。②铁的氧化物都能与酸发生反应而溶解。
根据上述信息,小王又设计了两个实验。
①将黑色固体研磨后,取少量加入________________溶液中,观察到有气泡出现,溶液未变黄色,据此得出的结论是________________。
②再用磁铁吸引余下黑色固体,实验后即可对黑色固体成分进行判断________________。
18.氧气支持生命活动,也是一种重要的化工原料。
(1)实验室用如图所示的装置制取少量氧气。
①仪器a、仪器b的名称分别是______、______。
②锥形瓶内发生反应的化学方程式是______。
(2)工业上有多种制取氧气的方法,如:
方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温、加压条件下,使之转化为液态,储存于钢瓶里。
①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是______。
②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守恒角度分析,该鱼腥气味的气体是______(填化学式或名称)。
(3)氢气和氧气在Pd基催化剂表面可反应生成H2O2,其微观示意图如下:
“解离”时,结构被破坏的分子是______(填化学式)。
(4)为探究双氧水的分解,进行以下两个实验:
①氯化物对双氧水分解的影响。
反应条件:6.0mL30%双氧水,0.1g氯化物,室温;实验时间:1.5h。
实验数据如下表所示:
氯化物 NaCl MgCl2 CuCl2
放出氧气的体积/mL 2.0 4.0 420.0
双氧水的分解率/% 0.30 0.60 63.18
由上表可知,双氧水保存时应绝对避免引入的离子是______(写离子符号)。
②pH对双氧水分解的影响。
反应条件:6.0mL30%双氧水,60℃;用NaOH溶液调pH;实验时间:1.5h。实验结果如图所示:
由如图可知,pH为______(填数字)时,双氧水的分解率最高。
(5)用双氧水可制得“鱼浮灵”、“钙多宝”。
①“鱼浮灵”主要成分是2Na2CO3·3H2O2,可迅速增加水体含氧量,其原因是______。
②“钙多宝”主要成分是CaO2,常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是______(填化学式)、Ca(OH)2。
五、计算题
19.某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
(l)反应至A点时加入氢氧化钠溶液的质量为__________;
(2)反应至B点时锥形瓶内所得溶液的溶质质量分数为_____(计算结果保留至0.1%)
20.早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。现有含1、6kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数。
(2)理论上与硫酸铜反应消耗铁粉的质量。
参考答案:
1.C 2.B 3.D 4.D 5.C 6.B 7.A 8.D 9.D 10.C 11.A 12.A
13. 3CO + Fe2O32Fe + 3CO2 与潮湿的空气接触 刷漆
14. 稀盐酸(或稀硫酸) 可燃物燃烧需要温度达到着火点 B中溶液变红 比较同种溶质在不同种溶剂中的溶解能力
15. 冶炼金属 Fe+CuSO4=FeSO4+Cu 铁>铜>银
16.(1) C
(2) CO2 AgCl H+、Na+、Ba2+
17. CO2+Ca(OH)2= CaCO3↓ + H2O 防止CO污染环境 稀硫酸(或稀盐酸) 有单质铁,无Fe3O4 如果黑色固体被磁铁全部吸引,说明只有单质铁,如果被部分吸引,说明黑色固体为Fe和Fe3O4
18. 铁架台 集气瓶 分子之间的间隔 臭氧(或O3) H2 Cu2+ 9 “鱼浮灵”溶于水生成碳酸钠和过氧化氢,碳酸钠溶液显碱性,能促进过氧化氢分解生成氧气 CaCO3
19.(1)40g(2)10.4%
20.40% 0.56kg
