第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册(word版 含答案)
文档属性
| 名称 | 第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 132.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-15 09:03:36 | ||
图片预览



文档简介
第八单元《海水中的化学》测试题
一、单选题
1.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
2.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
3.已知某物质在20℃ 和40℃ 时的溶解度分别为10g和40g。某温下,将5g该物质加到20g水中,下列有关叙述正确的是
A.20℃ 时,所得溶液的质量为25g
B.40℃ 时,所得溶液为饱和溶液
C.不管什么温度下,所得溶液的溶质质量分数均为20%
D.该物质的溶解度随温度的升高而增大
4.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
5.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
6.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
7.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
8.分离、除杂和检验是化学实验的重要环节,下列说法不正确的是
A.分离CO2和CO,先用NaOH溶液吸收CO2,再向该溶液中加足量稀盐酸
B.只用一种试剂无法把稀盐酸、氯化钡溶液和硝酸钾三种溶液区别开
C.除去氯化钙溶液中混有的少量稀盐酸,可加入过量碳酸钙,充分反应后过滤
D.只用组内溶液相互混合方法,能将KOH、Na2SO4、CuSO4、MgCl2鉴别开
9.下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
10.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
11.下列有关资源的说法正确的是( )
A.空气是一种宝贵的资源,各种成分作为原料广泛用于化工、炼钢、石油加工等领域
B.海洋是巨大的资源宝库,含有80多种化学物质
C.空气成分中稀有气体的体积分数为0.96%
D.海水可以淡化,且淡化成本不高,目前已经开始广泛应用
12.粗盐中难溶性杂质的去除过程中,涉及到称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
二、简答题
13.溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是_____ (填字母)。
A.只有固体 B.只有液体
C.只有气体 D.气体、液体、固体都可以
(2)生活中常用75%的酒精消毒,配制75%的酒精溶液不需要用到的仪器有_____ (填序号)。
①天平 ②胶头滴管 ③漏斗 ④量筒 ⑤烧杯 ⑥玻璃棒
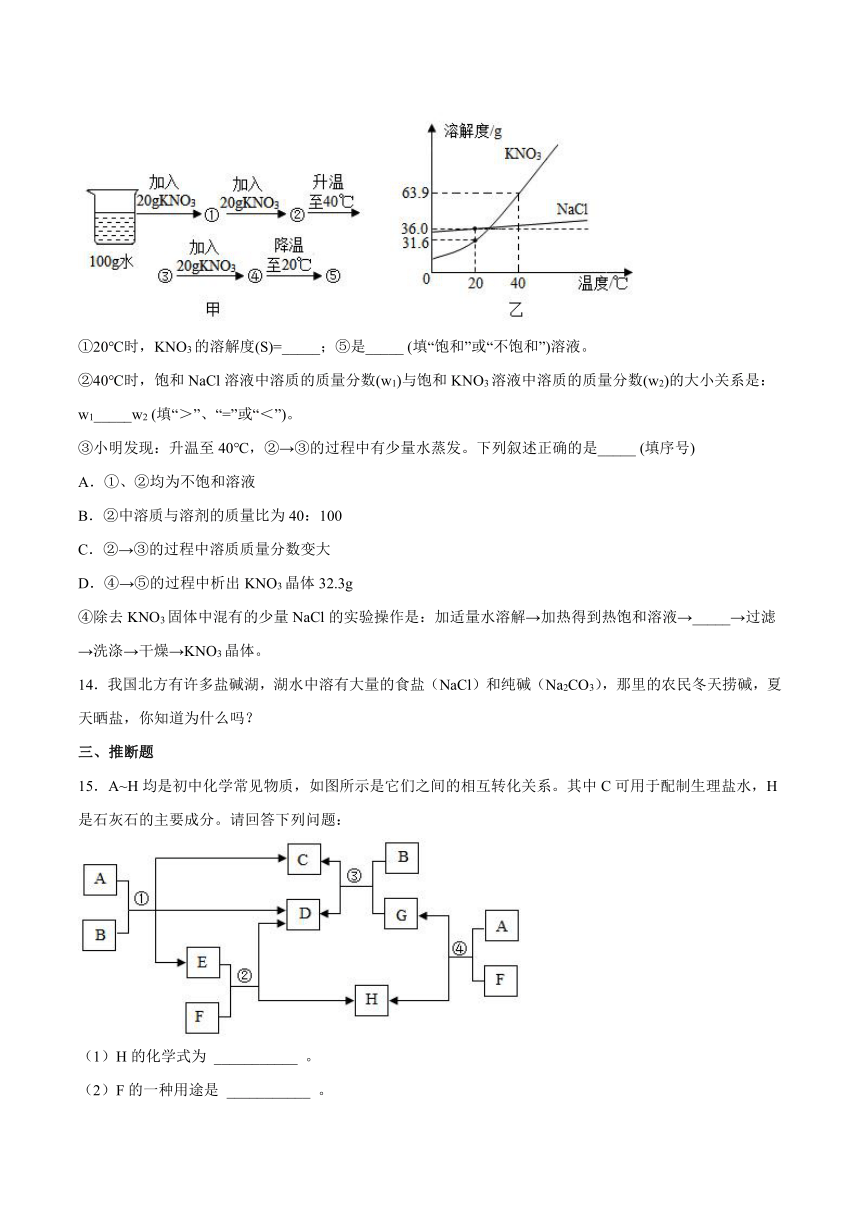
(3)图甲是小明在20℃时进行的系列实验示意图,①一⑤表示实验所得溶液;图乙是NaCl,KNO3的溶解度曲线。
①20℃时,KNO3的溶解度(S)=_____;⑤是_____ (填“饱和”或“不饱和”)溶液。
②40℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1_____w2 (填“>”、“=”或“<”)。
③小明发现:升温至40℃,②→③的过程中有少量水蒸发。下列叙述正确的是_____ (填序号)
A.①、②均为不饱和溶液
B.②中溶质与溶剂的质量比为40:100
C.②→③的过程中溶质质量分数变大
D.④→⑤的过程中析出KNO3晶体32.3g
④除去KNO3固体中混有的少量NaCl的实验操作是:加适量水溶解→加热得到热饱和溶液→_____→过滤→洗涤→干燥→KNO3晶体。
14.我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?
三、推断题
15.A~H均是初中化学常见物质,如图所示是它们之间的相互转化关系。其中C可用于配制生理盐水,H是石灰石的主要成分。请回答下列问题:
(1)H的化学式为 ___________ 。
(2)F的一种用途是 ___________ 。
(3)反应③的基本反应类型为 _______ 。
(4)反应①的化学方程式为 ________ 。
16.如图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式。
酸______,碱______。
(2)写出图中反应②和④的化学方程式。
②________________________________________________________;
④________________________________________________________。
(3)总结化学反应的规律是我们学习化学的方法之一。请根据上图总结出酸、碱、盐相互反应的规律。(写两点)
_____________________________________________;____________________________________________。
17.化学课外兴趣小组的同学准备用BaCl2溶液与适量K2SO4溶液制备BaSO4。完成实验操作1后,同学们发现自己错把K2CO3溶液当成K2SO4溶液。为了不浪费药品,同学们讨论决定,借助其它试剂与固体A继续完成制备BaSO4的实验,其中试剂B中的溶质由两种元素组成。整个实验流程如下:
(1)反应①的基本反应类型为__。
(2)反应②的化学方程式为__
(3)操作Ⅱ的名称为__,溶液b的溶质为__。
(4)从理论上讲,该实验过程最终得到的BaSO4质量__原方案得到的BaSO4质量(填“>”“=”或“<“)
四、实验题
18.I.如图是实验室常用装置。请据图回答下列问题:
(1)实验室若选用A、C装置制取氧气,请写出一个有关反应的化学方程式__________。
(2)实验室选用B、E装置制取和收集二氧化碳,请在虚线框中画出收集二氧化碳的装置图_____;若将发生装置由B改为D,其优点是_________。
II.酸、碱、盐是九年级化学学习的重要知识,它们具有广泛的用途。
(1)酸、碱、盐之间的反应中,生成物中一定有_________生成。
a.水 b.盐 c.沉淀 d.气体
(2)某化学兴趣小组同学利用压强传感器等数字化实验装置进行实验,根据图1的装置先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。
①写出图2中ab段发生反应的化学方程式。_____
②请设计实验验证b点的溶液中是否含有氢氧化钠。_____
③写出d点可能含有的溶质的化学式。_____
④已知50g稀盐酸与10.6g碳酸钠恰好完全反应,则参加反应的稀盐酸中溶质质量分数为多少?_____
五、计算题
19.实验室用10g石灰石样品与足量稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与所加稀盐酸的质量关系如图所示(提示:石灰石样品中的杂质不溶于水,也不与酸发生反应)。请回答下列问题:
(1)该石灰石样品中含碳酸钙的质量为 g。
(2)所用稀盐酸的溶质质量分数是多少?(写出计算过程)。
(3)当恰好完全反应时,反应后所得溶液的溶质质量分数为 (请写出最后一步的列式,不需计算结果)。
20.某废水样品含有氯化钙和少量稀盐酸,某校化学兴趣小组同学测定样品中氯化钙的含量,实验步骤如下:①20g废水样品于烧杯中;②将足量的碳酸钠溶液倒入样品中使其充分反应;③过滤、洗涤、干燥、称量得到的沉淀质量为5g。
(1)若整个操作无损耗且反应恰好完全,计算废水样品中氯化钙质量分数是多少?(结果保留两位小数)
(2)除去废水中的稀盐酸,并提纯氯化钙,可加入过量______(填写化学式),过滤后,滤液蒸发结晶得到CaCl2。
参考答案:
1.B 2.C 3.D 4.B 5.D 6.D 7.A 8.B 9.C 10.C 11.A 12.C 13. D ①③ 31.6g 饱和 < C 降温结晶
14.碳酸钠的溶解度受温度影响很大,冬季温度低,碳酸钠结晶析出;食盐的溶解度受温度影响很小,夏季温度高水分蒸发快食盐结晶析出
15. CaCO3 改良酸性土壤(合理即可) 复分解反应 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
16. ↓ ↓(答案不唯一,合理即可) 酸和碱反应生成盐和水 酸和盐反应生成新酸和新盐(其他答案合理均可)
17.(1)复分解反应
(2)BaCO3+2HCl=BaCl2+H2O+CO2↑
(3) 蒸发 BaCl2、HCl
(4)=
18.
随时控制反应的发生与停止 b 取样,向其中加入足量的氯化钙溶液,充分反应后,静置,取上层清液,向其中滴加适量的酚酞溶液,如果酚酞溶液变红说明含有氢氧化钠,不变红则不含氢氧化钠。 HCl 解:设参加反应的稀盐酸中溶质质量分数为x
x=14.6%
19.)(1)5;
(2)10%
解:设所用稀盐酸中溶质质量为y,
所用稀盐酸的溶质质量分数为
答:所用稀盐酸的溶质质量分数为10%;
(3)
20.(1)解:设氯化钠样品中CaCl2质量为x,得
x=5.55克
CaCl2%=×100%=27.75%
答:废水样品中氯化钙质量分数是27.75%。
(2)CaCO3
一、单选题
1.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
2.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
3.已知某物质在20℃ 和40℃ 时的溶解度分别为10g和40g。某温下,将5g该物质加到20g水中,下列有关叙述正确的是
A.20℃ 时,所得溶液的质量为25g
B.40℃ 时,所得溶液为饱和溶液
C.不管什么温度下,所得溶液的溶质质量分数均为20%
D.该物质的溶解度随温度的升高而增大
4.“河长制”有利于加强水资源保护,防治水体污染。研学小组对两个工厂排污口排放的污水进行检测,发现共含HNO3、K2SO4、MgCl2和NaOH四种物质,其中每个排污口排放两种不同物质。下列关于污水成分的分析合理的是( )
A.HNO3 和K2SO4一定来自同一排污口 B.HNO3 和MgCl2一定来自同 排污口
C.HNO3和NaOH一定来自同一排污口 D.将两处污水混合后,溶液一定呈中性
5.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
6.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
7.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
8.分离、除杂和检验是化学实验的重要环节,下列说法不正确的是
A.分离CO2和CO,先用NaOH溶液吸收CO2,再向该溶液中加足量稀盐酸
B.只用一种试剂无法把稀盐酸、氯化钡溶液和硝酸钾三种溶液区别开
C.除去氯化钙溶液中混有的少量稀盐酸,可加入过量碳酸钙,充分反应后过滤
D.只用组内溶液相互混合方法,能将KOH、Na2SO4、CuSO4、MgCl2鉴别开
9.下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
10.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
11.下列有关资源的说法正确的是( )
A.空气是一种宝贵的资源,各种成分作为原料广泛用于化工、炼钢、石油加工等领域
B.海洋是巨大的资源宝库,含有80多种化学物质
C.空气成分中稀有气体的体积分数为0.96%
D.海水可以淡化,且淡化成本不高,目前已经开始广泛应用
12.粗盐中难溶性杂质的去除过程中,涉及到称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
二、简答题
13.溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是_____ (填字母)。
A.只有固体 B.只有液体
C.只有气体 D.气体、液体、固体都可以
(2)生活中常用75%的酒精消毒,配制75%的酒精溶液不需要用到的仪器有_____ (填序号)。
①天平 ②胶头滴管 ③漏斗 ④量筒 ⑤烧杯 ⑥玻璃棒
(3)图甲是小明在20℃时进行的系列实验示意图,①一⑤表示实验所得溶液;图乙是NaCl,KNO3的溶解度曲线。
①20℃时,KNO3的溶解度(S)=_____;⑤是_____ (填“饱和”或“不饱和”)溶液。
②40℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1_____w2 (填“>”、“=”或“<”)。
③小明发现:升温至40℃,②→③的过程中有少量水蒸发。下列叙述正确的是_____ (填序号)
A.①、②均为不饱和溶液
B.②中溶质与溶剂的质量比为40:100
C.②→③的过程中溶质质量分数变大
D.④→⑤的过程中析出KNO3晶体32.3g
④除去KNO3固体中混有的少量NaCl的实验操作是:加适量水溶解→加热得到热饱和溶液→_____→过滤→洗涤→干燥→KNO3晶体。
14.我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道为什么吗?
三、推断题
15.A~H均是初中化学常见物质,如图所示是它们之间的相互转化关系。其中C可用于配制生理盐水,H是石灰石的主要成分。请回答下列问题:
(1)H的化学式为 ___________ 。
(2)F的一种用途是 ___________ 。
(3)反应③的基本反应类型为 _______ 。
(4)反应①的化学方程式为 ________ 。
16.如图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式。
酸______,碱______。
(2)写出图中反应②和④的化学方程式。
②________________________________________________________;
④________________________________________________________。
(3)总结化学反应的规律是我们学习化学的方法之一。请根据上图总结出酸、碱、盐相互反应的规律。(写两点)
_____________________________________________;____________________________________________。
17.化学课外兴趣小组的同学准备用BaCl2溶液与适量K2SO4溶液制备BaSO4。完成实验操作1后,同学们发现自己错把K2CO3溶液当成K2SO4溶液。为了不浪费药品,同学们讨论决定,借助其它试剂与固体A继续完成制备BaSO4的实验,其中试剂B中的溶质由两种元素组成。整个实验流程如下:
(1)反应①的基本反应类型为__。
(2)反应②的化学方程式为__
(3)操作Ⅱ的名称为__,溶液b的溶质为__。
(4)从理论上讲,该实验过程最终得到的BaSO4质量__原方案得到的BaSO4质量(填“>”“=”或“<“)
四、实验题
18.I.如图是实验室常用装置。请据图回答下列问题:
(1)实验室若选用A、C装置制取氧气,请写出一个有关反应的化学方程式__________。
(2)实验室选用B、E装置制取和收集二氧化碳,请在虚线框中画出收集二氧化碳的装置图_____;若将发生装置由B改为D,其优点是_________。
II.酸、碱、盐是九年级化学学习的重要知识,它们具有广泛的用途。
(1)酸、碱、盐之间的反应中,生成物中一定有_________生成。
a.水 b.盐 c.沉淀 d.气体
(2)某化学兴趣小组同学利用压强传感器等数字化实验装置进行实验,根据图1的装置先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。
①写出图2中ab段发生反应的化学方程式。_____
②请设计实验验证b点的溶液中是否含有氢氧化钠。_____
③写出d点可能含有的溶质的化学式。_____
④已知50g稀盐酸与10.6g碳酸钠恰好完全反应,则参加反应的稀盐酸中溶质质量分数为多少?_____
五、计算题
19.实验室用10g石灰石样品与足量稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与所加稀盐酸的质量关系如图所示(提示:石灰石样品中的杂质不溶于水,也不与酸发生反应)。请回答下列问题:
(1)该石灰石样品中含碳酸钙的质量为 g。
(2)所用稀盐酸的溶质质量分数是多少?(写出计算过程)。
(3)当恰好完全反应时,反应后所得溶液的溶质质量分数为 (请写出最后一步的列式,不需计算结果)。
20.某废水样品含有氯化钙和少量稀盐酸,某校化学兴趣小组同学测定样品中氯化钙的含量,实验步骤如下:①20g废水样品于烧杯中;②将足量的碳酸钠溶液倒入样品中使其充分反应;③过滤、洗涤、干燥、称量得到的沉淀质量为5g。
(1)若整个操作无损耗且反应恰好完全,计算废水样品中氯化钙质量分数是多少?(结果保留两位小数)
(2)除去废水中的稀盐酸,并提纯氯化钙,可加入过量______(填写化学式),过滤后,滤液蒸发结晶得到CaCl2。
参考答案:
1.B 2.C 3.D 4.B 5.D 6.D 7.A 8.B 9.C 10.C 11.A 12.C 13. D ①③ 31.6g 饱和 < C 降温结晶
14.碳酸钠的溶解度受温度影响很大,冬季温度低,碳酸钠结晶析出;食盐的溶解度受温度影响很小,夏季温度高水分蒸发快食盐结晶析出
15. CaCO3 改良酸性土壤(合理即可) 复分解反应 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
16. ↓ ↓(答案不唯一,合理即可) 酸和碱反应生成盐和水 酸和盐反应生成新酸和新盐(其他答案合理均可)
17.(1)复分解反应
(2)BaCO3+2HCl=BaCl2+H2O+CO2↑
(3) 蒸发 BaCl2、HCl
(4)=
18.
随时控制反应的发生与停止 b 取样,向其中加入足量的氯化钙溶液,充分反应后,静置,取上层清液,向其中滴加适量的酚酞溶液,如果酚酞溶液变红说明含有氢氧化钠,不变红则不含氢氧化钠。 HCl 解:设参加反应的稀盐酸中溶质质量分数为x
x=14.6%
19.)(1)5;
(2)10%
解:设所用稀盐酸中溶质质量为y,
所用稀盐酸的溶质质量分数为
答:所用稀盐酸的溶质质量分数为10%;
(3)
20.(1)解:设氯化钠样品中CaCl2质量为x,得
x=5.55克
CaCl2%=×100%=27.75%
答:废水样品中氯化钙质量分数是27.75%。
(2)CaCO3
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
