第四单元盐、化肥同步练习-2021-2022学年九年级化学人教版(五四学制)全一册(word版有答案)
文档属性
| 名称 | 第四单元盐、化肥同步练习-2021-2022学年九年级化学人教版(五四学制)全一册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 172.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-15 23:08:54 | ||
图片预览



文档简介
第四单元盐、化肥同步练习2021-2022学年九年级化学人教版(五四学制)全一册
一、单选题
1.下列物质的俗名错误的是
A.氢氧化钙:熟石灰 B.硫酸铜:胆矾
C.氧化钙:生石灰 D.固体二氧化碳:干冰
2.下列物质的名称和俗名相对应的是( )
A.碳酸钙﹣纯碱 B.氯化钠﹣食盐 C.碳酸钙﹣小苏打 D.氧化钙﹣熟石灰
3.下列有关叙述对应的化学方程式,所属基本反应类型都正确的是
A.用碳酸氢钠治疗胃酸过多 复分解反应
B.细铁丝在氧气中燃烧 氧化反应
C.铝与硫酸铜溶液反应 置换反应
D.二氧化碳与澄清石灰水 中和反应
4.下列有关纯碱的说法正确的是
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打可以用稀盐酸除去
5.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
6.在pH=3的溶液中,下列离子可以大量共存的是
A.Cu2+ K+ NO
B.Ag+ Na+ Cl-
C.Na+ Ba2+ OH-
D.K+ Ba 2+ SO
7.稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,如图操作及实验现象(或结果),不能证明反应发生的是
A.在混合液中加金属Zn,无气泡产生
B.在混合液中加无色酚酞,溶液呈无色的
C.在混合液中加AgNO3溶液,有白色沉淀
D.用pH试纸测混合液的pH,测得pH等于7
8.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
9.向一定质量的FeCl3溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列说法正确的是
A.a点时溶液中一定存在Fe3+
B.c点时所加试剂是NaOH溶液
C.加入试剂总体积为V1时,溶液中不存在NaOH
D.d点时溶液中的溶质不只是盐
10.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 分离KCl和MnO2的固体混合物 加足量的水溶解,过滤
B 鉴别NaNO3和NH4HCO3两种氮肥 取样,闻气味
C 除去CO中的CO2 将混合气体通过红热的铜网
D 探究铁钉生锈的条件 将两根铁钉分别密封在盛有干燥空气和盛满水的试管中一周并观察现象
A.A B.B C.C D.D
11.如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后U型管内液面a低于b,不符合上述实验现象的一组试剂是
A.生石灰和水 B.铁粉和稀盐酸 C.硝酸铵和水 D.纯碱和稀盐酸
12.按下表进行实验,有关说法及分析错误的是
向少量NaOH溶液滴加CuSO4溶液 向少量BaCl2溶液中滴加CuSO4溶液
现象 ① 白色沉淀
反应方程式 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 ②
A.①有蓝色沉淀
B.②反应的化学方程式为:CuSO4+BaCl2=BaSO4↓+CuCl2
C.两个反应都属于复分解反应
D.只要有沉淀生成的反应就属于复分解反应
二、简答题
13.在硫酸铜溶液中滴加石灰水,可以看到_____________,发生反应的方程式为_______________农业上用此配成_________液对农作物有很好的杀虫作用。
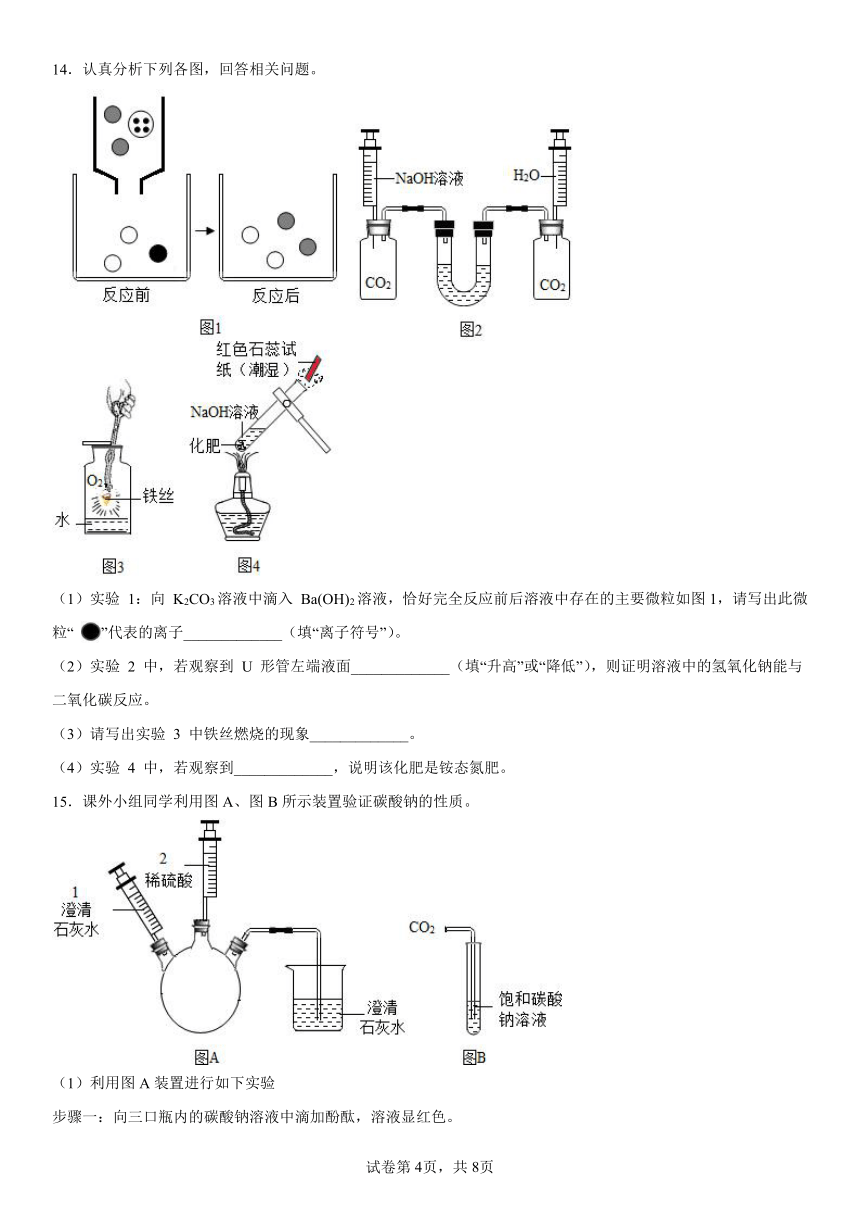
14.认真分析下列各图,回答相关问题。
(1)实验 1:向 K2CO3溶液中滴入 Ba(OH)2溶液,恰好完全反应前后溶液中存在的主要微粒如图1,请写出此微粒“ ”代表的离子_____________(填“离子符号”)。
(2)实验 2 中,若观察到 U 形管左端液面_____________(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。
(3)请写出实验 3 中铁丝燃烧的现象_____________。
(4)实验 4 中,若观察到_____________,说明该化肥是铵态氮肥。
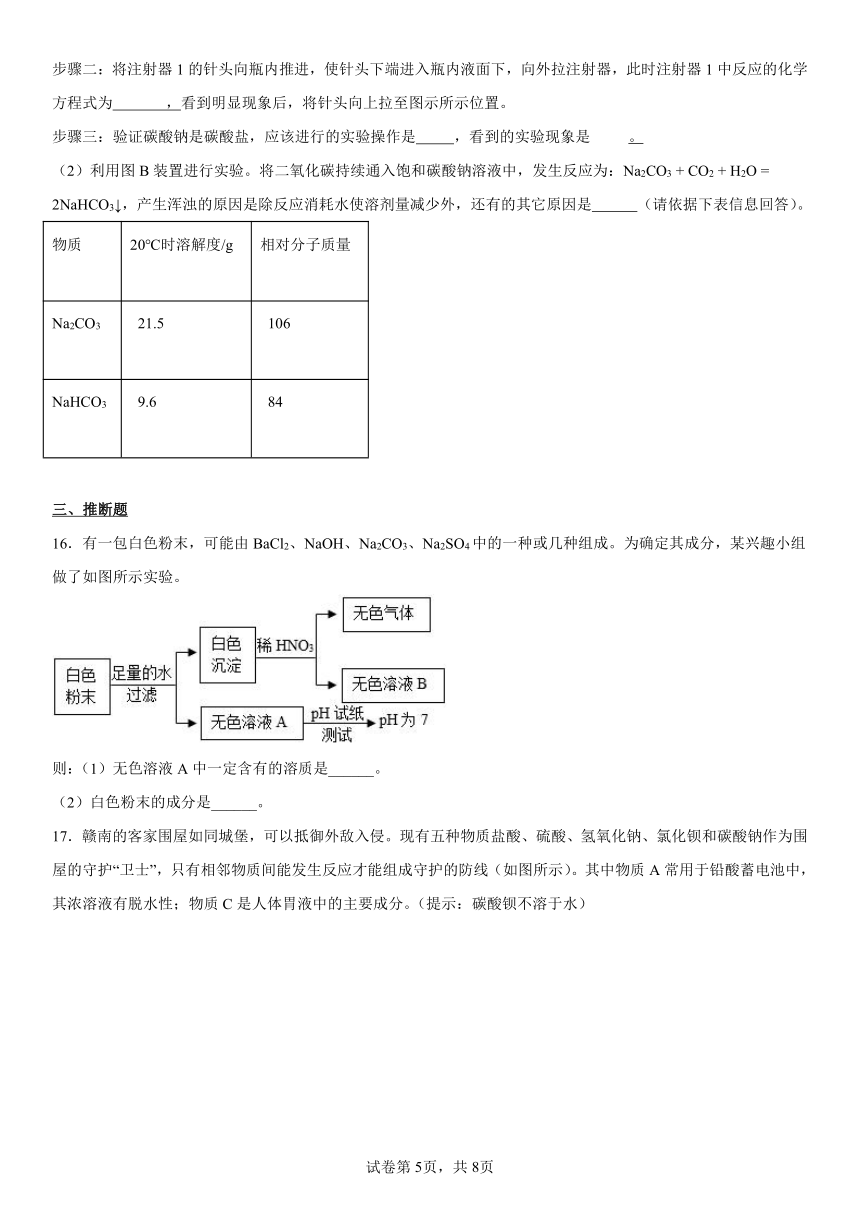
15.课外小组同学利用图A、图B所示装置验证碳酸钠的性质。
(1)利用图A装置进行如下实验
步骤一:向三口瓶内的碳酸钠溶液中滴加酚酞,溶液显红色。
步骤二:将注射器1的针头向瓶内推进,使针头下端进入瓶内液面下,向外拉注射器,此时注射器1中反应的化学方程式为 ,看到明显现象后,将针头向上拉至图示所示位置。
步骤三:验证碳酸钠是碳酸盐,应该进行的实验操作是 ,看到的实验现象是 。
(2)利用图B装置进行实验。将二氧化碳持续通入饱和碳酸钠溶液中,发生反应为:Na2CO3 + CO2 + H2O = 2NaHCO3↓,产生浑浊的原因是除反应消耗水使溶剂量减少外,还有的其它原因是 (请依据下表信息回答)。
物质 20℃时溶解度/g 相对分子质量
Na2CO3 21.5 106
NaHCO3 9.6 84
三、推断题
16.有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。
则:(1)无色溶液A中一定含有的溶质是______。
(2)白色粉末的成分是______。
17.赣南的客家围屋如同城堡,可以抵御外敌入侵。现有五种物质盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠作为围屋的守护“卫士”,只有相邻物质间能发生反应才能组成守护的防线(如图所示)。其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分。(提示:碳酸钡不溶于水)
(1)A物质是_________________
(2)B与C反应的化学方程式为_____________________;
A与E反应时的实验现象为_______________;
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质与两位相邻的守护“卫士”都能发生反应才能攻破防线,那么能攻入围屋的物质是____(填序号)。
①铁 ②氧化铁 ③二氧化碳 ④氢氧化钡
四、实验题
18.如图三个实验均可验证无现象的化学反应发生了。
【实验一】当观察到______现象时,证明化学反应发生,化学方程式是______。
【实验二】加入 X 可验证稀硫酸与NaOH 能发生反应,符合此条件的X 是______。
A.FeCl3 B. C.Na2CO3 D.
【实验三】用气压传感器测得曲线1 和2,要证明CO2 与NaOH 一定发生了反应,左瓶中应加入______;曲线 1 变化平缓的原因是______。
【反思】上述实验的设计思想是通过证明______,来判断化学反应的发生。
19.化肥是植物生长必不可少的营养成分,李爷爷分别采购了硝酸铵和硫酸钾两种化肥,却因运输过程中外包装受损导致无法辨认,请你帮李爷爷设计实验进行鉴别,并将实验操作、实验现象及实验结论填入下表:
实验操作 实验现象 实验结论
__________ __________ __________
20.在学习碳酸钠的性质的课堂上,老师向碳酸钠溶液中加入一定量的澄清石灰水,产生白色沉淀,滤出沉淀后,引导同学们对滤液中溶质的成分进行探究。同学们通过讨论认为溶质是NaOH、Na2CO3、Ca(OH)2中的一种或两种,其可能情况有三种:①NaOH;②NaOH和Na2CO3;③_____。
小伟同学设计了下列实验方案,请你帮助完成。
实验步骤 可能出现的实验现象 实验结论
(1)取少量滤液于试管中,加入碳酸钠溶液 产生_____ 假设③成立
(2)取少量滤液于试管中加入足量稀盐酸 放出无色气体 假设_____成立
(3)取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 均没有明显现象 假设_____成立
小强根据小伟设计的实验方案,在滤液中加入足量稀盐酸,观察到有大量气泡产生,产生该现象的化学方程式为_____。
因此在分析反应后剩余物质的种类时,既要考虑生成物,又要考虑_____。
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.某硫酸铵(化学式为(NH4)2SO4)化肥中含氮20%,该肥料中所含硫酸铵的质量分数为多少?
23.某混合物由氯化钾和碳酸钾组成,取该混合物28g,其中含氧元素4.8g,向其中加入100g水全部溶解,然后滴加一定质量和溶质质量分数的氯化钡溶液,恰好完全反应,过滤得213.3g的滤液。计算:
(1)原混合物中氯化钾的质量;
(2)过滤后所得滤渣的质量;
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
24.草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市发布通告,禁止露天烧制草木灰。
(1)从化学肥料分类角度分析。碳酸钾属于___________(填氮肥、磷肥、或钾肥)。
(2)要确认草木灰浸出液中含有,需用到的试剂是___________。
(3)为测定草木灰中碳酸钾的质量分数,小科进行以下实验:
①取50克样品加入足量的蒸馏水,充分搅拌静置后,浸出液全部转移到烧杯中;
②在烧杯中加入足量的CaCl2溶液,得到沉淀;
③将沉淀过滤洗涤、烘干后得到5g固体;
求该样品中碳酸钾的质量分数。(杂质不发生化学反应,K2CO3+CaCl2=2KCl+CaCO3↓)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.A
4.C
5.C
6.A
7.C
8.B
9.C
10.B
11.C
12.D
13.蓝色沉淀生成 CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 波尔多
14. (1)CO32- (2)升高 (3)剧烈燃烧,火星四射,放出热量,生成黑色固体
(4)红色石蕊试纸变蓝
15.(1)步骤三:将注射器2中稀硫酸推入瓶中 瓶中产生气泡,烧杯中澄清石灰水变浑浊
(2)20℃时,碳酸氢钠的溶解度小于碳酸钠;生成碳酸氢钠的质量大于参加反应的碳酸钠的质量
16. (1)氯化钠(NaC1) (2)氯化钡和碳酸钠(BaCl2和Na2CO3)
17. (1)H2SO4 (2) NaOH+HCl=NaCl+ H2O (3)产生白色沉淀 ④
18. (1)溶液由红色变为无色 (2) (3) A 20mL水 (4) CO2 在水中的溶解度较小且与水反应的量小 反应物已转化为其他物质
19. (1)分别取少量样品溶于水中(方法二:分别取少量样品加入到氯化钡溶液中;方法三:分别取少量样品加熟石灰研磨(或加入到某些碱溶液中)) (2)一份样品加入后温度降低,另一份温度不变;(方法二:一份样品会出现白色沉淀,另一份无明显现象;方法三:一份样品加入后产生刺激性气味的气体,另一份无明显现象) (3) 温度降低的样品是硝酸铵,温度不变的是硫酸钾(方法二:出现白色沉淀的是硫酸钾,无明显现象的是硝酸铵;方法三:出现刺激性气味的是硝酸铵,无明显现象的是硫酸钾)
20.(1)NaOH和Ca(OH)2 (2)白色沉淀 ② ① (3)反应物是否有剩余/反应物是否过量
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.纯硫酸铵中氮元素的质量分数为:;
化肥中硫酸铵的纯度为:。
23.(1)14.2g
(2)碳酸钾与氯化钡反应生成碳酸钡和氯化钾,故过滤后所得滤渣为碳酸钡,设生成碳酸钡的质量为x,反应生成氯化钾的质量为y
x=19.7g
y=14.9g
答:过滤后所得滤渣的质量为19.7g
(3)反应后所得溶液中溶质的质量分数:
答:反应后所得溶液中溶质的质量分数为13.6%。
24.(1)钾肥
(2)稀盐酸和氢氧化钙溶液
(3)解:设样品中碳酸钾的质量为x。
该样品中碳酸钾的质量分数为×100%=13.8%
答:该样品中碳酸钾的质量分数为13.8%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的俗名错误的是
A.氢氧化钙:熟石灰 B.硫酸铜:胆矾
C.氧化钙:生石灰 D.固体二氧化碳:干冰
2.下列物质的名称和俗名相对应的是( )
A.碳酸钙﹣纯碱 B.氯化钠﹣食盐 C.碳酸钙﹣小苏打 D.氧化钙﹣熟石灰
3.下列有关叙述对应的化学方程式,所属基本反应类型都正确的是
A.用碳酸氢钠治疗胃酸过多 复分解反应
B.细铁丝在氧气中燃烧 氧化反应
C.铝与硫酸铜溶液反应 置换反应
D.二氧化碳与澄清石灰水 中和反应
4.下列有关纯碱的说法正确的是
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打可以用稀盐酸除去
5.化肥碳酸铵、硫酸钾均为白色固体。分别取少量固体进行下列实验,不能将两者区别出来的是
A.与熟石灰粉末混合研磨 B.加入稀盐酸中
C.加入溶液中 D.加入溶液中
6.在pH=3的溶液中,下列离子可以大量共存的是
A.Cu2+ K+ NO
B.Ag+ Na+ Cl-
C.Na+ Ba2+ OH-
D.K+ Ba 2+ SO
7.稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,如图操作及实验现象(或结果),不能证明反应发生的是
A.在混合液中加金属Zn,无气泡产生
B.在混合液中加无色酚酞,溶液呈无色的
C.在混合液中加AgNO3溶液,有白色沉淀
D.用pH试纸测混合液的pH,测得pH等于7
8.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
9.向一定质量的FeCl3溶液中滴加NaOH溶液一段时间后,改为滴加稀盐酸,所得沉淀质量随加入试剂总体积的变化趋势如图所示。下列说法正确的是
A.a点时溶液中一定存在Fe3+
B.c点时所加试剂是NaOH溶液
C.加入试剂总体积为V1时,溶液中不存在NaOH
D.d点时溶液中的溶质不只是盐
10.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 分离KCl和MnO2的固体混合物 加足量的水溶解,过滤
B 鉴别NaNO3和NH4HCO3两种氮肥 取样,闻气味
C 除去CO中的CO2 将混合气体通过红热的铜网
D 探究铁钉生锈的条件 将两根铁钉分别密封在盛有干燥空气和盛满水的试管中一周并观察现象
A.A B.B C.C D.D
11.如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后U型管内液面a低于b,不符合上述实验现象的一组试剂是
A.生石灰和水 B.铁粉和稀盐酸 C.硝酸铵和水 D.纯碱和稀盐酸
12.按下表进行实验,有关说法及分析错误的是
向少量NaOH溶液滴加CuSO4溶液 向少量BaCl2溶液中滴加CuSO4溶液
现象 ① 白色沉淀
反应方程式 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 ②
A.①有蓝色沉淀
B.②反应的化学方程式为:CuSO4+BaCl2=BaSO4↓+CuCl2
C.两个反应都属于复分解反应
D.只要有沉淀生成的反应就属于复分解反应
二、简答题
13.在硫酸铜溶液中滴加石灰水,可以看到_____________,发生反应的方程式为_______________农业上用此配成_________液对农作物有很好的杀虫作用。
14.认真分析下列各图,回答相关问题。
(1)实验 1:向 K2CO3溶液中滴入 Ba(OH)2溶液,恰好完全反应前后溶液中存在的主要微粒如图1,请写出此微粒“ ”代表的离子_____________(填“离子符号”)。
(2)实验 2 中,若观察到 U 形管左端液面_____________(填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应。
(3)请写出实验 3 中铁丝燃烧的现象_____________。
(4)实验 4 中,若观察到_____________,说明该化肥是铵态氮肥。
15.课外小组同学利用图A、图B所示装置验证碳酸钠的性质。
(1)利用图A装置进行如下实验
步骤一:向三口瓶内的碳酸钠溶液中滴加酚酞,溶液显红色。
步骤二:将注射器1的针头向瓶内推进,使针头下端进入瓶内液面下,向外拉注射器,此时注射器1中反应的化学方程式为 ,看到明显现象后,将针头向上拉至图示所示位置。
步骤三:验证碳酸钠是碳酸盐,应该进行的实验操作是 ,看到的实验现象是 。
(2)利用图B装置进行实验。将二氧化碳持续通入饱和碳酸钠溶液中,发生反应为:Na2CO3 + CO2 + H2O = 2NaHCO3↓,产生浑浊的原因是除反应消耗水使溶剂量减少外,还有的其它原因是 (请依据下表信息回答)。
物质 20℃时溶解度/g 相对分子质量
Na2CO3 21.5 106
NaHCO3 9.6 84
三、推断题
16.有一包白色粉末,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,某兴趣小组做了如图所示实验。
则:(1)无色溶液A中一定含有的溶质是______。
(2)白色粉末的成分是______。
17.赣南的客家围屋如同城堡,可以抵御外敌入侵。现有五种物质盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠作为围屋的守护“卫士”,只有相邻物质间能发生反应才能组成守护的防线(如图所示)。其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分。(提示:碳酸钡不溶于水)
(1)A物质是_________________
(2)B与C反应的化学方程式为_____________________;
A与E反应时的实验现象为_______________;
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质与两位相邻的守护“卫士”都能发生反应才能攻破防线,那么能攻入围屋的物质是____(填序号)。
①铁 ②氧化铁 ③二氧化碳 ④氢氧化钡
四、实验题
18.如图三个实验均可验证无现象的化学反应发生了。
【实验一】当观察到______现象时,证明化学反应发生,化学方程式是______。
【实验二】加入 X 可验证稀硫酸与NaOH 能发生反应,符合此条件的X 是______。
A.FeCl3 B. C.Na2CO3 D.
【实验三】用气压传感器测得曲线1 和2,要证明CO2 与NaOH 一定发生了反应,左瓶中应加入______;曲线 1 变化平缓的原因是______。
【反思】上述实验的设计思想是通过证明______,来判断化学反应的发生。
19.化肥是植物生长必不可少的营养成分,李爷爷分别采购了硝酸铵和硫酸钾两种化肥,却因运输过程中外包装受损导致无法辨认,请你帮李爷爷设计实验进行鉴别,并将实验操作、实验现象及实验结论填入下表:
实验操作 实验现象 实验结论
__________ __________ __________
20.在学习碳酸钠的性质的课堂上,老师向碳酸钠溶液中加入一定量的澄清石灰水,产生白色沉淀,滤出沉淀后,引导同学们对滤液中溶质的成分进行探究。同学们通过讨论认为溶质是NaOH、Na2CO3、Ca(OH)2中的一种或两种,其可能情况有三种:①NaOH;②NaOH和Na2CO3;③_____。
小伟同学设计了下列实验方案,请你帮助完成。
实验步骤 可能出现的实验现象 实验结论
(1)取少量滤液于试管中,加入碳酸钠溶液 产生_____ 假设③成立
(2)取少量滤液于试管中加入足量稀盐酸 放出无色气体 假设_____成立
(3)取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 均没有明显现象 假设_____成立
小强根据小伟设计的实验方案,在滤液中加入足量稀盐酸,观察到有大量气泡产生,产生该现象的化学方程式为_____。
因此在分析反应后剩余物质的种类时,既要考虑生成物,又要考虑_____。
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.某硫酸铵(化学式为(NH4)2SO4)化肥中含氮20%,该肥料中所含硫酸铵的质量分数为多少?
23.某混合物由氯化钾和碳酸钾组成,取该混合物28g,其中含氧元素4.8g,向其中加入100g水全部溶解,然后滴加一定质量和溶质质量分数的氯化钡溶液,恰好完全反应,过滤得213.3g的滤液。计算:
(1)原混合物中氯化钾的质量;
(2)过滤后所得滤渣的质量;
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
24.草木灰(主要成分为K2CO3)是一种常见的肥料。烧制草木灰是我国传统耕方式,但会造成一定的环境污染。为护卫蓝天白云,我市发布通告,禁止露天烧制草木灰。
(1)从化学肥料分类角度分析。碳酸钾属于___________(填氮肥、磷肥、或钾肥)。
(2)要确认草木灰浸出液中含有,需用到的试剂是___________。
(3)为测定草木灰中碳酸钾的质量分数,小科进行以下实验:
①取50克样品加入足量的蒸馏水,充分搅拌静置后,浸出液全部转移到烧杯中;
②在烧杯中加入足量的CaCl2溶液,得到沉淀;
③将沉淀过滤洗涤、烘干后得到5g固体;
求该样品中碳酸钾的质量分数。(杂质不发生化学反应,K2CO3+CaCl2=2KCl+CaCO3↓)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.A
4.C
5.C
6.A
7.C
8.B
9.C
10.B
11.C
12.D
13.蓝色沉淀生成 CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 波尔多
14. (1)CO32- (2)升高 (3)剧烈燃烧,火星四射,放出热量,生成黑色固体
(4)红色石蕊试纸变蓝
15.(1)步骤三:将注射器2中稀硫酸推入瓶中 瓶中产生气泡,烧杯中澄清石灰水变浑浊
(2)20℃时,碳酸氢钠的溶解度小于碳酸钠;生成碳酸氢钠的质量大于参加反应的碳酸钠的质量
16. (1)氯化钠(NaC1) (2)氯化钡和碳酸钠(BaCl2和Na2CO3)
17. (1)H2SO4 (2) NaOH+HCl=NaCl+ H2O (3)产生白色沉淀 ④
18. (1)溶液由红色变为无色 (2) (3) A 20mL水 (4) CO2 在水中的溶解度较小且与水反应的量小 反应物已转化为其他物质
19. (1)分别取少量样品溶于水中(方法二:分别取少量样品加入到氯化钡溶液中;方法三:分别取少量样品加熟石灰研磨(或加入到某些碱溶液中)) (2)一份样品加入后温度降低,另一份温度不变;(方法二:一份样品会出现白色沉淀,另一份无明显现象;方法三:一份样品加入后产生刺激性气味的气体,另一份无明显现象) (3) 温度降低的样品是硝酸铵,温度不变的是硫酸钾(方法二:出现白色沉淀的是硫酸钾,无明显现象的是硝酸铵;方法三:出现刺激性气味的是硝酸铵,无明显现象的是硫酸钾)
20.(1)NaOH和Ca(OH)2 (2)白色沉淀 ② ① (3)反应物是否有剩余/反应物是否过量
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.纯硫酸铵中氮元素的质量分数为:;
化肥中硫酸铵的纯度为:。
23.(1)14.2g
(2)碳酸钾与氯化钡反应生成碳酸钡和氯化钾,故过滤后所得滤渣为碳酸钡,设生成碳酸钡的质量为x,反应生成氯化钾的质量为y
x=19.7g
y=14.9g
答:过滤后所得滤渣的质量为19.7g
(3)反应后所得溶液中溶质的质量分数:
答:反应后所得溶液中溶质的质量分数为13.6%。
24.(1)钾肥
(2)稀盐酸和氢氧化钙溶液
(3)解:设样品中碳酸钾的质量为x。
该样品中碳酸钾的质量分数为×100%=13.8%
答:该样品中碳酸钾的质量分数为13.8%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
