江苏省南京市2012-2013学年高三学业水平第一次模拟考试化学试题(有答案)
文档属性
| 名称 | 江苏省南京市2012-2013学年高三学业水平第一次模拟考试化学试题(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 308.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2013-02-25 11:56:19 | ||
图片预览




文档简介
江苏省南京市2012-2013学年高三学业水平第一次模拟考试化学试题
注意事项:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必将自己的学校、班级、姓名填写在密封线内。
可能用到的相对原子质量:
H一1 C一12 N一14 O—16 Mg一24 Al一27 S一32 Fe一56 Ba一137
一、单项选择题(本部分23题,每题3分,共69分。每题只有一个选项符合题意)
1.于谦的《石灰吟》,借石灰石(碳酸钙)表现了作者“粉身碎骨浑不怕,要留清白在人间”的人格精神。碳酸钙属于 ( )
A.单质 B.氧化物 C.酸 D.盐
2.某些液体用肉眼难以区分是胶体还是溶液。区分胶体和溶液的实验方法可行的是 ( )
A.一束光照射 B加热至沸 C.静置沉降 D.过滤
3.下列溶液中滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是 ( )
A.氯化钡 B.氢氧化钡 C.碳酸钠 D.氢氧化钾
4.下列物质水解的最终产物中含有葡萄糖的是 ( )
A.蛋白质 B氨基酸 C.油脂 D.蔗糖
5.下列物质属于共价化合物的是 ( )
A.KOH B.MgO C.C2H6 D.C60
6.下列实验中溶液变为红色的是 ( )
A.紫色石蕊溶液中滴加氨水 B.品红溶液中滴加饱和二氧化硫溶液
C.硫氰化钾溶液中滴加氯化铁溶液 D.把铜片投入到浓硝酸中
7.关于化学键的叙述中正确的是 ( )
A.Na2O2中含有共价键 B.H2中不含共价键
C.NH4 Cl中只含离子键 D.CaCl2中既含离子键又含共价键
8.实验室用98%的浓硫酸(密度为1.84 g·mL-1)配制500 mL0.5 mol·L-1的稀硫酸。已选用的主要仪器有烧杯、胶头滴管、玻璃棒,还缺少的仪器是 ( )
A.容量瓶、13.6 mL量筒 B.容量瓶、100 mlL量筒
C.500 mL容量瓶、100 mL量筒 D .500 mL容量瓶、25 mL量筒
9.对下列物质用途的描述不符合事实的是
A.硅酸钠溶液可用作木材防火剂 B铝制容器可以贮运稀硝酸
C.过氧化钠可作潜水艇的供氧剂 D.氯气可用于制造漂白粉
10.锌是人体不可缺少的微量元素之一。下列关于6530Zn的说法正确的是
A.质子数为30 B.中子数为30 C.核外电子数为35 D.质量数为65
11.下列物质之间的转化,不能一步完成的是
A.Na2O→NaOH B.SO3→H2SO4 C.SiO2→H2SiO3 D.Na2CO3→NaHCO3
12.下列离子方程式书写正确的是
13.在pH=1的澄清透明溶液中,能大量共存的离子组是
A.Na+、HCO3、Cl— B. K+、SO42-、OH- C. Cu2+、Na+、SO42- D.NH4+、、Al3+、CO32-
14.关于化学反应中能量变化的说法不符合事实的是 ( )
A.化学键断裂吸收能量,化学键生成放出能量 B化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应 D.右图所示的反应为放热反应
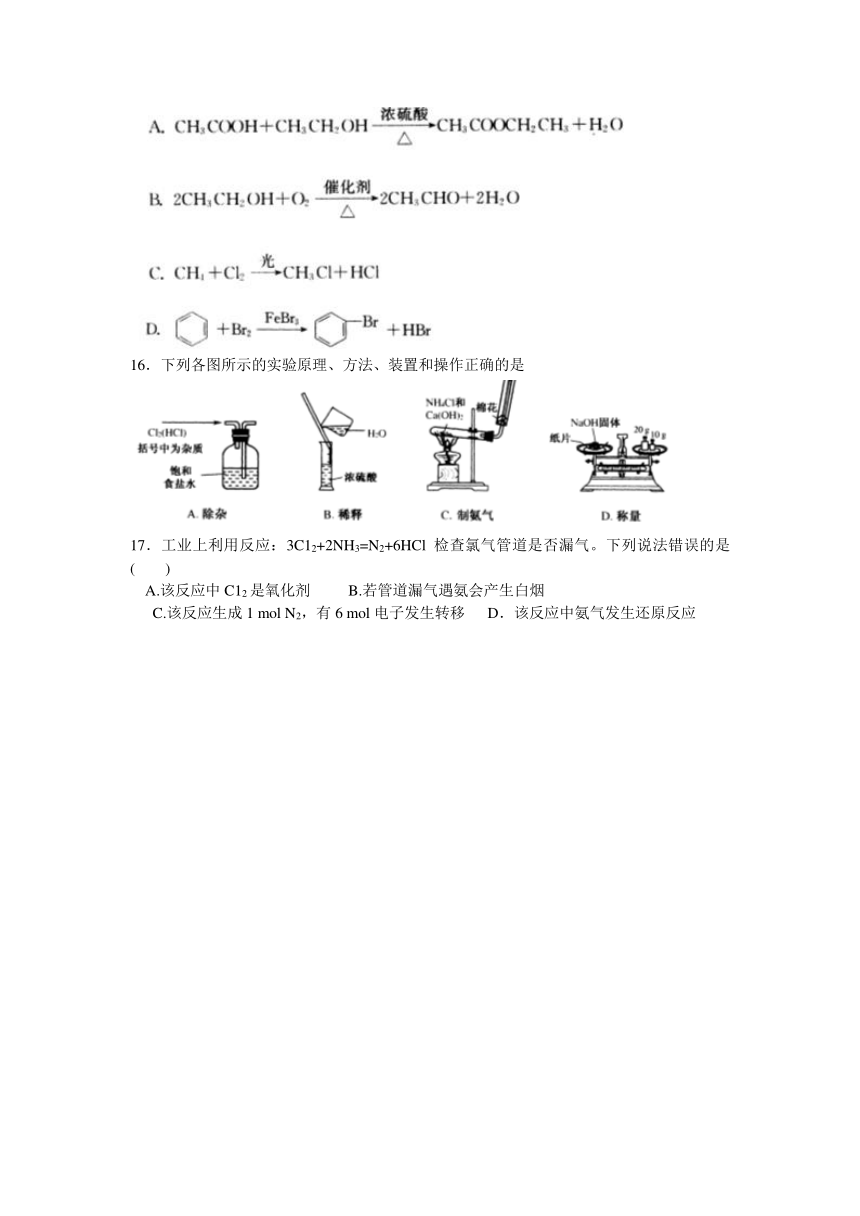
15.下列有机反应中,有一种反应类型与其他三种反应类型不同的是
16.下列各图所示的实验原理、方法、装置和操作正确的是
17.工业上利用反应:3C12+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A.该反应中C12是氧化剂 B.若管道漏气遇氨会产生白烟
C.该反应生成1 mol N2,有6 mol电子发生转移 D.该反应中氨气发生还原反应
18.下列化学用语正确的是 ( )
19.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1 L I mol·L-1 CaCl2溶液中含有的氯离子数为2NA
B.锌从盐酸中置换出1 mol H2,电子转移数为NA
C.常温常压下,11.2 L氧气含有的原子数为NA
D.4.4 g二氧化碳含有的原子数为0.1NA
20.下列有机物互为同分异构体的是
A.正丁烷和异丁烷 B.淀粉和纤维素 C.乙烯和聚乙烯 D.乙酸和乙醇
21.右图为铜一铁一稀硫酸构成的原电池示意图,下列说法错误的是 ( )
A.铁片为负极,且铁片逐渐溶解 B.铜片为正极,且铜片上有气泡
C.电子由铜片通过导线流向铁片 D. 该装置能将化学能转变为电能
22.X、Y、Z是元素周期表中相邻的三种短周期元素,它们的原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物。下列叙述正确的是
A.Z是第二周期ⅣA族元素 B.最高价氧化物对应水化物的酸性:Y>X
C.非金属性:X>Y>Z D.X、Y、Z的氢化物稳定性逐渐减弱
23.在硫酸铝、硫酸和硫酸镁的混合溶液200 mL中,c(SO42-)=0.80mol·L-1,当加入等体积1.6 mol·L-1KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得到白色沉淀2.32 g。则反应前的混合溶液中c(A13+)可能是 ( )
A.0.20 mol·L-1 B.0.40 mol·L-1 C.0.80 mol·L-1 D. 1.20 mol·L-1
二、非选择题(本部分3题,共31分)
24.(15分)
(1)(3分)关注营养平衡_'认识人体必需的重要营养物质。
①糖类是生命的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是 。
A.糖类 B.油脂 C.蛋白质
②碘缺乏会使人智力低下,配制加碘盐时,一般往食盐中加入微量的 。
A.KI B.I2 C.KIO3
③人体牙龈出血、患坏血病;主要是缺乏 。
A.维生素A B.维生素B C.维生素C
(2)(5分)合理选择饮食,正确使用药物,促进身心健康。
①选择食物要注意食物的酸碱性和营养搭配。
蔬菜、水果一般属于 (填“酸”或“碱”)性食物。
②阿司匹林()是常用的 药。它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为 。
③复方氢氧化铝可治疗胃酸过多,写出氢氧化铝与胃酸(HCl)反应的离子方程式: 。
(3)(7分)2014年的青奥会,古都南京将以优美的环境迎来四海宾客。
①控制粉尘污染和汽车尾气,让天空更蓝。燃煤气化有助于控制大气中PM2.5的含量,写出灼热的焦炭与水蒸气反应的化学方程式: 。汽车必须使用无铅汽油,其原因是 。
②治理污水,让河流更清。治理含汞废水可用沉淀法,往废液中加入适量的硫化钠溶液可将汞离子(Hg2+)转化成 (写化学式)沉淀出来。
③玻璃和不锈钢是青奥会场馆建设中大量使用的功能性和装饰性材料。在玻璃制造中,碳酸钠与二 氧化硅发生反应的化学方程式是 。制玻璃和水泥的共同原料是 (写名称或化学式)。
25.(6分)下图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色。F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色。图中的部分反应产物或反应物已略去。
(1)写出G的化学式: 。
(2)写出F的电子式: 。
(3) 写出D单质和E溶液反应的离子方程式: 。
(4)写出电解B溶液的化学方程式: 。
26.(10分)黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
【实验一】测定硫元素的含量。
I.将m1g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中主要发生反应的化学方程式为
4FeS2+11O2=Fe2O3+8SO2。
Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠)。
【实验二】测定铁元素的含量。
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+)。
问题讨论:
(1)图1装置中,甲瓶内所盛试剂是 溶液。
(2)图2流程中除了可以用H2O2溶液作为氧化剂,还可用 (填序号)为氧化剂。
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 (用含字母的式子表示)。
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式: 。
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分)。
2013年南京市学业水平第一次模拟考试
化学参考答案及评分标准
一、单项选择题(本部分23题,每题3分,共69分)
1.D 2.A 3.B 4.D 5.C 6.C 7.A 8.D 9.B 10.A 1 1.C 12.D 13.C 14.D 15.B 16.C
17.D 18.C 19.A 20.A 21.C 22.B 23.A
二、非选择题(本部分3题,共3 1分)
24.(1 5分)
(1) ①B(1分) ②C(1分) ③C(1分)
(2)①碱(1分) ②解热镇痛(1分)
③Al(OH)3+3H+=Al3++3H2O(2分)
(3) ① 铅有污染(1分)
. ②HgS(1分)
③ (2分) 石灰石(CaCO3)(1分)
25.
江苏省南京市2012-2013学年高三学业水平第一次模拟考试化学试题
注意事项:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必将自己的学校、班级、姓名填写在密封线内。
可能用到的相对原子质量:
H一1 C一12 N一14 O—16 Mg一24 Al一27 S一32 Fe一56 Ba一137
一、单项选择题(本部分23题,每题3分,共69分。每题只有一个选项符合题意)
1.于谦的《石灰吟》,借石灰石(碳酸钙)表现了作者“粉身碎骨浑不怕,要留清白在人间”的人格精神。碳酸钙属于 ( )
A.单质 B.氧化物 C.酸 D.盐
2.某些液体用肉眼难以区分是胶体还是溶液。区分胶体和溶液的实验方法可行的是 ( )
A.一束光照射 B加热至沸 C.静置沉降 D.过滤
3.下列溶液中滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是 ( )
A.氯化钡 B.氢氧化钡 C.碳酸钠 D.氢氧化钾
4.下列物质水解的最终产物中含有葡萄糖的是 ( )
A.蛋白质 B氨基酸 C.油脂 D.蔗糖
5.下列物质属于共价化合物的是 ( )
A.KOH B.MgO C.C2H6 D.C60
6.下列实验中溶液变为红色的是 ( )
A.紫色石蕊溶液中滴加氨水 B.品红溶液中滴加饱和二氧化硫溶液
C.硫氰化钾溶液中滴加氯化铁溶液 D.把铜片投入到浓硝酸中
7.关于化学键的叙述中正确的是 ( )
A.Na2O2中含有共价键 B.H2中不含共价键
C.NH4 Cl中只含离子键 D.CaCl2中既含离子键又含共价键
8.实验室用98%的浓硫酸(密度为1.84 g·mL-1)配制500 mL0.5 mol·L-1的稀硫酸。已选用的主要仪器有烧杯、胶头滴管、玻璃棒,还缺少的仪器是 ( )
A.容量瓶、13.6 mL量筒 B.容量瓶、100 mlL量筒
C.500 mL容量瓶、100 mL量筒 D .500 mL容量瓶、25 mL量筒
9.对下列物质用途的描述不符合事实的是
A.硅酸钠溶液可用作木材防火剂 B铝制容器可以贮运稀硝酸
C.过氧化钠可作潜水艇的供氧剂 D.氯气可用于制造漂白粉
10.锌是人体不可缺少的微量元素之一。下列关于6530Zn的说法正确的是
A.质子数为30 B.中子数为30 C.核外电子数为35 D.质量数为65
11.下列物质之间的转化,不能一步完成的是
A.Na2O→NaOH B.SO3→H2SO4 C.SiO2→H2SiO3 D.Na2CO3→NaHCO3
12.下列离子方程式书写正确的是
13.在pH=1的澄清透明溶液中,能大量共存的离子组是
A.Na+、HCO3 、Cl— B. K+、SO42-、OH- C. Cu2+、Na+、SO42- D.NH4+、、Al3+、CO32-
14.关于化学反应中能量变化的说法不符合事实的是 ( )
A.化学键断裂吸收能量,化学键生成放出能量 B化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应 D.右图所示的反应为放热反应
15.下列有机反应中,有一种反应类型与其他三种反应类型不同的是
16.下列各图所示的实验原理、方法、装置和操作正确的是
17.工业上利用反应:3C12+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A.该反应中C12是氧化剂 B.若管道漏气遇氨会产生白烟
C.该反应生成1 mol N2,有6 mol电子发生转移 D.该反应中氨气发生还原反应
18.下列化学用语正确的是 ( )
19.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1 L I mol·L-1 CaCl2溶液中含有的氯离子数为2NA
B.锌从盐酸中置换出1 mol H2,电子转移数为NA
C.常温常压下,11.2 L氧气含有的原子数为NA
D.4.4 g二氧化碳含有的原子数为0.1NA
20.下列有机物互为同分异构体的是
A.正丁烷和异丁烷 B.淀粉和纤维素 C.乙烯和聚乙烯 D.乙酸和乙醇
21.右图为铜一铁一稀硫酸构成的原电池示意图,下列说法错误的是 ( )
A.铁片为负极,且铁片逐渐溶解 B.铜片为正极,且铜片上有气泡
C.电子由铜片通过导线流向铁片 D. 该装置能将化学能转变为电能
22.X、Y、Z是元素周期表中相邻的三种短周期元素,它们的原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物。下列叙述正确的是
A.Z是第二周期ⅣA族元素 B.最高价氧化物对应水化物的酸性:Y>X
C.非金属性:X>Y>Z D.X、Y、Z的氢化物稳定性逐渐减弱
23.在硫酸铝、硫酸和硫酸镁的混合溶液200 mL中,c(SO42-)=0.80mol·L-1,当加入等体积1.6 mol·L-1KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得到白色沉淀2.32 g。则反应前的混合溶液中c(A13+)可能是 ( )
A.0.20 mol·L-1 B.0.40 mol·L-1 C.0.80 mol·L-1 D. 1.20 mol·L-1
二、非选择题(本部分3题,共31分)
24.(15分)
(1)(3分)关注营养平衡_'认识人体必需的重要营养物质。
①糖类是生命的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是 。
A.糖类 B.油脂 C.蛋白质
②碘缺乏会使人智力低下,配制加碘盐时,一般往食盐中加入微量的 。
A.KI B.I2 C.KIO3
③人体牙龈出血、患坏血病;主要是缺乏 。
A.维生素A B.维生素B C.维生素C
(2)(5分)合理选择饮食,正确使用药物,促进身心健康。
①选择食物要注意食物的酸碱性和营养搭配。
蔬菜、水果一般属于 (填“酸”或“碱”)性食物。
②阿司匹林()是常用的 药。它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为 。
③复方氢氧化铝可治疗胃酸过多,写出氢氧化铝与胃酸(HCl)反应的离子方程式: 。
(3)(7分)2014年的青奥会,古都南京将以优美的环境迎来四海宾客。
①控制粉尘污染和汽车尾气,让天空更蓝。燃煤气化有助于控制大气中PM2.5的含量,写出灼热的焦炭与水蒸气反应的化学方程式: 。汽车必须使用无铅汽油,其原因是 。
②治理污水,让河流更清。治理含汞废水可用沉淀法,往废液中加入适量的硫化钠溶液可将汞离子(Hg2+)转化成 (写化学式)沉淀出来。
③玻璃和不锈钢是青奥会场馆建设中大量使用的功能性和装饰性材料。在玻璃制造中,碳酸钠与二 氧化硅发生反应的化学方程式是 。制玻璃和水泥的共同原料是 (写名称或化学式)。
25.(6分)下图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色。F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色。图中的部分反应产物或反应物已略去。
(1)写出G的化学式: 。
(2)写出F的电子式: 。
(3) 写出D单质和E溶液反应的离子方程式: 。
(4)写出电解B溶液的化学方程式: 。
26.(10分)黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
【实验一】测定硫元素的含量。
I.将m1g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中主要发生反应的化学方程式为
4FeS2+11O2=Fe2O3+8SO2。
Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠)。
【实验二】测定铁元素的含量。
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+)。
问题讨论:
(1)图1装置中,甲瓶内所盛试剂是 溶液。
(2)图2流程中除了可以用H2O2溶液作为氧化剂,还可用 (填序号)为氧化剂。
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 (用含字母的式子表示)。
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式: 。
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分)。
2013年南京市学业水平第一次模拟考试
化学参考答案及评分标准
一、单项选择题(本部分23题,每题3分,共69分)
1.D 2.A 3.B 4.D 5.C 6.C 7.A 8.D 9.B 10.A 1 1.C 12.D 13.C 14.D 15.B 16.C
17.D 18.C 19.A 20.A 21.C 22.B 23.A
二、非选择题(本部分3题,共3 1分)
24.(1 5分)
(1) ①B(1分) ②C(1分) ③C(1分)
(2)①碱(1分) ②解热镇痛(1分)
③Al(OH)3+3H+=Al3++3H2O(2分)
(3) ① 铅有污染(1分)
. ②HgS(1分)
③ (2分) 石灰石(CaCO3)(1分)
25.
注意事项:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必将自己的学校、班级、姓名填写在密封线内。
可能用到的相对原子质量:
H一1 C一12 N一14 O—16 Mg一24 Al一27 S一32 Fe一56 Ba一137
一、单项选择题(本部分23题,每题3分,共69分。每题只有一个选项符合题意)
1.于谦的《石灰吟》,借石灰石(碳酸钙)表现了作者“粉身碎骨浑不怕,要留清白在人间”的人格精神。碳酸钙属于 ( )
A.单质 B.氧化物 C.酸 D.盐
2.某些液体用肉眼难以区分是胶体还是溶液。区分胶体和溶液的实验方法可行的是 ( )
A.一束光照射 B加热至沸 C.静置沉降 D.过滤
3.下列溶液中滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是 ( )
A.氯化钡 B.氢氧化钡 C.碳酸钠 D.氢氧化钾
4.下列物质水解的最终产物中含有葡萄糖的是 ( )
A.蛋白质 B氨基酸 C.油脂 D.蔗糖
5.下列物质属于共价化合物的是 ( )
A.KOH B.MgO C.C2H6 D.C60
6.下列实验中溶液变为红色的是 ( )
A.紫色石蕊溶液中滴加氨水 B.品红溶液中滴加饱和二氧化硫溶液
C.硫氰化钾溶液中滴加氯化铁溶液 D.把铜片投入到浓硝酸中
7.关于化学键的叙述中正确的是 ( )
A.Na2O2中含有共价键 B.H2中不含共价键
C.NH4 Cl中只含离子键 D.CaCl2中既含离子键又含共价键
8.实验室用98%的浓硫酸(密度为1.84 g·mL-1)配制500 mL0.5 mol·L-1的稀硫酸。已选用的主要仪器有烧杯、胶头滴管、玻璃棒,还缺少的仪器是 ( )
A.容量瓶、13.6 mL量筒 B.容量瓶、100 mlL量筒
C.500 mL容量瓶、100 mL量筒 D .500 mL容量瓶、25 mL量筒
9.对下列物质用途的描述不符合事实的是
A.硅酸钠溶液可用作木材防火剂 B铝制容器可以贮运稀硝酸
C.过氧化钠可作潜水艇的供氧剂 D.氯气可用于制造漂白粉
10.锌是人体不可缺少的微量元素之一。下列关于6530Zn的说法正确的是
A.质子数为30 B.中子数为30 C.核外电子数为35 D.质量数为65
11.下列物质之间的转化,不能一步完成的是
A.Na2O→NaOH B.SO3→H2SO4 C.SiO2→H2SiO3 D.Na2CO3→NaHCO3
12.下列离子方程式书写正确的是
13.在pH=1的澄清透明溶液中,能大量共存的离子组是
A.Na+、HCO3、Cl— B. K+、SO42-、OH- C. Cu2+、Na+、SO42- D.NH4+、、Al3+、CO32-
14.关于化学反应中能量变化的说法不符合事实的是 ( )
A.化学键断裂吸收能量,化学键生成放出能量 B化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应 D.右图所示的反应为放热反应
15.下列有机反应中,有一种反应类型与其他三种反应类型不同的是
16.下列各图所示的实验原理、方法、装置和操作正确的是
17.工业上利用反应:3C12+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A.该反应中C12是氧化剂 B.若管道漏气遇氨会产生白烟
C.该反应生成1 mol N2,有6 mol电子发生转移 D.该反应中氨气发生还原反应
18.下列化学用语正确的是 ( )
19.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1 L I mol·L-1 CaCl2溶液中含有的氯离子数为2NA
B.锌从盐酸中置换出1 mol H2,电子转移数为NA
C.常温常压下,11.2 L氧气含有的原子数为NA
D.4.4 g二氧化碳含有的原子数为0.1NA
20.下列有机物互为同分异构体的是
A.正丁烷和异丁烷 B.淀粉和纤维素 C.乙烯和聚乙烯 D.乙酸和乙醇
21.右图为铜一铁一稀硫酸构成的原电池示意图,下列说法错误的是 ( )
A.铁片为负极,且铁片逐渐溶解 B.铜片为正极,且铜片上有气泡
C.电子由铜片通过导线流向铁片 D. 该装置能将化学能转变为电能
22.X、Y、Z是元素周期表中相邻的三种短周期元素,它们的原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物。下列叙述正确的是
A.Z是第二周期ⅣA族元素 B.最高价氧化物对应水化物的酸性:Y>X
C.非金属性:X>Y>Z D.X、Y、Z的氢化物稳定性逐渐减弱
23.在硫酸铝、硫酸和硫酸镁的混合溶液200 mL中,c(SO42-)=0.80mol·L-1,当加入等体积1.6 mol·L-1KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得到白色沉淀2.32 g。则反应前的混合溶液中c(A13+)可能是 ( )
A.0.20 mol·L-1 B.0.40 mol·L-1 C.0.80 mol·L-1 D. 1.20 mol·L-1
二、非选择题(本部分3题,共31分)
24.(15分)
(1)(3分)关注营养平衡_'认识人体必需的重要营养物质。
①糖类是生命的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是 。
A.糖类 B.油脂 C.蛋白质
②碘缺乏会使人智力低下,配制加碘盐时,一般往食盐中加入微量的 。
A.KI B.I2 C.KIO3
③人体牙龈出血、患坏血病;主要是缺乏 。
A.维生素A B.维生素B C.维生素C
(2)(5分)合理选择饮食,正确使用药物,促进身心健康。
①选择食物要注意食物的酸碱性和营养搭配。
蔬菜、水果一般属于 (填“酸”或“碱”)性食物。
②阿司匹林()是常用的 药。它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为 。
③复方氢氧化铝可治疗胃酸过多,写出氢氧化铝与胃酸(HCl)反应的离子方程式: 。
(3)(7分)2014年的青奥会,古都南京将以优美的环境迎来四海宾客。
①控制粉尘污染和汽车尾气,让天空更蓝。燃煤气化有助于控制大气中PM2.5的含量,写出灼热的焦炭与水蒸气反应的化学方程式: 。汽车必须使用无铅汽油,其原因是 。
②治理污水,让河流更清。治理含汞废水可用沉淀法,往废液中加入适量的硫化钠溶液可将汞离子(Hg2+)转化成 (写化学式)沉淀出来。
③玻璃和不锈钢是青奥会场馆建设中大量使用的功能性和装饰性材料。在玻璃制造中,碳酸钠与二 氧化硅发生反应的化学方程式是 。制玻璃和水泥的共同原料是 (写名称或化学式)。
25.(6分)下图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色。F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色。图中的部分反应产物或反应物已略去。
(1)写出G的化学式: 。
(2)写出F的电子式: 。
(3) 写出D单质和E溶液反应的离子方程式: 。
(4)写出电解B溶液的化学方程式: 。
26.(10分)黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
【实验一】测定硫元素的含量。
I.将m1g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中主要发生反应的化学方程式为
4FeS2+11O2=Fe2O3+8SO2。
Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠)。
【实验二】测定铁元素的含量。
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+)。
问题讨论:
(1)图1装置中,甲瓶内所盛试剂是 溶液。
(2)图2流程中除了可以用H2O2溶液作为氧化剂,还可用 (填序号)为氧化剂。
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 (用含字母的式子表示)。
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式: 。
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分)。
2013年南京市学业水平第一次模拟考试
化学参考答案及评分标准
一、单项选择题(本部分23题,每题3分,共69分)
1.D 2.A 3.B 4.D 5.C 6.C 7.A 8.D 9.B 10.A 1 1.C 12.D 13.C 14.D 15.B 16.C
17.D 18.C 19.A 20.A 21.C 22.B 23.A
二、非选择题(本部分3题,共3 1分)
24.(1 5分)
(1) ①B(1分) ②C(1分) ③C(1分)
(2)①碱(1分) ②解热镇痛(1分)
③Al(OH)3+3H+=Al3++3H2O(2分)
(3) ① 铅有污染(1分)
. ②HgS(1分)
③ (2分) 石灰石(CaCO3)(1分)
25.
江苏省南京市2012-2013学年高三学业水平第一次模拟考试化学试题
注意事项:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必将自己的学校、班级、姓名填写在密封线内。
可能用到的相对原子质量:
H一1 C一12 N一14 O—16 Mg一24 Al一27 S一32 Fe一56 Ba一137
一、单项选择题(本部分23题,每题3分,共69分。每题只有一个选项符合题意)
1.于谦的《石灰吟》,借石灰石(碳酸钙)表现了作者“粉身碎骨浑不怕,要留清白在人间”的人格精神。碳酸钙属于 ( )
A.单质 B.氧化物 C.酸 D.盐
2.某些液体用肉眼难以区分是胶体还是溶液。区分胶体和溶液的实验方法可行的是 ( )
A.一束光照射 B加热至沸 C.静置沉降 D.过滤
3.下列溶液中滴加稀硫酸或氯化镁溶液时,均有白色沉淀生成的是 ( )
A.氯化钡 B.氢氧化钡 C.碳酸钠 D.氢氧化钾
4.下列物质水解的最终产物中含有葡萄糖的是 ( )
A.蛋白质 B氨基酸 C.油脂 D.蔗糖
5.下列物质属于共价化合物的是 ( )
A.KOH B.MgO C.C2H6 D.C60
6.下列实验中溶液变为红色的是 ( )
A.紫色石蕊溶液中滴加氨水 B.品红溶液中滴加饱和二氧化硫溶液
C.硫氰化钾溶液中滴加氯化铁溶液 D.把铜片投入到浓硝酸中
7.关于化学键的叙述中正确的是 ( )
A.Na2O2中含有共价键 B.H2中不含共价键
C.NH4 Cl中只含离子键 D.CaCl2中既含离子键又含共价键
8.实验室用98%的浓硫酸(密度为1.84 g·mL-1)配制500 mL0.5 mol·L-1的稀硫酸。已选用的主要仪器有烧杯、胶头滴管、玻璃棒,还缺少的仪器是 ( )
A.容量瓶、13.6 mL量筒 B.容量瓶、100 mlL量筒
C.500 mL容量瓶、100 mL量筒 D .500 mL容量瓶、25 mL量筒
9.对下列物质用途的描述不符合事实的是
A.硅酸钠溶液可用作木材防火剂 B铝制容器可以贮运稀硝酸
C.过氧化钠可作潜水艇的供氧剂 D.氯气可用于制造漂白粉
10.锌是人体不可缺少的微量元素之一。下列关于6530Zn的说法正确的是
A.质子数为30 B.中子数为30 C.核外电子数为35 D.质量数为65
11.下列物质之间的转化,不能一步完成的是
A.Na2O→NaOH B.SO3→H2SO4 C.SiO2→H2SiO3 D.Na2CO3→NaHCO3
12.下列离子方程式书写正确的是
13.在pH=1的澄清透明溶液中,能大量共存的离子组是
A.Na+、HCO3 、Cl— B. K+、SO42-、OH- C. Cu2+、Na+、SO42- D.NH4+、、Al3+、CO32-
14.关于化学反应中能量变化的说法不符合事实的是 ( )
A.化学键断裂吸收能量,化学键生成放出能量 B化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应 D.右图所示的反应为放热反应
15.下列有机反应中,有一种反应类型与其他三种反应类型不同的是
16.下列各图所示的实验原理、方法、装置和操作正确的是
17.工业上利用反应:3C12+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 ( )
A.该反应中C12是氧化剂 B.若管道漏气遇氨会产生白烟
C.该反应生成1 mol N2,有6 mol电子发生转移 D.该反应中氨气发生还原反应
18.下列化学用语正确的是 ( )
19.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1 L I mol·L-1 CaCl2溶液中含有的氯离子数为2NA
B.锌从盐酸中置换出1 mol H2,电子转移数为NA
C.常温常压下,11.2 L氧气含有的原子数为NA
D.4.4 g二氧化碳含有的原子数为0.1NA
20.下列有机物互为同分异构体的是
A.正丁烷和异丁烷 B.淀粉和纤维素 C.乙烯和聚乙烯 D.乙酸和乙醇
21.右图为铜一铁一稀硫酸构成的原电池示意图,下列说法错误的是 ( )
A.铁片为负极,且铁片逐渐溶解 B.铜片为正极,且铜片上有气泡
C.电子由铜片通过导线流向铁片 D. 该装置能将化学能转变为电能
22.X、Y、Z是元素周期表中相邻的三种短周期元素,它们的原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物。下列叙述正确的是
A.Z是第二周期ⅣA族元素 B.最高价氧化物对应水化物的酸性:Y>X
C.非金属性:X>Y>Z D.X、Y、Z的氢化物稳定性逐渐减弱
23.在硫酸铝、硫酸和硫酸镁的混合溶液200 mL中,c(SO42-)=0.80mol·L-1,当加入等体积1.6 mol·L-1KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得到白色沉淀2.32 g。则反应前的混合溶液中c(A13+)可能是 ( )
A.0.20 mol·L-1 B.0.40 mol·L-1 C.0.80 mol·L-1 D. 1.20 mol·L-1
二、非选择题(本部分3题,共31分)
24.(15分)
(1)(3分)关注营养平衡_'认识人体必需的重要营养物质。
①糖类是生命的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是 。
A.糖类 B.油脂 C.蛋白质
②碘缺乏会使人智力低下,配制加碘盐时,一般往食盐中加入微量的 。
A.KI B.I2 C.KIO3
③人体牙龈出血、患坏血病;主要是缺乏 。
A.维生素A B.维生素B C.维生素C
(2)(5分)合理选择饮食,正确使用药物,促进身心健康。
①选择食物要注意食物的酸碱性和营养搭配。
蔬菜、水果一般属于 (填“酸”或“碱”)性食物。
②阿司匹林()是常用的 药。它遇水会缓慢地水解生成水杨酸,则水杨酸的结构简式可表示为 。
③复方氢氧化铝可治疗胃酸过多,写出氢氧化铝与胃酸(HCl)反应的离子方程式: 。
(3)(7分)2014年的青奥会,古都南京将以优美的环境迎来四海宾客。
①控制粉尘污染和汽车尾气,让天空更蓝。燃煤气化有助于控制大气中PM2.5的含量,写出灼热的焦炭与水蒸气反应的化学方程式: 。汽车必须使用无铅汽油,其原因是 。
②治理污水,让河流更清。治理含汞废水可用沉淀法,往废液中加入适量的硫化钠溶液可将汞离子(Hg2+)转化成 (写化学式)沉淀出来。
③玻璃和不锈钢是青奥会场馆建设中大量使用的功能性和装饰性材料。在玻璃制造中,碳酸钠与二 氧化硅发生反应的化学方程式是 。制玻璃和水泥的共同原料是 (写名称或化学式)。
25.(6分)下图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色。F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色。图中的部分反应产物或反应物已略去。
(1)写出G的化学式: 。
(2)写出F的电子式: 。
(3) 写出D单质和E溶液反应的离子方程式: 。
(4)写出电解B溶液的化学方程式: 。
26.(10分)黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究:
【实验一】测定硫元素的含量。
I.将m1g黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,往甲瓶中不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中主要发生反应的化学方程式为
4FeS2+11O2=Fe2O3+8SO2。
Ⅱ.反应结束后,将乙瓶中的溶液按图2的流程进行处理(H2O2可以氧化亚硫酸钠)。
【实验二】测定铁元素的含量。
Ⅲ.测定铁元素含量的实验步骤如图3所示(假设其他金属元素不影响铁元素的测定;MnO4-在酸性条件下可将Fe2+氧化成Fe3+,并被还原为Mn2+)。
问题讨论:
(1)图1装置中,甲瓶内所盛试剂是 溶液。
(2)图2流程中除了可以用H2O2溶液作为氧化剂,还可用 (填序号)为氧化剂。
①氯水 ②浓硫酸 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 (用含字母的式子表示)。
(4)写出在酸性溶液中,KMnO4与Fe2+反应的离子方程式: 。
(5)列式计算黄铁矿样品中铁元素的质量(没有计算过程;计算结果正确也不给分)。
2013年南京市学业水平第一次模拟考试
化学参考答案及评分标准
一、单项选择题(本部分23题,每题3分,共69分)
1.D 2.A 3.B 4.D 5.C 6.C 7.A 8.D 9.B 10.A 1 1.C 12.D 13.C 14.D 15.B 16.C
17.D 18.C 19.A 20.A 21.C 22.B 23.A
二、非选择题(本部分3题,共3 1分)
24.(1 5分)
(1) ①B(1分) ②C(1分) ③C(1分)
(2)①碱(1分) ②解热镇痛(1分)
③Al(OH)3+3H+=Al3++3H2O(2分)
(3) ① 铅有污染(1分)
. ②HgS(1分)
③ (2分) 石灰石(CaCO3)(1分)
25.
同课章节目录
