6.1.2 化学反应的限度 课件(56张PPT)
文档属性
| 名称 | 6.1.2 化学反应的限度 课件(56张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-16 23:59:51 | ||
图片预览










文档简介
(共56张PPT)
专题6 化学反应与能量变化
第一单元 化学反应速率与反应限度
第2课时 化学反应的限度
学习目标
1.了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡。
2.初步学会根据反应速率判断化学反应所能达到的限度及化学反应限度的建立。
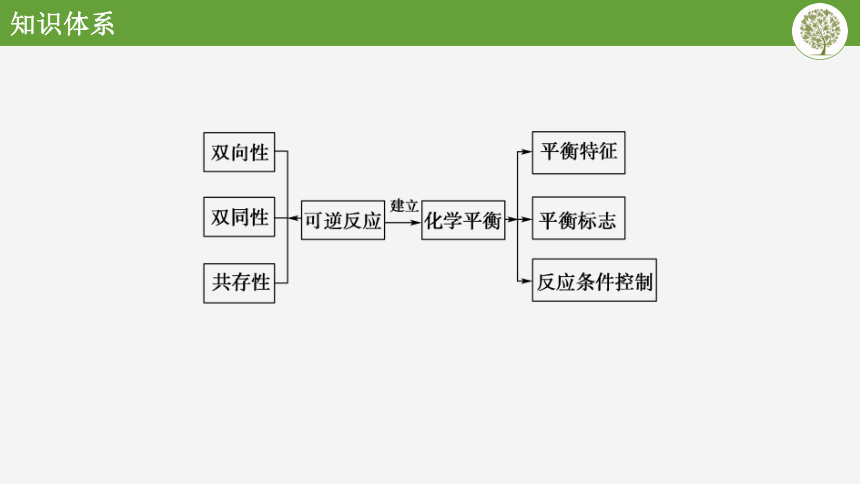
知识体系
正反应
逆反应
进行到底
同时存在
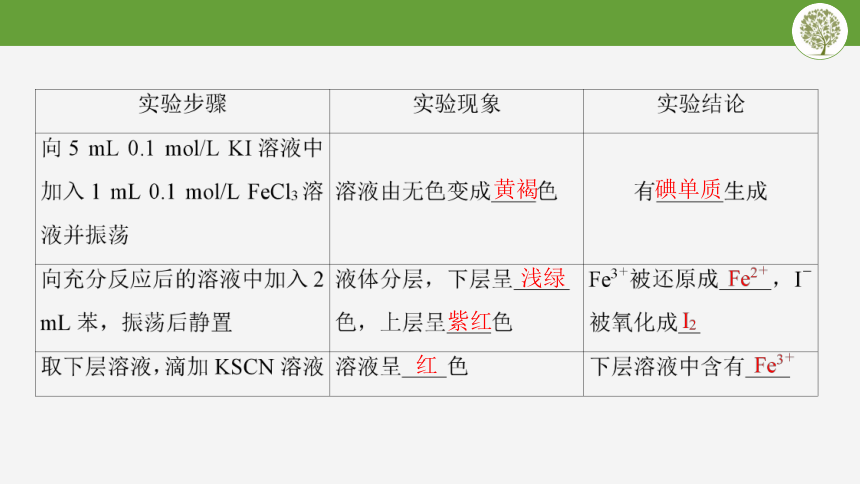
知识梳理
黄褐
碘单质
浅绿
紫红
红
限度
不能完全
最大
反应物浓度最大
0
生成物浓度为0
逐渐减小
反应物浓度逐渐减小
逐渐增大
生成物浓度逐渐增大
大小相等
不再改变
不再改变
温度
浓度
压强
可逆
正反应速率
逆反应速率
浓度
浓度
=
≠
动态
保持不变
化学平衡的移动
反应物的化学性质
温度
浓度
压强
化学反应的限度
×
×
×
√
B
一、化学平衡状态的标志
能力提升
【答案】D
【答案】A
[反思总结]
二、利用“三段式法”对化学反应速率、化学平衡进行简单计算
C
当堂检测
C
D
C
D
本节内容结束
双向性
平衡特征
建立
双同性
可逆反应
化学平衡斗
平衡标志
共存性
反应条件控制
0
I
U正!v正=v逆
V逆}
0
ti
老
逆
化学平衡状态研究的对象是可逆反应
等
平衡时v正_v逆_0(本质)
动
平衡时,反应仍在不断进行,是一种平衡
定
平衡时,反应混合物各组分的百分含量
变
外界条件改变时,平衡可能被破坏,并在新的条
件下建立新的化学平衡,即发生
国
专题6 化学反应与能量变化
第一单元 化学反应速率与反应限度
第2课时 化学反应的限度
学习目标
1.了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡。
2.初步学会根据反应速率判断化学反应所能达到的限度及化学反应限度的建立。
知识体系
正反应
逆反应
进行到底
同时存在
知识梳理
黄褐
碘单质
浅绿
紫红
红
限度
不能完全
最大
反应物浓度最大
0
生成物浓度为0
逐渐减小
反应物浓度逐渐减小
逐渐增大
生成物浓度逐渐增大
大小相等
不再改变
不再改变
温度
浓度
压强
可逆
正反应速率
逆反应速率
浓度
浓度
=
≠
动态
保持不变
化学平衡的移动
反应物的化学性质
温度
浓度
压强
化学反应的限度
×
×
×
√
B
一、化学平衡状态的标志
能力提升
【答案】D
【答案】A
[反思总结]
二、利用“三段式法”对化学反应速率、化学平衡进行简单计算
C
当堂检测
C
D
C
D
本节内容结束
双向性
平衡特征
建立
双同性
可逆反应
化学平衡斗
平衡标志
共存性
反应条件控制
0
I
U正!v正=v逆
V逆}
0
ti
老
逆
化学平衡状态研究的对象是可逆反应
等
平衡时v正_v逆_0(本质)
动
平衡时,反应仍在不断进行,是一种平衡
定
平衡时,反应混合物各组分的百分含量
变
外界条件改变时,平衡可能被破坏,并在新的条
件下建立新的化学平衡,即发生
国
