9.2.2 反应条件的控制 课件(16张PPT)
文档属性
| 名称 | 9.2.2 反应条件的控制 课件(16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 879.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-17 00:09:30 | ||
图片预览





文档简介
(共16张PPT)
第2课时 反应条件的控制
第二单元 探究铁及其化合物的转化
专题9 金属与人类文明
1.了解Fe(OH)2的制备方法及转化。
2.能通过Fe(OH)2在不同条件下的制备,知道反应条件的控制对化学反应的影响。
学习目标
反应条件的控制
Fe(OH)2的制备实验探究。
新知导学
实验内容 实验现象 结论(用离子方程式或化学方程式表示)
先观察到有 生成,迅速变成 色,最后变成 色 ,
。
白色絮状沉淀
灰绿
红褐
Fe2++2OH-══Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
实验内容 实验现象 结论(用离子方程式或化学方程式表示)
观察到有 生成且不消失 。
白色絮状沉淀
Fe2++2OH-══Fe(OH)2↓
探究 Fe(OH)2的制备实验探究
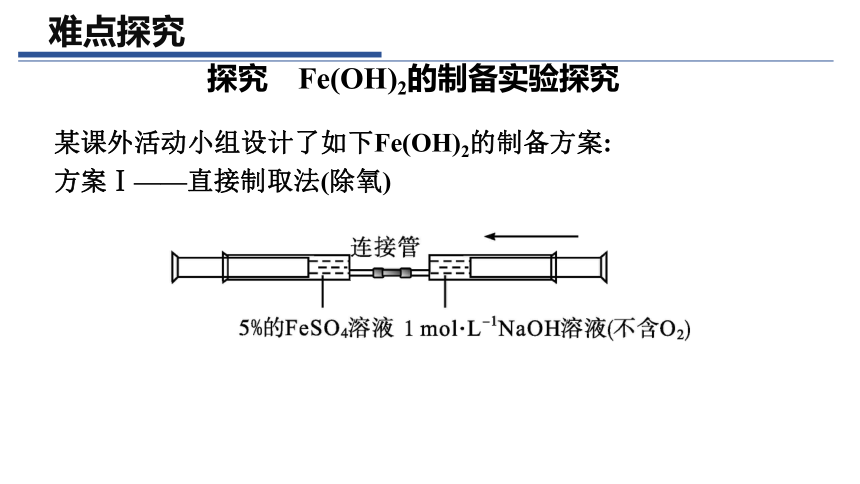
某课外活动小组设计了如下Fe(OH)2的制备方案:
方案Ⅰ——直接制取法(除氧)
难点探究
(1)将右边注射器中的NaOH溶液推入左边注射器,可观察到什么现象
(2)若拔去连接管,向有白色沉淀的注射器里抽入空气,振荡,又观察到什么现象
提示:(1)有白色絮状沉淀生成。
(2)白色沉淀迅速转变为灰绿色,最后变为红褐色。
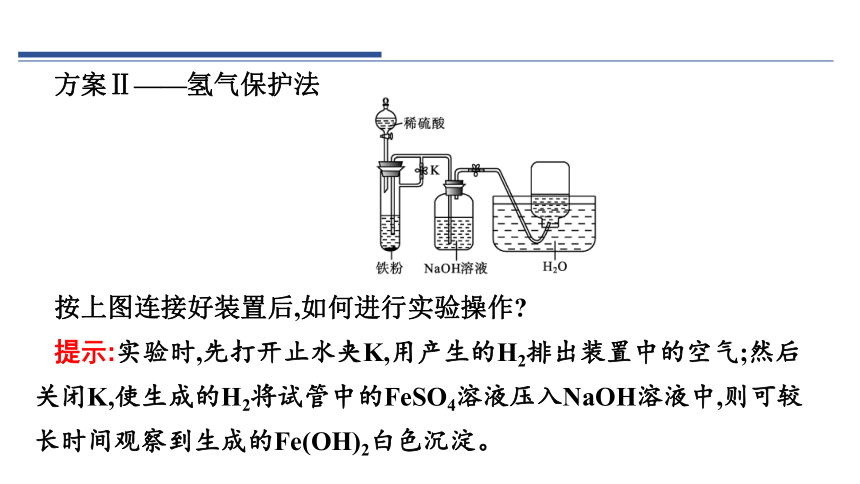
方案Ⅱ——氢气保护法
按上图连接好装置后,如何进行实验操作
提示:实验时,先打开止水夹K,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可较长时间观察到生成的Fe(OH)2白色沉淀。
归纳提升
1.Fe(OH)2的制备。
试剂:FeSO4与NaOH溶液。
原理:Fe2++2OH-══Fe(OH)2↓。
实验注意事项:Fe(OH)2具有较强的还原性,在空气中易被O2氧化,故制备Fe(OH)2时注意避免与O2的接触。
制备Fe(OH)2的措施:
(1)Fe2+必须是新制的,并放入Fe粉,以防Fe2+被氧化成Fe3+。
(2)除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液。
(3)长胶头滴管末端插入试管内的液面以下。
(4)在FeSO4溶液液面上加植物油或苯进行液封。
(5)在容器内充满H2等气体,保证无O2环境。如下图。
2.Fe(OH)2、Fe(OH)3的比较。
典型例题
【例题】 下列三个实验中能较长时间看到Fe(OH)2白色沉淀的是( )。
A.①② B.①③ C.②③ D.①②③
答案:B
解析:因为Fe(OH)2在空气中易被氧化成Fe(OH)3,故要长时间观察到Fe(OH)2白色沉淀,就要排除装置中的空气或氧气。装置①是先用H2将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③中液面上加苯阻止了空气进入;②由于能接触到空气中的O2,故不能较长时间观察到白色沉淀,故选B。
【变式训练】 下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )。
A.可利用如图所示装置,制备氢氧化亚铁
B.氢氧化亚铁为灰绿色絮状沉淀
C.氢氧化亚铁易被空气氧化
D.制备实验中,氢氧化钠溶液应预先煮沸
答案:B
解析:氢氧化亚铁易被氧气氧化,把胶头滴管伸入硫酸亚铁溶液中,滴加氢氧化钠溶液,可以防止氢氧化亚铁被氧化,所以可利用A项中的装置制备氢氧化亚铁,A正确;氢氧化亚铁为白色絮状沉淀,B错误;氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,C正确;加热煮沸可以除去氢氧化钠溶液中的氧气,所以制备氢氧化亚铁时,氢氧化钠溶液应预先煮沸,D正确。
归纳总结
化学反应都是在一定条件下发生的。反应条件对化学反应的方向、速率和限度都会有不同程度的影响。在研究物质的性质和制备时,应依据化学反应的规律和反应物、生成物的特点,合理选择并控制好反应条件,才能达到预期的结果。
本节内容结束
第2课时 反应条件的控制
第二单元 探究铁及其化合物的转化
专题9 金属与人类文明
1.了解Fe(OH)2的制备方法及转化。
2.能通过Fe(OH)2在不同条件下的制备,知道反应条件的控制对化学反应的影响。
学习目标
反应条件的控制
Fe(OH)2的制备实验探究。
新知导学
实验内容 实验现象 结论(用离子方程式或化学方程式表示)
先观察到有 生成,迅速变成 色,最后变成 色 ,
。
白色絮状沉淀
灰绿
红褐
Fe2++2OH-══Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
实验内容 实验现象 结论(用离子方程式或化学方程式表示)
观察到有 生成且不消失 。
白色絮状沉淀
Fe2++2OH-══Fe(OH)2↓
探究 Fe(OH)2的制备实验探究
某课外活动小组设计了如下Fe(OH)2的制备方案:
方案Ⅰ——直接制取法(除氧)
难点探究
(1)将右边注射器中的NaOH溶液推入左边注射器,可观察到什么现象
(2)若拔去连接管,向有白色沉淀的注射器里抽入空气,振荡,又观察到什么现象
提示:(1)有白色絮状沉淀生成。
(2)白色沉淀迅速转变为灰绿色,最后变为红褐色。
方案Ⅱ——氢气保护法
按上图连接好装置后,如何进行实验操作
提示:实验时,先打开止水夹K,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可较长时间观察到生成的Fe(OH)2白色沉淀。
归纳提升
1.Fe(OH)2的制备。
试剂:FeSO4与NaOH溶液。
原理:Fe2++2OH-══Fe(OH)2↓。
实验注意事项:Fe(OH)2具有较强的还原性,在空气中易被O2氧化,故制备Fe(OH)2时注意避免与O2的接触。
制备Fe(OH)2的措施:
(1)Fe2+必须是新制的,并放入Fe粉,以防Fe2+被氧化成Fe3+。
(2)除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液。
(3)长胶头滴管末端插入试管内的液面以下。
(4)在FeSO4溶液液面上加植物油或苯进行液封。
(5)在容器内充满H2等气体,保证无O2环境。如下图。
2.Fe(OH)2、Fe(OH)3的比较。
典型例题
【例题】 下列三个实验中能较长时间看到Fe(OH)2白色沉淀的是( )。
A.①② B.①③ C.②③ D.①②③
答案:B
解析:因为Fe(OH)2在空气中易被氧化成Fe(OH)3,故要长时间观察到Fe(OH)2白色沉淀,就要排除装置中的空气或氧气。装置①是先用H2将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③中液面上加苯阻止了空气进入;②由于能接触到空气中的O2,故不能较长时间观察到白色沉淀,故选B。
【变式训练】 下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )。
A.可利用如图所示装置,制备氢氧化亚铁
B.氢氧化亚铁为灰绿色絮状沉淀
C.氢氧化亚铁易被空气氧化
D.制备实验中,氢氧化钠溶液应预先煮沸
答案:B
解析:氢氧化亚铁易被氧气氧化,把胶头滴管伸入硫酸亚铁溶液中,滴加氢氧化钠溶液,可以防止氢氧化亚铁被氧化,所以可利用A项中的装置制备氢氧化亚铁,A正确;氢氧化亚铁为白色絮状沉淀,B错误;氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,C正确;加热煮沸可以除去氢氧化钠溶液中的氧气,所以制备氢氧化亚铁时,氢氧化钠溶液应预先煮沸,D正确。
归纳总结
化学反应都是在一定条件下发生的。反应条件对化学反应的方向、速率和限度都会有不同程度的影响。在研究物质的性质和制备时,应依据化学反应的规律和反应物、生成物的特点,合理选择并控制好反应条件,才能达到预期的结果。
本节内容结束
