2021-2022学年高一下学期化学人教版(2019)必修第二册5.1硫及其化合物 第二课时 教学设计
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册5.1硫及其化合物 第二课时 教学设计 |

|
|
| 格式 | doc | ||
| 文件大小 | 871.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-17 18:44:59 | ||
图片预览



文档简介
人教版高中化学必修第二册5.1硫及其化合物
第二课时教学设计
教学目标
1.能从物质类别和元素的化合价的角度认识硫酸的性质,促进“证据推理与模型认知”化学核心素养的发展。
2.通过实验探究浓硫酸的吸水性、脱水性和强氧化性,强化“科学探究与创新意识”
教学重难点
重点 浓硫酸的三大特性
难点 浓硫酸的三大特性
教学方法
1.实验探究法,以实验为导向,通过观察实验现象,思考分析,得出结论,使学生在自己已有的知识基础上,通过对新的实验现象的分析、思考,建构起新的知识体系。
2.对比分析法(对比浓硫酸和稀硫酸的性质差异)
教学流程
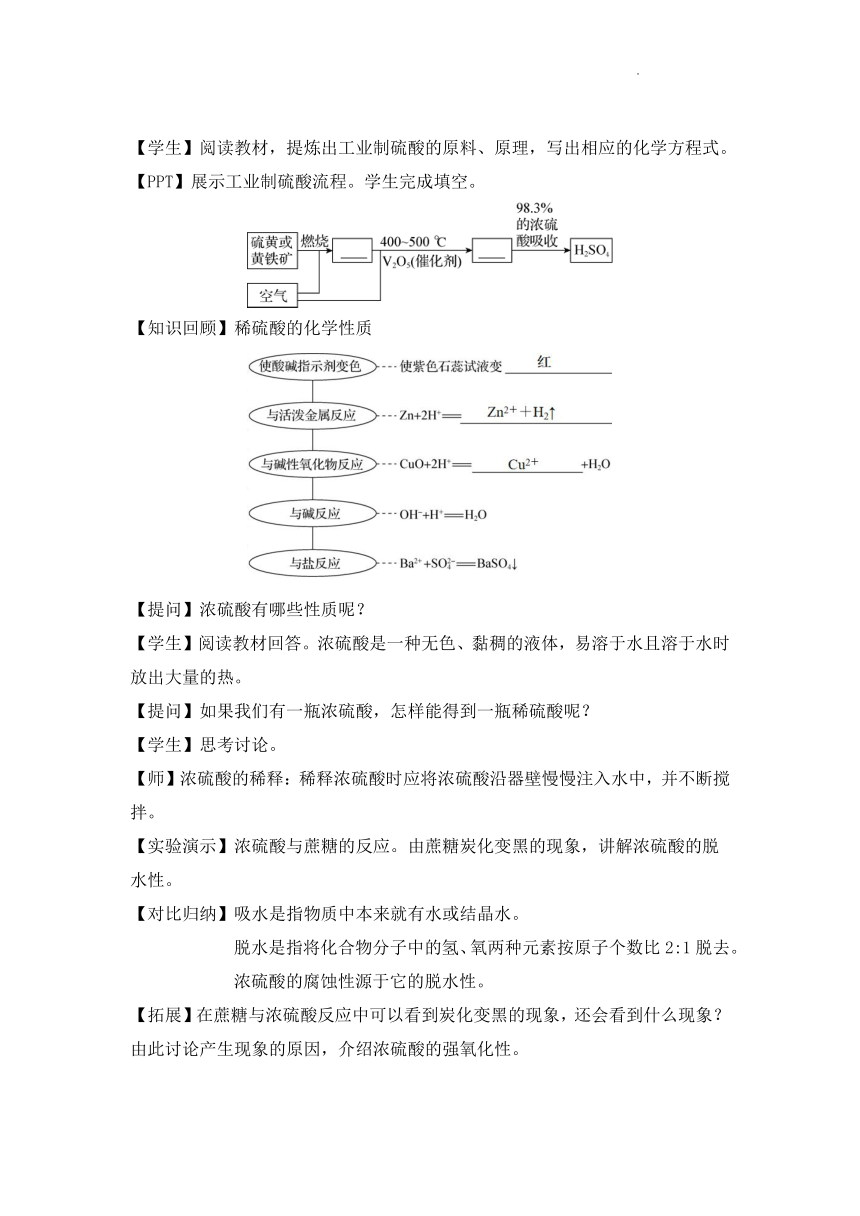
【学生】阅读教材,提炼出工业制硫酸的原料、原理,写出相应的化学方程式。
【PPT】展示工业制硫酸流程。学生完成填空。
【知识回顾】稀硫酸的化学性质
【提问】浓硫酸有哪些性质呢?
【学生】阅读教材回答。浓硫酸是一种无色、黏稠的液体,易溶于水且溶于水时放出大量的热。
【提问】如果我们有一瓶浓硫酸,怎样能得到一瓶稀硫酸呢?
【学生】思考讨论。
【师】浓硫酸的稀释:稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
【实验演示】浓硫酸与蔗糖的反应。由蔗糖炭化变黑的现象,讲解浓硫酸的脱水性。
【对比归纳】吸水是指物质中本来就有水或结晶水。
脱水是指将化合物分子中的氢、氧两种元素按原子个数比2:1脱去。浓硫酸的腐蚀性源于它的脱水性。
【拓展】在蔗糖与浓硫酸反应中可以看到炭化变黑的现象,还会看到什么现象?由此讨论产生现象的原因,介绍浓硫酸的强氧化性。
【师】蔗糖遇浓硫酸炭化,生成黑色物质,体积膨胀为疏松多孔状,说明有气体产生。,浓硫酸表现出强氧化性。
【思考讨论】炭能与浓硫酸在加热条件下反应,那么金属呢?
【实验演示】浓硫酸与铜在加热条件下的反应
【实验分析与问题探讨】铜与浓硫酸反应需要什么条件?描述实验现象,根据实验现象推测反应生成物,分析试管Ⅱ口部棉花团的作用。
实验现象:
a试管中铜丝表面有气泡逸出;
b试管中的品红溶液逐渐变为无色;
c试管中的石蕊溶液逐渐变为红色;
将a试管里的溶液冷却后慢慢倒入水中,溶液变为蓝色。
反应原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
【讨论】1、实验中如何检验二氧化硫?如何防止污染?
浓硫酸的作用是什么?
当反应进行到一定程度,硫酸的浓度逐渐降低,反应是否会继续进行?
【总结】①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
【提问】所有金属单质与浓硫酸都能反应吗?
【学生】常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
【提问】浓硫酸能吸收存在于周围环境中的水分,因此能使蓝色胆矾(CuSO4·5H2O)变为白色粉末(CuSO4),故常用作干燥剂。浓硫酸不能用来干燥哪些气体?
【学生】思考讨论
【师】浓硫酸不能干燥碱性气体(如NH3等)和强还原性的气体(如H2S等)。但CO、H2等还原性气体不与浓硫酸反应,可以用浓硫酸干燥。
【拓展延伸】浓、稀硫酸的鉴别方法
讲与练
1.硫酸的工业制法
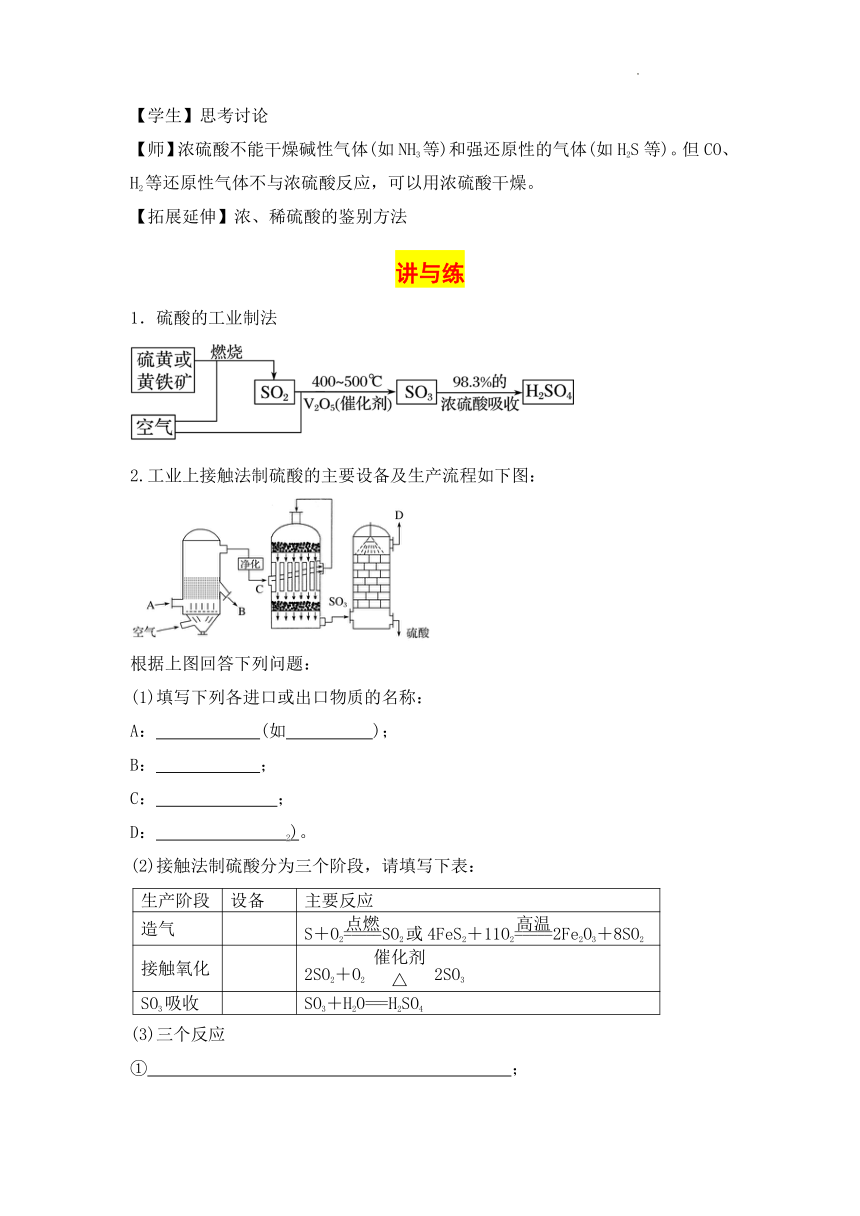
2.工业上接触法制硫酸的主要设备及生产流程如下图:
根据上图回答下列问题:
(1)填写下列各进口或出口物质的名称:
A: (如 );
B: ;
C: ;
D: 2)。
(2)接触法制硫酸分为三个阶段,请填写下表:
生产阶段 设备 主要反应
造气 S+O2SO2或4FeS2+11O22Fe2O3+8SO2
接触氧化 2SO2+O22SO3
SO3吸收 SO3+H2O===H2SO4
(3)三个反应
① ;
② ;
③ 。
答案:
(1)A:含硫矿石(如FeS2);
B:炉渣;
C:二氧化硫、氧气、氮气;
D:尾气(SO2、O2、N2)。
(2)接触法制硫酸分为三个阶段,请填写下表:
生产阶段 设备 主要反应
造气 沸腾炉 S+O2SO2或4FeS2+11O22Fe2O3+8SO2
接触氧化 接触室 2SO2+O22SO3
SO3吸收 吸收塔 SO3+H2O===H2SO4
(3)①4FeS2+11O22Fe2O3+8SO2或S+O2SO2;
②2SO2+O22SO3;
③SO3+H2O===H2SO4。
3.硫酸的酸的通性
H2SO4在水里很容易电离出 ,具有 ,能使紫色石蕊试液显 ,请写出下列反应的离子方程式。
①和活泼金属(如Fe): ;
②和金属氧化物(如MgO): ;
③和碱[如Mg(OH)2]: ;
④和盐(如Na2CO3): 。
4.浓硫酸的特性
浓硫酸有三大特性: 、 和 。
(1)吸水性与脱水性
①吸水性
浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作 。
②脱水性
浓硫酸能把有机物中的氢元素和氧元素按 脱去。如向蔗糖中加入浓硫酸时,蔗糖逐渐变黑,体积膨胀,形成 固体,并放出有 气味的气体。
(2)强氧化性
实验操作
实验现象 a试管中铜丝表面 ; b试管中的溶液 ; c试管中的 ; 将a试管里的溶液慢慢倒入水中, 色
实验结论 在反应中,浓硫酸是 ,铜是
答案:
1.H+,酸性,红色,
①Fe+2H+===Fe2++H2↑; ②MgO+2H+===Mg2++H2O;
③Mg(OH)2+2H+===Mg2++2H2O; ④CO+2H+===CO2↑+H2O。
2.浓硫酸的特性
吸水性、脱水性和强氧化性。
(1)①干燥剂。②水的元素组成比。黑色 刺激性。
(2)
实验现象 a变黑,有气泡生成; b逐渐变为无色; c紫色石蕊溶液变红色;溶液呈蓝色
实验结论 氧化剂,还原剂
课时练习
1.实验室盛装浓硫酸的试剂瓶上贴有的标识是
A. B.
C. D.
2.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
3.下列关于浓硫酸与稀硫酸的说法,不正确的是
A.浓硫酸有脱水性,稀硫酸没有脱水性
B.浓硫酸有氧化性,稀硫酸没有氧化性
C.浓硫酸和稀硫酸都有酸性
D.常温下,浓硫酸和稀硫酸都不能与铜反应
4.如图是硫酸的用途示意图,下列有关叙述不正确的是( )
A.以硫酸为原料可以制备人们需要的部分物质
B.蔬菜、粮食中的化肥及农药的残留说明化学反应是造成食品污染的罪魁祸首
C.利用化学反应制备物质为人类带来了便利
D.化学反应有利于新物质的合成
5.下列现象或用途与浓硫酸的脱水性有关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
C.浓硫酸滴加到蔗糖中,蔗糖变黑
D.浓硫酸在加热条件下可与铜等不活泼金属反应
6.将一定量的锌与100mL18.5mol·L 1浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物 B.反应中共消耗Zn97.5g
C.气体A中SO2和H2的体积比为4∶1 D.反应中共转移3mol电子
7.研究铜和铁与浓硫酸的反应,实验如下:
① ②
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色
下列说法正确的是A.常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B.②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C.依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D.①②中现象的差异仅是由于温度改变了化学反应速率
8.某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如下表所示。
试管 ① ② ③ ④
实验现象 溶液仍为无色,有白雾、白色固体产生 有大量白色沉淀产生 无明显现象 品红溶液褪色
下列说法正确的是A.②中白色沉淀是BaSO3
B.①中观察到的白雾中含有硫酸小液滴
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
(多选)9.mg铜与足量浓H2SO4共热时完全反应,在标准状况下生成L气体,则被还原的H2SO4的量是( )
A.mol B.mol C.g D.g
参考答案:
1.A
【解析】
浓硫酸具有强烈的腐蚀性,实验室盛装浓硫酸的试剂瓶上贴有的标识应该是腐蚀品,故答案为:A
2.D
【解析】
A.浓硫酸使蔗糖碳化是因为其脱水性,A错误;
B.常温下浓硫酸与铜不反应,B错误;
C.氨气会和浓硫酸反应,不能用浓硫酸干燥,C错误;
D.浓硫酸具有强氧化性,在常温下可使铁、铝等金属在表面生成一层致密的氧化膜而钝化,D正确;
综上所述答案为D。
3.B
【解析】
A.浓硫酸可按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子,具有脱水性,而稀硫酸没有脱水性,A正确;
B.稀硫酸有氧化性,稀硫酸与活泼金属反应时,表现氧化性,发生还原反应生成H2,B错误;
C.浓硫酸和稀硫酸在与金属单质的反应中均能提供硫酸根离子,生成相应的硫酸盐,从而表现酸性,C正确;
D.铜属于不活泼金属,不能与稀硫酸反应,而铜与浓硫酸的反应需要在加热条件下才能进行,常温下不反应,D正确;
故选B。
4.B
【解析】
A.硫酸是重要的化工原料,从图示来看,可以用于制药品等物质人们需要的物质,正确,A不符合题意;
B.蔬菜、粮食中的化肥及农药的残留是由于人们不合理使用化学与农药,与化学反应无关,错误,B符合题意;
C.化学反应制备的物质丰富了人类的生活,给人们的生活带来了方便,正确,C不符合题意;
D.化学反应能够制备新的物质,有利于新物质的合成,正确,D不符合题意。
答案选B。
5.C
【解析】
A.浓硫酸和氯气不反应,浓硫酸作氯气的干燥剂是体现的吸水性,A选项错误;
B.浓硫酸加到胆矾上,蓝色晶体变成白色粉末,浓硫酸体现吸水性,B选项错误;
C.浓硫酸将蔗糖中H、O元素以2:1水的形式脱去而体现脱水性,C选项正确;
D.在加热条件下,浓硫酸和铜等不活泼金属反应而体现强氧化性和酸性,D选项错误;
答案选C。
6.C
【解析】
浓硫酸与锌反应生成二氧化硫气体,随着反应的进行,硫酸的浓度逐渐降低,继续与锌反应生成氢气,所以33.6L气体为二氧化硫和氢气的混合物,生成气体的物质的量为:=1.5mol,溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,,所以溶液剩余硫酸的物质的量为0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L 0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,则
,,则有:x+y=1.5,2x+y=1.8,解之得x=0.3,y=1.2,所以反应会生成0.3mol的二氧化硫和1.2mol的氢气。
【详解】
A.根据上述分析可知,气体为二氧化硫和氢气的混合物,A正确;
B.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,B正确;
C.由上述分析可知,V(SO2):V(H2)=1:4,C错误;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,D正确;
答案选C。
7.C
【解析】
A.常温下铁遇冷浓硫酸发生钝化,则可以用铁制容器盛放浓硫酸,故A错误;B.随着反应的进行浓硫酸的浓度逐渐降低,Cu与稀硫酸不反应,而Fe能与稀硫酸反应生成氢气,则②中铜丝或铁丝均有剩余时,产生气体的物质的量不可能相等,故B错误;C.②中在加热条件下,铜丝或铁丝逐渐溶解,产生大量气体,品红溶液褪色,说明反应中生成SO2,故C正确;D.温度升高可加快化学反应速率,同时浓硫酸的氧化性随温度升高而升高,故D错误;故答案为C。
8.B
【解析】
实验探究铜与浓硫酸的反应,试管①中溶液仍为无色,原因可能是混合体系中水太少,有白雾说明有气体形成液滴的过程,根据此现象,可以判断为反应过程中有SO3生成,与水蒸气结合形成酸雾;同时产生白色固体,该固体可能是无水硫酸铜;试管②中有白色沉淀生成,该沉淀应为硫酸钡,进一步说明反应过程中有SO3生成;试管③中无明显现象,试管④中品红溶液褪色说明反应中生成二氧化硫,浸有碱液的棉花团可以处理尾气。
【详解】
A.二氧化硫不能与氯化钡溶液反应,白色沉淀不可能是BaSO3,A错误;
B.根据分析可知①中有SO3和硫酸酸雾生成,B正确;
C.冷却后的试管中可能仍有剩余的浓硫酸,浓硫酸稀释放热,不能将水注入试管中,否则可能会造成液滴飞溅,C错误;
D.反应过程中SO3是氧气将二氧化硫氧化生成的,若先往装置内通入足量N2,体系内没有氧气,则无SO3生成,试管②中将无沉淀产生,实验现象发生变化,D正确;
故选B。
9.BC
【解析】
mgCu的物质的量=mol,反应中Cu元素化合价由0价升高为+2,S元素化合价由+6降低为+4,根据得失电子守恒有:(6-4)×n(SO2)=2×mol,故n(SO2)=mol,由S元素守恒可知n被还原(H2SO4)=n(SO2)=mol,m被还原(H2SO4)=mol×98g/mol=g;标况下n L二氧化硫的物质的量=mol,根据S原子守恒可知n被还原(H2SO4)=n(SO2)=mol,m被还原(H2SO4)=g。综上分析,选BC。
第二课时教学设计
教学目标
1.能从物质类别和元素的化合价的角度认识硫酸的性质,促进“证据推理与模型认知”化学核心素养的发展。
2.通过实验探究浓硫酸的吸水性、脱水性和强氧化性,强化“科学探究与创新意识”
教学重难点
重点 浓硫酸的三大特性
难点 浓硫酸的三大特性
教学方法
1.实验探究法,以实验为导向,通过观察实验现象,思考分析,得出结论,使学生在自己已有的知识基础上,通过对新的实验现象的分析、思考,建构起新的知识体系。
2.对比分析法(对比浓硫酸和稀硫酸的性质差异)
教学流程
【学生】阅读教材,提炼出工业制硫酸的原料、原理,写出相应的化学方程式。
【PPT】展示工业制硫酸流程。学生完成填空。
【知识回顾】稀硫酸的化学性质
【提问】浓硫酸有哪些性质呢?
【学生】阅读教材回答。浓硫酸是一种无色、黏稠的液体,易溶于水且溶于水时放出大量的热。
【提问】如果我们有一瓶浓硫酸,怎样能得到一瓶稀硫酸呢?
【学生】思考讨论。
【师】浓硫酸的稀释:稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
【实验演示】浓硫酸与蔗糖的反应。由蔗糖炭化变黑的现象,讲解浓硫酸的脱水性。
【对比归纳】吸水是指物质中本来就有水或结晶水。
脱水是指将化合物分子中的氢、氧两种元素按原子个数比2:1脱去。浓硫酸的腐蚀性源于它的脱水性。
【拓展】在蔗糖与浓硫酸反应中可以看到炭化变黑的现象,还会看到什么现象?由此讨论产生现象的原因,介绍浓硫酸的强氧化性。
【师】蔗糖遇浓硫酸炭化,生成黑色物质,体积膨胀为疏松多孔状,说明有气体产生。,浓硫酸表现出强氧化性。
【思考讨论】炭能与浓硫酸在加热条件下反应,那么金属呢?
【实验演示】浓硫酸与铜在加热条件下的反应
【实验分析与问题探讨】铜与浓硫酸反应需要什么条件?描述实验现象,根据实验现象推测反应生成物,分析试管Ⅱ口部棉花团的作用。
实验现象:
a试管中铜丝表面有气泡逸出;
b试管中的品红溶液逐渐变为无色;
c试管中的石蕊溶液逐渐变为红色;
将a试管里的溶液冷却后慢慢倒入水中,溶液变为蓝色。
反应原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
【讨论】1、实验中如何检验二氧化硫?如何防止污染?
浓硫酸的作用是什么?
当反应进行到一定程度,硫酸的浓度逐渐降低,反应是否会继续进行?
【总结】①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
【提问】所有金属单质与浓硫酸都能反应吗?
【学生】常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
【提问】浓硫酸能吸收存在于周围环境中的水分,因此能使蓝色胆矾(CuSO4·5H2O)变为白色粉末(CuSO4),故常用作干燥剂。浓硫酸不能用来干燥哪些气体?
【学生】思考讨论
【师】浓硫酸不能干燥碱性气体(如NH3等)和强还原性的气体(如H2S等)。但CO、H2等还原性气体不与浓硫酸反应,可以用浓硫酸干燥。
【拓展延伸】浓、稀硫酸的鉴别方法
讲与练
1.硫酸的工业制法
2.工业上接触法制硫酸的主要设备及生产流程如下图:
根据上图回答下列问题:
(1)填写下列各进口或出口物质的名称:
A: (如 );
B: ;
C: ;
D: 2)。
(2)接触法制硫酸分为三个阶段,请填写下表:
生产阶段 设备 主要反应
造气 S+O2SO2或4FeS2+11O22Fe2O3+8SO2
接触氧化 2SO2+O22SO3
SO3吸收 SO3+H2O===H2SO4
(3)三个反应
① ;
② ;
③ 。
答案:
(1)A:含硫矿石(如FeS2);
B:炉渣;
C:二氧化硫、氧气、氮气;
D:尾气(SO2、O2、N2)。
(2)接触法制硫酸分为三个阶段,请填写下表:
生产阶段 设备 主要反应
造气 沸腾炉 S+O2SO2或4FeS2+11O22Fe2O3+8SO2
接触氧化 接触室 2SO2+O22SO3
SO3吸收 吸收塔 SO3+H2O===H2SO4
(3)①4FeS2+11O22Fe2O3+8SO2或S+O2SO2;
②2SO2+O22SO3;
③SO3+H2O===H2SO4。
3.硫酸的酸的通性
H2SO4在水里很容易电离出 ,具有 ,能使紫色石蕊试液显 ,请写出下列反应的离子方程式。
①和活泼金属(如Fe): ;
②和金属氧化物(如MgO): ;
③和碱[如Mg(OH)2]: ;
④和盐(如Na2CO3): 。
4.浓硫酸的特性
浓硫酸有三大特性: 、 和 。
(1)吸水性与脱水性
①吸水性
浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作 。
②脱水性
浓硫酸能把有机物中的氢元素和氧元素按 脱去。如向蔗糖中加入浓硫酸时,蔗糖逐渐变黑,体积膨胀,形成 固体,并放出有 气味的气体。
(2)强氧化性
实验操作
实验现象 a试管中铜丝表面 ; b试管中的溶液 ; c试管中的 ; 将a试管里的溶液慢慢倒入水中, 色
实验结论 在反应中,浓硫酸是 ,铜是
答案:
1.H+,酸性,红色,
①Fe+2H+===Fe2++H2↑; ②MgO+2H+===Mg2++H2O;
③Mg(OH)2+2H+===Mg2++2H2O; ④CO+2H+===CO2↑+H2O。
2.浓硫酸的特性
吸水性、脱水性和强氧化性。
(1)①干燥剂。②水的元素组成比。黑色 刺激性。
(2)
实验现象 a变黑,有气泡生成; b逐渐变为无色; c紫色石蕊溶液变红色;溶液呈蓝色
实验结论 氧化剂,还原剂
课时练习
1.实验室盛装浓硫酸的试剂瓶上贴有的标识是
A. B.
C. D.
2.下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
3.下列关于浓硫酸与稀硫酸的说法,不正确的是
A.浓硫酸有脱水性,稀硫酸没有脱水性
B.浓硫酸有氧化性,稀硫酸没有氧化性
C.浓硫酸和稀硫酸都有酸性
D.常温下,浓硫酸和稀硫酸都不能与铜反应
4.如图是硫酸的用途示意图,下列有关叙述不正确的是( )
A.以硫酸为原料可以制备人们需要的部分物质
B.蔬菜、粮食中的化肥及农药的残留说明化学反应是造成食品污染的罪魁祸首
C.利用化学反应制备物质为人类带来了便利
D.化学反应有利于新物质的合成
5.下列现象或用途与浓硫酸的脱水性有关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
C.浓硫酸滴加到蔗糖中,蔗糖变黑
D.浓硫酸在加热条件下可与铜等不活泼金属反应
6.将一定量的锌与100mL18.5mol·L 1浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物 B.反应中共消耗Zn97.5g
C.气体A中SO2和H2的体积比为4∶1 D.反应中共转移3mol电子
7.研究铜和铁与浓硫酸的反应,实验如下:
① ②
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色
下列说法正确的是A.常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B.②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C.依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D.①②中现象的差异仅是由于温度改变了化学反应速率
8.某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如下表所示。
试管 ① ② ③ ④
实验现象 溶液仍为无色,有白雾、白色固体产生 有大量白色沉淀产生 无明显现象 品红溶液褪色
下列说法正确的是A.②中白色沉淀是BaSO3
B.①中观察到的白雾中含有硫酸小液滴
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
(多选)9.mg铜与足量浓H2SO4共热时完全反应,在标准状况下生成L气体,则被还原的H2SO4的量是( )
A.mol B.mol C.g D.g
参考答案:
1.A
【解析】
浓硫酸具有强烈的腐蚀性,实验室盛装浓硫酸的试剂瓶上贴有的标识应该是腐蚀品,故答案为:A
2.D
【解析】
A.浓硫酸使蔗糖碳化是因为其脱水性,A错误;
B.常温下浓硫酸与铜不反应,B错误;
C.氨气会和浓硫酸反应,不能用浓硫酸干燥,C错误;
D.浓硫酸具有强氧化性,在常温下可使铁、铝等金属在表面生成一层致密的氧化膜而钝化,D正确;
综上所述答案为D。
3.B
【解析】
A.浓硫酸可按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子,具有脱水性,而稀硫酸没有脱水性,A正确;
B.稀硫酸有氧化性,稀硫酸与活泼金属反应时,表现氧化性,发生还原反应生成H2,B错误;
C.浓硫酸和稀硫酸在与金属单质的反应中均能提供硫酸根离子,生成相应的硫酸盐,从而表现酸性,C正确;
D.铜属于不活泼金属,不能与稀硫酸反应,而铜与浓硫酸的反应需要在加热条件下才能进行,常温下不反应,D正确;
故选B。
4.B
【解析】
A.硫酸是重要的化工原料,从图示来看,可以用于制药品等物质人们需要的物质,正确,A不符合题意;
B.蔬菜、粮食中的化肥及农药的残留是由于人们不合理使用化学与农药,与化学反应无关,错误,B符合题意;
C.化学反应制备的物质丰富了人类的生活,给人们的生活带来了方便,正确,C不符合题意;
D.化学反应能够制备新的物质,有利于新物质的合成,正确,D不符合题意。
答案选B。
5.C
【解析】
A.浓硫酸和氯气不反应,浓硫酸作氯气的干燥剂是体现的吸水性,A选项错误;
B.浓硫酸加到胆矾上,蓝色晶体变成白色粉末,浓硫酸体现吸水性,B选项错误;
C.浓硫酸将蔗糖中H、O元素以2:1水的形式脱去而体现脱水性,C选项正确;
D.在加热条件下,浓硫酸和铜等不活泼金属反应而体现强氧化性和酸性,D选项错误;
答案选C。
6.C
【解析】
浓硫酸与锌反应生成二氧化硫气体,随着反应的进行,硫酸的浓度逐渐降低,继续与锌反应生成氢气,所以33.6L气体为二氧化硫和氢气的混合物,生成气体的物质的量为:=1.5mol,溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,,所以溶液剩余硫酸的物质的量为0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L 0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,则
,,则有:x+y=1.5,2x+y=1.8,解之得x=0.3,y=1.2,所以反应会生成0.3mol的二氧化硫和1.2mol的氢气。
【详解】
A.根据上述分析可知,气体为二氧化硫和氢气的混合物,A正确;
B.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,B正确;
C.由上述分析可知,V(SO2):V(H2)=1:4,C错误;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,D正确;
答案选C。
7.C
【解析】
A.常温下铁遇冷浓硫酸发生钝化,则可以用铁制容器盛放浓硫酸,故A错误;B.随着反应的进行浓硫酸的浓度逐渐降低,Cu与稀硫酸不反应,而Fe能与稀硫酸反应生成氢气,则②中铜丝或铁丝均有剩余时,产生气体的物质的量不可能相等,故B错误;C.②中在加热条件下,铜丝或铁丝逐渐溶解,产生大量气体,品红溶液褪色,说明反应中生成SO2,故C正确;D.温度升高可加快化学反应速率,同时浓硫酸的氧化性随温度升高而升高,故D错误;故答案为C。
8.B
【解析】
实验探究铜与浓硫酸的反应,试管①中溶液仍为无色,原因可能是混合体系中水太少,有白雾说明有气体形成液滴的过程,根据此现象,可以判断为反应过程中有SO3生成,与水蒸气结合形成酸雾;同时产生白色固体,该固体可能是无水硫酸铜;试管②中有白色沉淀生成,该沉淀应为硫酸钡,进一步说明反应过程中有SO3生成;试管③中无明显现象,试管④中品红溶液褪色说明反应中生成二氧化硫,浸有碱液的棉花团可以处理尾气。
【详解】
A.二氧化硫不能与氯化钡溶液反应,白色沉淀不可能是BaSO3,A错误;
B.根据分析可知①中有SO3和硫酸酸雾生成,B正确;
C.冷却后的试管中可能仍有剩余的浓硫酸,浓硫酸稀释放热,不能将水注入试管中,否则可能会造成液滴飞溅,C错误;
D.反应过程中SO3是氧气将二氧化硫氧化生成的,若先往装置内通入足量N2,体系内没有氧气,则无SO3生成,试管②中将无沉淀产生,实验现象发生变化,D正确;
故选B。
9.BC
【解析】
mgCu的物质的量=mol,反应中Cu元素化合价由0价升高为+2,S元素化合价由+6降低为+4,根据得失电子守恒有:(6-4)×n(SO2)=2×mol,故n(SO2)=mol,由S元素守恒可知n被还原(H2SO4)=n(SO2)=mol,m被还原(H2SO4)=mol×98g/mol=g;标况下n L二氧化硫的物质的量=mol,根据S原子守恒可知n被还原(H2SO4)=n(SO2)=mol,m被还原(H2SO4)=g。综上分析,选BC。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
