2021-2022学年下学期高一化学人教版(2019)必修第二册5.1硫及其化合物第一课时教学设计
文档属性
| 名称 | 2021-2022学年下学期高一化学人教版(2019)必修第二册5.1硫及其化合物第一课时教学设计 |  | |
| 格式 | doc | ||
| 文件大小 | 332.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-17 18:45:56 | ||
图片预览




文档简介
人教版高中化学必修第二册5.1硫及其化合物第一课时教学设计
《硫和二氧化硫》
教学目标 1.通过分析硫的原子结构,推断硫元素可能的化学性质并进行证实,理解物质的微观结构与宏观性质之间的关系。 2.结合实验探究,了解二氧化硫的物理性质和化学性质,能说出二氧化硫的主要用途。 3.通过二氧化硫与水、与氧气反应的学习,初步建立可逆反应的概念。
重难点 处理方法
重点 1、二氧化硫的性质(酸性氧化物通性、氧化性、还原性、漂白性) 通过分析硫原子结构特征,推断硫元素可能的化学性质。 2、播放二氧化硫溶于水和漂白作用的实验。
难点 2、二氧化碳和二氧化硫的比较以及鉴别、漂白性的比较。 开展小组探究活动,问题引导、类比。
【PPT展示】展示硫元素在元素周期表中位置图片。回忆硫元素的位置。
【学生】硫元素位于元素周期表第三周期 第Ⅵ A族
【学生活动】阅读教材,熟悉硫的物理性质。
【师】硫的物理性质:黄色固体易研成粉末;难溶于水;微溶于酒精;易溶于CS2
【提问】硫的溶解性在实际中有什么应用呢?
【学生活动】思考讨论
【师】硫易溶于CS2,故在实验中常用CS2清洗试管内壁上附着的硫单质。
【提问】硫有哪些化学性质呢?
【学生】思考讨论
【师】
。
2、二氧化硫
【过渡】二氧化硫和二氧化碳都是非金属氧化物,在组成上有相似之处,性质也可能相似。二氧化碳是一种酸性氧化物,能与水反应,能与碱溶液反应,二氧化硫是否也有类似性质?如何验证?
【教师实验演示一】展示二氧化硫气体,引导学生观色并闻味。
【学生】无色气体,有刺激性气味的有毒气体。
【教师实验演示二】将一盛满二氧化硫的试管倒置于水槽中,轻轻晃动,观察液面位置,待液面不再变化时,用橡皮塞塞紧试管口,取出试管。
【学生】二氧化硫易溶于水
【教师实验演示三】用pH试纸测所得溶液的酸碱度
【学生】试纸变红,说明溶液显酸性,二氧化硫与水反应生成亚硫酸
【实验结论总结】SO2是酸性氧化物,SO2溶于水和H2O反应生成H2SO3。这同CO2溶于水极为相似,亚硫酸也只能存在于溶液中,不稳定,易分解成SO2和H2O。
【提问】教材中二氧化硫与水反应的化学方程式与平常写的化学方程式有何差别?
【学生】教材中方程式用了可逆号,而不是等号
【师】可逆反应既能向正反应方向进行,同时又能向逆反应方向进行的反应。
【总结】二氧化硫的化学性质
与水反应:SO2+H2O H2SO3
与氧化物反应:SO2+Ca(OH)2=CaSO3↓+H2O;CaSO3+SO2+H2O=Ca(HSO3)2
与NaOH反应:SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3
还原性:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O=H2SO4+2HBr
氧化性:SO2+2H2S=3S↓+2H2O
【实验5-2】验证二氧化硫的漂白作用
【实验现象】向品红溶液中通入SO2气体,品红溶液褪色,加热后恢复原色。
【实验结论】二氧化硫具有漂白性,但生成的无色物质不稳定,受热易分解,使颜色恢复。
【拓展延伸】常见漂白剂的漂白原理比较
类型 漂白原理 漂白特点 变化类型 举例
氧化型 漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色 褪色后不会恢复原色 化学变化 HClO、Na2O2、O3、H2O2等
化合型 漂白剂与某些有色物质发生化合反应而使其褪色 一定条件下发生分解,又恢复原色 化学变化 SO2
吸附型 某些固体物质具有疏松多孔的结构,能吸附有色物质 —— 物理变化 活性炭等
【提问】二氧化硫在实际生活中有什么用途呢?
【学生】1.制硫酸:
2.漂白纸浆、毛、丝、草帽等
3.杀菌消毒
【拓展延伸】SO2与CO2的性质比较
SO2 CO2
相同点 常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2=CaSO3↓+H2O CaSO3+SO2+H2O=Ca(HSO3)2 Ca(OH)2+CO2=CaCO3↓+H2O CaCO3+CO2+H2O=Ca(HCO3)2
不同点 有刺激性气味,有毒 无味,无毒
易溶于水 可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化 无还原性
具有漂白性,能使品红溶液褪色 没有漂白性
酸性:H2SO3>H2CO3
常见的CO2、SO2的鉴别方法
试剂 现象及结论
品红溶液 使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸 出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液 使紫色退去的是SO2,无明显现象的是CO2
溴水 使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉) 使蓝色退去的是SO2,无明显现象的是CO2
讲与练
硫
1.硫元素的存在形态
2.硫单质的物理性质
硫单质俗称硫黄,是一种 色固体; 溶于水,微溶于酒精, 溶于CS2;有多种同素异形体,如单斜硫、斜方硫等。
答案:
2.淡黄色;不 ,微 ,易
随堂演练:
1.实验室洗涤试管壁上附着的硫单质,常用两种方法。
(1)物理方法:用CS2洗涤,利用单质硫的性质为____________________。
(2)化学方法:用热的NaOH溶液洗涤,该反应原理为 3S+6NaOH2Na2S+Na2SO3+3H2O,在该反应中,硫单质表现________性和________性,氧化剂和还原剂的物质的量之比为_________,写出上述反应的离子方程式:_____________________________。
(3)向上述反应的溶液中再加入适量的稀H2SO4,会产生淡黄色沉淀,写出该反应的离子方程式:________________________________________________________________________。
【答案】(1)易溶于CS2
(2)氧化 还原 2∶1 3S+6OH-2S2-+SO+3H2O
(3)2S2-+SO+6H+===3S↓+3H2O
二氧化硫
1.物理性质
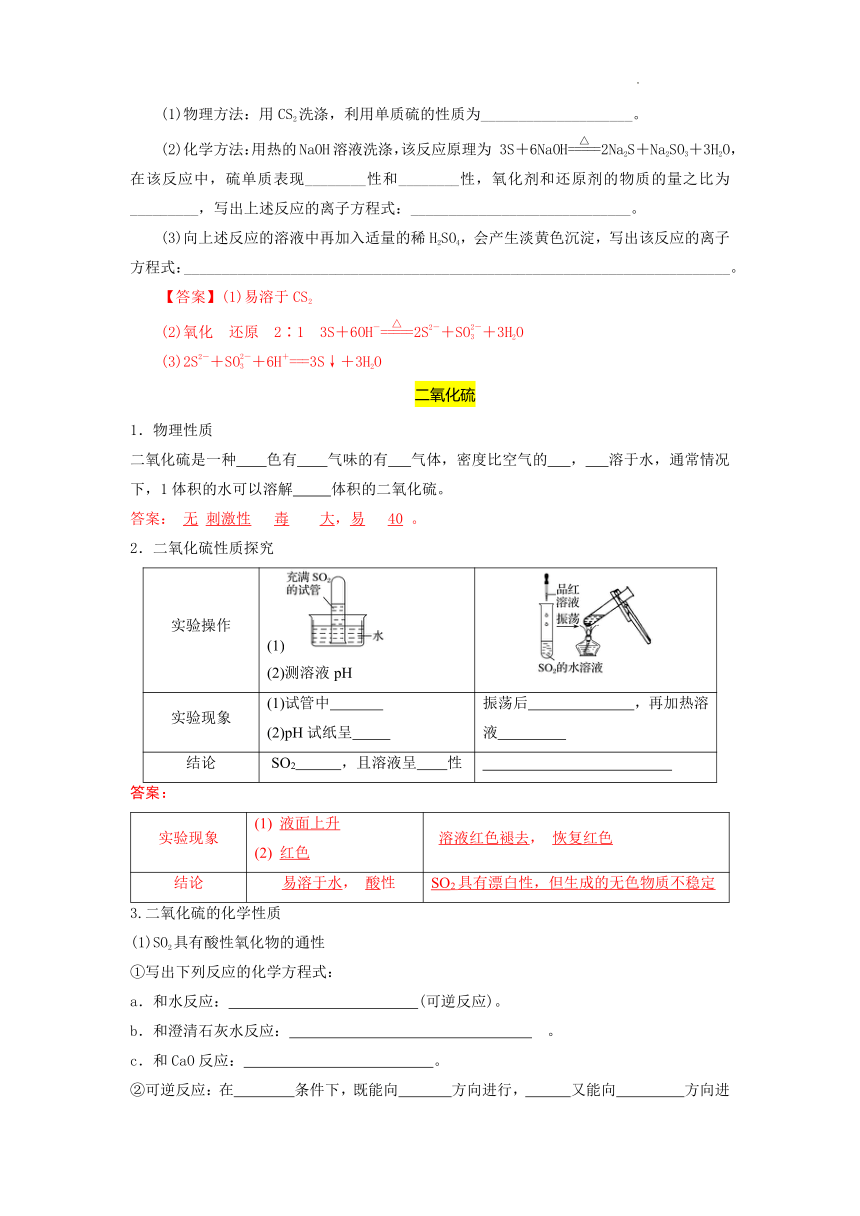
二氧化硫是一种 色有 气味的有 气体,密度比空气的 , 溶于水,通常情况下,1体积的水可以溶解 体积的二氧化硫。
答案: 无 刺激性 毒 大,易 40 。
2.二氧化硫性质探究
实验操作 (1) (2)测溶液pH
实验现象 (1)试管中 (2)pH试纸呈 振荡后 ,再加热溶液
结论 SO2 ,且溶液呈 性
答案:
实验现象 液面上升 红色 溶液红色褪去, 恢复红色
结论 易溶于水, 酸性 SO2具有漂白性,但生成的无色物质不稳定
3.二氧化硫的化学性质
(1)SO2具有酸性氧化物的通性
①写出下列反应的化学方程式:
a.和水反应: (可逆反应)。
b.和澄清石灰水反应: 。
c.和CaO反应: 。
②可逆反应:在 条件下,既能向 方向进行, 又能向 方向进行的反应。
在可逆反应的化学方程式中用“ ”代替“===”。
(2)从元素化合价变化角度分析SO2性质
(3)SO2的特性——漂白性
它能与某些有色物质(如品红溶液)生成不稳定的无色物质。这些无色物质容易分解而使有色物质恢复原来的颜色。
答案:(1)①a. SO2+H2OH2SO3(可逆反应)。b. SO2+Ca(OH)2===CaSO3↓+H2O。c. SO2+CaO===CaSO3。
② 同一 , 正反应 ,同时 逆反应 。“”
4.硫的氧化物的污染与治理
(1)来源: 的燃烧及 的冶炼等。
(2)危害:危害人体健康,形成酸雨(pH小于5.6)。
(3)治理:燃煤 ,改进燃烧技术。
(4)硫酸型酸雨的形成途径有两个:
途径1:空气中飘尘的催化作用, 。
途径2: 。
(5)两种常见的SO2尾气处理方法
方法一:钙基固硫法
为防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、氧气共同反应生成硫酸钙,从而使硫元素转移到煤渣中,反应原理为 ,总反应方程式为 。
方法二:氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为: (或生成NH4HSO3,然后进一步氧化)。
答案:(1)含硫化石燃料 金属矿物 。 (3)脱硫。
(4) 2SO2+O22SO3、SO3+H2O===H2SO4。 SO2+H2O??H2SO3、2H2SO3+O2===2H2SO4。
(5)CaO+SO2CaSO3,2CaSO3+O22CaSO4,总反应方程式为2CaO+2SO2+O22CaSO4。
2NH3+SO2+H2O===(NH4)2SO3,2(NH4)2SO3+O2===2(NH4)2SO4
随堂演练
(2020·江西赣州中学高一月考)下列有关SO2的漂白性说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)溶液、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2的水溶液具有更强的漂白能力
【答案】B
【解析】 A选项错误,SO2使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红褪色是因其漂白性,SO2不能使指示剂褪色;B选项正确,因为能使品红溶液褪色的物质很多,不仅仅是SO2;C选项错误,因为这些漂白剂的漂白原理不相同,SO2漂白属于化合型,活性炭属吸附型,漂白粉、Na2O2属氧化型;D选项错误,等物质的量的SO2和Cl2在水溶液中反应生成H2SO4和HCl,从而失去漂白能力。
课后测
1.下列反应中,调节反应物用量或浓度,不会改变反应产物的是
A.硫在氧气中燃烧 B.H2SO4与Zn反应
C.二氧化硫通入澄清石灰水 D.亚硫酸钠溶液中加入盐酸
2.下列有关硫及其化合物的叙述正确的是
A.硫易溶于酒精 B.二氧化硫不可用作食品的添加剂
C.浓硫酸不能干燥 D.硫有多种同素异形体
3.硫元素的价类二维图如图所示(其中h、g的阳离子均为Na+),下列说法正确的是
A.将氯化钡溶液分别滴入h和g的稀溶液中,现象不同
B.c能将滴有酚酞的氢氧化钠稀溶液漂白为无色
C.工业上,在常温下可以用铁罐储存f的浓溶液
D.b与少量的Cu在加热条件下生成黑色固体CuS
4.将干燥的铁粉和硫粉混合均匀后,用红热的玻璃棒接触混合粉末,待反应引发后便移开玻璃棒,反应仍然继续剧烈进行,最终生成黑色固体。下列关于该反应的说法中正确的组合是
①发生反应的化学方程式为Fe+SFeS ②反应中硫粉是氧化剂 ③每消耗56 g 铁粉,此反应中转移的电子数为2NA
A.只有①② B.只有②③ C.只有①③ D.①②③
5.可以由两种单质直接化合得到的物质是
A.硫化铜 B.氯化亚铁 C.硫化亚铁 D.三氧化硫
6.硫及其化合物在生产、生活和科学研究中有广泛的应用。SO2可添加到食品中作为漂白剂、防腐剂和抗氧化剂:工业上常用V2O5催化O2氧化SO2制取SO3,进而制得H2SO4,H2SO4溶于水后可电离出H+和SO。下列关于硫及其化合物的性质与用途具有对应关系的是
A.硫磺难溶于水,可用于去除洒落在地面的汞
B.二氧化硫具有漂白性,可用作干制果蔬的抗氧化剂
C.浓硫酸具有强氧化性,实验室可用作干燥剂
D.聚合硫酸铁能水解并形成胶体,可用于净水
7.宏观辨识与微观探析是化学学科核心素养之一。下列实验现象对应的离子方程式正确的是
A.过量SO2通入滴有酚酞的NaOH溶液,溶液红色褪去:SO2 +OH- =HSO
B.大理石与盐酸接触,产生无色气泡:CO+2H+=CO2↑ +H2O
C.CO2 通入饱和Na2CO3溶液中出现浑浊现象:CO2 +H2O +CO= 2HCO
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体:2Fe +3Cu2+= 3Cu +2Fe3+
8.将SO2通入下列溶液中,能观察到明显现象的是
①BaCl2②Ba(OH)2③品红④酸性高锰酸钾溶液
A.①② B.②③④ C.③④ D.①②③④
9.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
[已知:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O]
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_______、_______
(2)①反应后,装置B中发生的现象是_______,反应的离子方程式为_______;
②装置C中实验表现了SO2的_______;
③装置D中发生反应的化学方程式为_______。
(3)装置E的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象:_______。
(4)F装置的作用是_______,漏斗的作用是_______。
答案
1.A
【解析】
A.硫单质的氧化性较弱,与氧气反应时,无论氧气是否过量,硫蒸气与氧气反应只能生成二氧化硫,A正确;
B.稀硫酸与锌反应生成硫酸锌和氢气,与浓硫酸反应生成硫酸锌、二氧化硫和水,则调节硫酸的浓度会改变反应产物,B错误;
C.少量的二氧化硫与澄清石灰水反应生成亚硫酸钙沉淀,过量的二氧化硫与澄清石灰水反应生成亚硫酸氢钙,则调节二氧化硫的用量会改变反应产物,C错误;
D.少量的亚硫酸钠与盐酸反应生成氯化钠、二氧化硫和水,足量的亚硫酸钠与盐酸反应生成氯化钠和亚硫酸氢钠,则调节亚硫酸钠的用量会改变反应产物,D错误;
故选A。
2.D
【解析】
A.硫微溶于酒精,故A错误;
B.二氧化硫有还原作用,可消耗果蔬组织中的氧,可以抑制氧化酶的活性,从而抑制酶性褐变,有抗氧化作用,所以二氧化硫能作食品防腐剂,但不能超量,故B错误;
C.浓硫酸与二氧化硫不反应,可以用浓硫酸干燥二氧化硫,故C错误;
D.硫有多种同素异形体,如S2、S4、S6、S8等,故D正确;
故选:D。
3.C
【解析】
a是S的-2价氢化物,a是H2S;b是S单质;c是S的+4价氧化物,c是SO2;d是S的+6价氧化物,c是SO3;e是S的+4价含氧酸,e是H2SO3;f是S的+6价含氧酸,f是H2SO4;g是S的+4价含氧酸的钠盐,g是Na2SO3;h是S的+6价含氧酸的钠盐,h是Na2SO4;
【详解】
A.将氯化钡溶液分别滴入Na2SO3、Na2SO4的稀溶液中生成白色沉淀BaSO3、BaSO4,故A错误;
B.SO2使滴有酚酞的氢氧化钠稀溶液褪色,是因为SO2和氢氧化钠稀溶液反应,体现二氧化硫酸性氧化物的性质,故B错误;
C.常温下,浓硫酸能使铁、铝钝化,在常温下可以用铁罐储存浓硫酸,故C正确;
D.S的氧化性弱,S与少量的Cu在加热条件下生成黑色固体Cu2S,故D错误;
选C。
4.D
【解析】
①Fe与S共热反应生成FeS,则发生反应的化学方程式为Fe+SFeS,①正确;②反应中S的化合价由0价降低到-2价,被还原,则硫粉是氧化剂,②正确;③每消耗56 g 即=1mol铁粉,此反应中转移的电子数为2NA,③正确;综上分析可知,①②③均正确,故答案为:D。
5.C
【解析】
A.铜与硫单质反应生成Cu2S,所以硫化铜不能由单质直接化合得到,故A不符合题意;
B.铁与氯气反应生成氯化铁,所以氯化亚铁不能通过单质直接化合得到,故B不符合题意;
C.铁与硫单质反应生成硫化亚铁,所以硫化亚铁能由单质直接化合得到,故C符合题意;
D.硫和氧气反应生成二氧化硫,二氧化硫和氧气在催化剂作用下可生成三氧化硫,三氧化硫不能由两种单质直接化合得到,故D不符合题意;
答案选C。
6.D
【解析】
A.硫能与汞反应,可用于去除洒落在地面的汞,与硫的溶解性无关,故A错误;
B.作抗氧化剂与还原性有关,与二氧化硫具有漂白性无关,故B错误;
C.浓硫酸可以作干燥剂,是因为浓硫酸具有吸水性,与其强氧化性无关,故C错误;
D.聚合硫酸铁能水解形成氢氧化铁胶体,胶体具有吸附性,可以吸附水中悬浮物,起净水作用,故D正确;
答案选D。
7.A
【解析】
A.二氧化硫为酸性氧化物,过量的SO2与NaOH溶液反应生成酸式盐和水,溶液红色褪去,其离子方程式为SO2 +OH- =,故A正确;
B.大理石与盐酸接触,发生反应生成CaCl2、CO2和H2O,由于CaCO3难溶于水,在离子方程式中应保留化学式,其离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.CO2 通入饱和Na2CO3溶液中,二者发生反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则产生沉淀,即溶液出现浑浊,其离子方程式为CO2 +H2O +2Na++=2NaHCO3↓,故C错误;
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体,说明铁能与硫酸铜发生置换反应,即Fe与CuSO4发生反应,生成硫酸亚铁和Cu,其离子方程式为Fe+Cu2+=Fe2++Cu,故D错误;
答案为A。
8.B
【解析】
①SO2不与BaCl2溶液反应,则①中无现象;②二氧化硫是酸性氧化物,能与Ba(OH)2反应生成白色沉淀亚硫酸钡,则管②中产生白色沉淀;③ SO2具有漂白性,能使品红溶液褪色,则③中品红溶液褪色;④酸性高锰酸钾溶液具有强氧化性,能够氧化二氧化硫,则④中高锰酸钾褪色;能观察到明显现象的是②③④;
答案选B。
9.(1) 分液漏斗 圆底烧瓶
(2) 溶液褪色 SO2+Cl2+2H2O=4H++2Cl-+ 还原性 2H2S+SO2=3S↓+2H2O
(3)将试管E在酒精灯上加热,溶液恢复红色
(4) 吸收多余的SO2 防止倒吸
【解析】
浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫与氯气反应生成盐酸和硫酸,二氧化硫具有还原性能够使酸性高锰酸钾褪色,二氧化硫具有氧化性,能够氧化硫化氢生成硫单质,二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫有毒,不能直接排放到空气中,能够与氢氧化钠反应生成亚硫酸钠,可以用氢氧化钠吸收过量的二氧化硫。
(1)
装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是分液漏斗、圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)
①二氧化硫与氯气反应生成盐酸和硫酸,反应后,装置B中发生的现象是溶液褪色,反应的离子方程式为SO2+Cl2+2H2O=4H++2Cl-+;
②二氧化硫具有还原性能够使C中酸性高锰酸钾褪色,装置C中的现象是溶液紫红色褪去,表现了SO2的还原性;
③二氧化硫具有氧化性,能够氧化装置D中硫化氢生成硫单质,发生反应的化学方程式为2H2S+SO2=3S↓+2H2O;
(3)
二氧化硫具有漂白性,能够使装置E中品红溶液褪色;装置E的目的是探究SO2与品红溶液作用的可逆性,实验操作及现象将试管E在酒精灯上加热,溶液恢复红色;
(4)
二氧化硫有毒不能排放到空气中,所以用氢氧化钠溶液可吸收二氧化硫,倒扣的漏斗溶液上升具有缓冲作用,能防止倒吸。
《硫和二氧化硫》
教学目标 1.通过分析硫的原子结构,推断硫元素可能的化学性质并进行证实,理解物质的微观结构与宏观性质之间的关系。 2.结合实验探究,了解二氧化硫的物理性质和化学性质,能说出二氧化硫的主要用途。 3.通过二氧化硫与水、与氧气反应的学习,初步建立可逆反应的概念。
重难点 处理方法
重点 1、二氧化硫的性质(酸性氧化物通性、氧化性、还原性、漂白性) 通过分析硫原子结构特征,推断硫元素可能的化学性质。 2、播放二氧化硫溶于水和漂白作用的实验。
难点 2、二氧化碳和二氧化硫的比较以及鉴别、漂白性的比较。 开展小组探究活动,问题引导、类比。
【PPT展示】展示硫元素在元素周期表中位置图片。回忆硫元素的位置。
【学生】硫元素位于元素周期表第三周期 第Ⅵ A族
【学生活动】阅读教材,熟悉硫的物理性质。
【师】硫的物理性质:黄色固体易研成粉末;难溶于水;微溶于酒精;易溶于CS2
【提问】硫的溶解性在实际中有什么应用呢?
【学生活动】思考讨论
【师】硫易溶于CS2,故在实验中常用CS2清洗试管内壁上附着的硫单质。
【提问】硫有哪些化学性质呢?
【学生】思考讨论
【师】
。
2、二氧化硫
【过渡】二氧化硫和二氧化碳都是非金属氧化物,在组成上有相似之处,性质也可能相似。二氧化碳是一种酸性氧化物,能与水反应,能与碱溶液反应,二氧化硫是否也有类似性质?如何验证?
【教师实验演示一】展示二氧化硫气体,引导学生观色并闻味。
【学生】无色气体,有刺激性气味的有毒气体。
【教师实验演示二】将一盛满二氧化硫的试管倒置于水槽中,轻轻晃动,观察液面位置,待液面不再变化时,用橡皮塞塞紧试管口,取出试管。
【学生】二氧化硫易溶于水
【教师实验演示三】用pH试纸测所得溶液的酸碱度
【学生】试纸变红,说明溶液显酸性,二氧化硫与水反应生成亚硫酸
【实验结论总结】SO2是酸性氧化物,SO2溶于水和H2O反应生成H2SO3。这同CO2溶于水极为相似,亚硫酸也只能存在于溶液中,不稳定,易分解成SO2和H2O。
【提问】教材中二氧化硫与水反应的化学方程式与平常写的化学方程式有何差别?
【学生】教材中方程式用了可逆号,而不是等号
【师】可逆反应既能向正反应方向进行,同时又能向逆反应方向进行的反应。
【总结】二氧化硫的化学性质
与水反应:SO2+H2O H2SO3
与氧化物反应:SO2+Ca(OH)2=CaSO3↓+H2O;CaSO3+SO2+H2O=Ca(HSO3)2
与NaOH反应:SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3
还原性:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2+Br2+2H2O=H2SO4+2HBr
氧化性:SO2+2H2S=3S↓+2H2O
【实验5-2】验证二氧化硫的漂白作用
【实验现象】向品红溶液中通入SO2气体,品红溶液褪色,加热后恢复原色。
【实验结论】二氧化硫具有漂白性,但生成的无色物质不稳定,受热易分解,使颜色恢复。
【拓展延伸】常见漂白剂的漂白原理比较
类型 漂白原理 漂白特点 变化类型 举例
氧化型 漂白剂具有强氧化性,因与有色物质发生氧化还原反应而使其褪色 褪色后不会恢复原色 化学变化 HClO、Na2O2、O3、H2O2等
化合型 漂白剂与某些有色物质发生化合反应而使其褪色 一定条件下发生分解,又恢复原色 化学变化 SO2
吸附型 某些固体物质具有疏松多孔的结构,能吸附有色物质 —— 物理变化 活性炭等
【提问】二氧化硫在实际生活中有什么用途呢?
【学生】1.制硫酸:
2.漂白纸浆、毛、丝、草帽等
3.杀菌消毒
【拓展延伸】SO2与CO2的性质比较
SO2 CO2
相同点 常温下都是气体
密度均大于空气
溶于水后的溶液均可导电
酸性氧化物,都能使澄清石灰水变浑浊,气体过量时又变澄清
Ca(OH)2+SO2=CaSO3↓+H2O CaSO3+SO2+H2O=Ca(HSO3)2 Ca(OH)2+CO2=CaCO3↓+H2O CaCO3+CO2+H2O=Ca(HCO3)2
不同点 有刺激性气味,有毒 无味,无毒
易溶于水 可溶于水
具有还原性,能被O2、Cl2、Br2、I2、酸性KMnO4溶液等氧化 无还原性
具有漂白性,能使品红溶液褪色 没有漂白性
酸性:H2SO3>H2CO3
常见的CO2、SO2的鉴别方法
试剂 现象及结论
品红溶液 使品红溶液退色的是SO2;不能使品红溶液退色的是CO2
氢硫酸 出现浑浊的是SO2,无明显现象的是CO2
高锰酸钾溶液 使紫色退去的是SO2,无明显现象的是CO2
溴水 使橙色退去的是SO2,无明显现象的是CO2
碘水(含淀粉) 使蓝色退去的是SO2,无明显现象的是CO2
讲与练
硫
1.硫元素的存在形态
2.硫单质的物理性质
硫单质俗称硫黄,是一种 色固体; 溶于水,微溶于酒精, 溶于CS2;有多种同素异形体,如单斜硫、斜方硫等。
答案:
2.淡黄色;不 ,微 ,易
随堂演练:
1.实验室洗涤试管壁上附着的硫单质,常用两种方法。
(1)物理方法:用CS2洗涤,利用单质硫的性质为____________________。
(2)化学方法:用热的NaOH溶液洗涤,该反应原理为 3S+6NaOH2Na2S+Na2SO3+3H2O,在该反应中,硫单质表现________性和________性,氧化剂和还原剂的物质的量之比为_________,写出上述反应的离子方程式:_____________________________。
(3)向上述反应的溶液中再加入适量的稀H2SO4,会产生淡黄色沉淀,写出该反应的离子方程式:________________________________________________________________________。
【答案】(1)易溶于CS2
(2)氧化 还原 2∶1 3S+6OH-2S2-+SO+3H2O
(3)2S2-+SO+6H+===3S↓+3H2O
二氧化硫
1.物理性质
二氧化硫是一种 色有 气味的有 气体,密度比空气的 , 溶于水,通常情况下,1体积的水可以溶解 体积的二氧化硫。
答案: 无 刺激性 毒 大,易 40 。
2.二氧化硫性质探究
实验操作 (1) (2)测溶液pH
实验现象 (1)试管中 (2)pH试纸呈 振荡后 ,再加热溶液
结论 SO2 ,且溶液呈 性
答案:
实验现象 液面上升 红色 溶液红色褪去, 恢复红色
结论 易溶于水, 酸性 SO2具有漂白性,但生成的无色物质不稳定
3.二氧化硫的化学性质
(1)SO2具有酸性氧化物的通性
①写出下列反应的化学方程式:
a.和水反应: (可逆反应)。
b.和澄清石灰水反应: 。
c.和CaO反应: 。
②可逆反应:在 条件下,既能向 方向进行, 又能向 方向进行的反应。
在可逆反应的化学方程式中用“ ”代替“===”。
(2)从元素化合价变化角度分析SO2性质
(3)SO2的特性——漂白性
它能与某些有色物质(如品红溶液)生成不稳定的无色物质。这些无色物质容易分解而使有色物质恢复原来的颜色。
答案:(1)①a. SO2+H2OH2SO3(可逆反应)。b. SO2+Ca(OH)2===CaSO3↓+H2O。c. SO2+CaO===CaSO3。
② 同一 , 正反应 ,同时 逆反应 。“”
4.硫的氧化物的污染与治理
(1)来源: 的燃烧及 的冶炼等。
(2)危害:危害人体健康,形成酸雨(pH小于5.6)。
(3)治理:燃煤 ,改进燃烧技术。
(4)硫酸型酸雨的形成途径有两个:
途径1:空气中飘尘的催化作用, 。
途径2: 。
(5)两种常见的SO2尾气处理方法
方法一:钙基固硫法
为防治酸雨,工业上常用生石灰和含硫的煤混合后燃烧,燃烧时硫、生石灰、氧气共同反应生成硫酸钙,从而使硫元素转移到煤渣中,反应原理为 ,总反应方程式为 。
方法二:氨水脱硫法
该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为: (或生成NH4HSO3,然后进一步氧化)。
答案:(1)含硫化石燃料 金属矿物 。 (3)脱硫。
(4) 2SO2+O22SO3、SO3+H2O===H2SO4。 SO2+H2O??H2SO3、2H2SO3+O2===2H2SO4。
(5)CaO+SO2CaSO3,2CaSO3+O22CaSO4,总反应方程式为2CaO+2SO2+O22CaSO4。
2NH3+SO2+H2O===(NH4)2SO3,2(NH4)2SO3+O2===2(NH4)2SO4
随堂演练
(2020·江西赣州中学高一月考)下列有关SO2的漂白性说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)溶液、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2的水溶液具有更强的漂白能力
【答案】B
【解析】 A选项错误,SO2使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红褪色是因其漂白性,SO2不能使指示剂褪色;B选项正确,因为能使品红溶液褪色的物质很多,不仅仅是SO2;C选项错误,因为这些漂白剂的漂白原理不相同,SO2漂白属于化合型,活性炭属吸附型,漂白粉、Na2O2属氧化型;D选项错误,等物质的量的SO2和Cl2在水溶液中反应生成H2SO4和HCl,从而失去漂白能力。
课后测
1.下列反应中,调节反应物用量或浓度,不会改变反应产物的是
A.硫在氧气中燃烧 B.H2SO4与Zn反应
C.二氧化硫通入澄清石灰水 D.亚硫酸钠溶液中加入盐酸
2.下列有关硫及其化合物的叙述正确的是
A.硫易溶于酒精 B.二氧化硫不可用作食品的添加剂
C.浓硫酸不能干燥 D.硫有多种同素异形体
3.硫元素的价类二维图如图所示(其中h、g的阳离子均为Na+),下列说法正确的是
A.将氯化钡溶液分别滴入h和g的稀溶液中,现象不同
B.c能将滴有酚酞的氢氧化钠稀溶液漂白为无色
C.工业上,在常温下可以用铁罐储存f的浓溶液
D.b与少量的Cu在加热条件下生成黑色固体CuS
4.将干燥的铁粉和硫粉混合均匀后,用红热的玻璃棒接触混合粉末,待反应引发后便移开玻璃棒,反应仍然继续剧烈进行,最终生成黑色固体。下列关于该反应的说法中正确的组合是
①发生反应的化学方程式为Fe+SFeS ②反应中硫粉是氧化剂 ③每消耗56 g 铁粉,此反应中转移的电子数为2NA
A.只有①② B.只有②③ C.只有①③ D.①②③
5.可以由两种单质直接化合得到的物质是
A.硫化铜 B.氯化亚铁 C.硫化亚铁 D.三氧化硫
6.硫及其化合物在生产、生活和科学研究中有广泛的应用。SO2可添加到食品中作为漂白剂、防腐剂和抗氧化剂:工业上常用V2O5催化O2氧化SO2制取SO3,进而制得H2SO4,H2SO4溶于水后可电离出H+和SO。下列关于硫及其化合物的性质与用途具有对应关系的是
A.硫磺难溶于水,可用于去除洒落在地面的汞
B.二氧化硫具有漂白性,可用作干制果蔬的抗氧化剂
C.浓硫酸具有强氧化性,实验室可用作干燥剂
D.聚合硫酸铁能水解并形成胶体,可用于净水
7.宏观辨识与微观探析是化学学科核心素养之一。下列实验现象对应的离子方程式正确的是
A.过量SO2通入滴有酚酞的NaOH溶液,溶液红色褪去:SO2 +OH- =HSO
B.大理石与盐酸接触,产生无色气泡:CO+2H+=CO2↑ +H2O
C.CO2 通入饱和Na2CO3溶液中出现浑浊现象:CO2 +H2O +CO= 2HCO
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体:2Fe +3Cu2+= 3Cu +2Fe3+
8.将SO2通入下列溶液中,能观察到明显现象的是
①BaCl2②Ba(OH)2③品红④酸性高锰酸钾溶液
A.①② B.②③④ C.③④ D.①②③④
9.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
[已知:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O]
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_______、_______
(2)①反应后,装置B中发生的现象是_______,反应的离子方程式为_______;
②装置C中实验表现了SO2的_______;
③装置D中发生反应的化学方程式为_______。
(3)装置E的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象:_______。
(4)F装置的作用是_______,漏斗的作用是_______。
答案
1.A
【解析】
A.硫单质的氧化性较弱,与氧气反应时,无论氧气是否过量,硫蒸气与氧气反应只能生成二氧化硫,A正确;
B.稀硫酸与锌反应生成硫酸锌和氢气,与浓硫酸反应生成硫酸锌、二氧化硫和水,则调节硫酸的浓度会改变反应产物,B错误;
C.少量的二氧化硫与澄清石灰水反应生成亚硫酸钙沉淀,过量的二氧化硫与澄清石灰水反应生成亚硫酸氢钙,则调节二氧化硫的用量会改变反应产物,C错误;
D.少量的亚硫酸钠与盐酸反应生成氯化钠、二氧化硫和水,足量的亚硫酸钠与盐酸反应生成氯化钠和亚硫酸氢钠,则调节亚硫酸钠的用量会改变反应产物,D错误;
故选A。
2.D
【解析】
A.硫微溶于酒精,故A错误;
B.二氧化硫有还原作用,可消耗果蔬组织中的氧,可以抑制氧化酶的活性,从而抑制酶性褐变,有抗氧化作用,所以二氧化硫能作食品防腐剂,但不能超量,故B错误;
C.浓硫酸与二氧化硫不反应,可以用浓硫酸干燥二氧化硫,故C错误;
D.硫有多种同素异形体,如S2、S4、S6、S8等,故D正确;
故选:D。
3.C
【解析】
a是S的-2价氢化物,a是H2S;b是S单质;c是S的+4价氧化物,c是SO2;d是S的+6价氧化物,c是SO3;e是S的+4价含氧酸,e是H2SO3;f是S的+6价含氧酸,f是H2SO4;g是S的+4价含氧酸的钠盐,g是Na2SO3;h是S的+6价含氧酸的钠盐,h是Na2SO4;
【详解】
A.将氯化钡溶液分别滴入Na2SO3、Na2SO4的稀溶液中生成白色沉淀BaSO3、BaSO4,故A错误;
B.SO2使滴有酚酞的氢氧化钠稀溶液褪色,是因为SO2和氢氧化钠稀溶液反应,体现二氧化硫酸性氧化物的性质,故B错误;
C.常温下,浓硫酸能使铁、铝钝化,在常温下可以用铁罐储存浓硫酸,故C正确;
D.S的氧化性弱,S与少量的Cu在加热条件下生成黑色固体Cu2S,故D错误;
选C。
4.D
【解析】
①Fe与S共热反应生成FeS,则发生反应的化学方程式为Fe+SFeS,①正确;②反应中S的化合价由0价降低到-2价,被还原,则硫粉是氧化剂,②正确;③每消耗56 g 即=1mol铁粉,此反应中转移的电子数为2NA,③正确;综上分析可知,①②③均正确,故答案为:D。
5.C
【解析】
A.铜与硫单质反应生成Cu2S,所以硫化铜不能由单质直接化合得到,故A不符合题意;
B.铁与氯气反应生成氯化铁,所以氯化亚铁不能通过单质直接化合得到,故B不符合题意;
C.铁与硫单质反应生成硫化亚铁,所以硫化亚铁能由单质直接化合得到,故C符合题意;
D.硫和氧气反应生成二氧化硫,二氧化硫和氧气在催化剂作用下可生成三氧化硫,三氧化硫不能由两种单质直接化合得到,故D不符合题意;
答案选C。
6.D
【解析】
A.硫能与汞反应,可用于去除洒落在地面的汞,与硫的溶解性无关,故A错误;
B.作抗氧化剂与还原性有关,与二氧化硫具有漂白性无关,故B错误;
C.浓硫酸可以作干燥剂,是因为浓硫酸具有吸水性,与其强氧化性无关,故C错误;
D.聚合硫酸铁能水解形成氢氧化铁胶体,胶体具有吸附性,可以吸附水中悬浮物,起净水作用,故D正确;
答案选D。
7.A
【解析】
A.二氧化硫为酸性氧化物,过量的SO2与NaOH溶液反应生成酸式盐和水,溶液红色褪去,其离子方程式为SO2 +OH- =,故A正确;
B.大理石与盐酸接触,发生反应生成CaCl2、CO2和H2O,由于CaCO3难溶于水,在离子方程式中应保留化学式,其离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.CO2 通入饱和Na2CO3溶液中,二者发生反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则产生沉淀,即溶液出现浑浊,其离子方程式为CO2 +H2O +2Na++=2NaHCO3↓,故C错误;
D.铁钉浸泡在CuSO4溶液中,铁钉表面产生红色固体,说明铁能与硫酸铜发生置换反应,即Fe与CuSO4发生反应,生成硫酸亚铁和Cu,其离子方程式为Fe+Cu2+=Fe2++Cu,故D错误;
答案为A。
8.B
【解析】
①SO2不与BaCl2溶液反应,则①中无现象;②二氧化硫是酸性氧化物,能与Ba(OH)2反应生成白色沉淀亚硫酸钡,则管②中产生白色沉淀;③ SO2具有漂白性,能使品红溶液褪色,则③中品红溶液褪色;④酸性高锰酸钾溶液具有强氧化性,能够氧化二氧化硫,则④中高锰酸钾褪色;能观察到明显现象的是②③④;
答案选B。
9.(1) 分液漏斗 圆底烧瓶
(2) 溶液褪色 SO2+Cl2+2H2O=4H++2Cl-+ 还原性 2H2S+SO2=3S↓+2H2O
(3)将试管E在酒精灯上加热,溶液恢复红色
(4) 吸收多余的SO2 防止倒吸
【解析】
浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫与氯气反应生成盐酸和硫酸,二氧化硫具有还原性能够使酸性高锰酸钾褪色,二氧化硫具有氧化性,能够氧化硫化氢生成硫单质,二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫有毒,不能直接排放到空气中,能够与氢氧化钠反应生成亚硫酸钠,可以用氢氧化钠吸收过量的二氧化硫。
(1)
装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是分液漏斗、圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)
①二氧化硫与氯气反应生成盐酸和硫酸,反应后,装置B中发生的现象是溶液褪色,反应的离子方程式为SO2+Cl2+2H2O=4H++2Cl-+;
②二氧化硫具有还原性能够使C中酸性高锰酸钾褪色,装置C中的现象是溶液紫红色褪去,表现了SO2的还原性;
③二氧化硫具有氧化性,能够氧化装置D中硫化氢生成硫单质,发生反应的化学方程式为2H2S+SO2=3S↓+2H2O;
(3)
二氧化硫具有漂白性,能够使装置E中品红溶液褪色;装置E的目的是探究SO2与品红溶液作用的可逆性,实验操作及现象将试管E在酒精灯上加热,溶液恢复红色;
(4)
二氧化硫有毒不能排放到空气中,所以用氢氧化钠溶液可吸收二氧化硫,倒扣的漏斗溶液上升具有缓冲作用,能防止倒吸。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
