7.2.1 氨气 课件(14张PPT)
文档属性
| 名称 | 7.2.1 氨气 课件(14张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-18 00:50:21 | ||
图片预览






文档简介
第1课时 氨气
第二单元 重要的含氮化工原料
专题7 氮与社会可持续发展
学习目标
1.知道NH3的物理性质特点。
2.理解氨水显碱性的原因。
3.能运用化学变化的规律说明氨气的化学性质。
氨气是人工固氮的产物,也是人类制备各种含氮化合物的基础原料。与化学性质相对稳定的氮气不同,氨气容易参与多种化学反应,转化为其他含氮化合物。氮的许多化合物在工农业生产和人类生活中发挥着极为重要的作用。
硫酸铵
新课导入
硝酸铵
浓硝酸
一、氨气的实验制法
1.药品:
2.反应原理 :
3.实验装置:
4.收集方法:
NH4Cl固体和Ca(OH)2固体
固体 + 固体 → 气体
△
向下排空气法
5.验满方法:
湿润的红色石蕊,变蓝色
2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3↑ + 2H2O
△
6.棉花的作用:
防止NH3与空气对流,提高NH3的纯度和收集速度,浸湿后可吸收多余的氨气防止污染空气
基础梳理
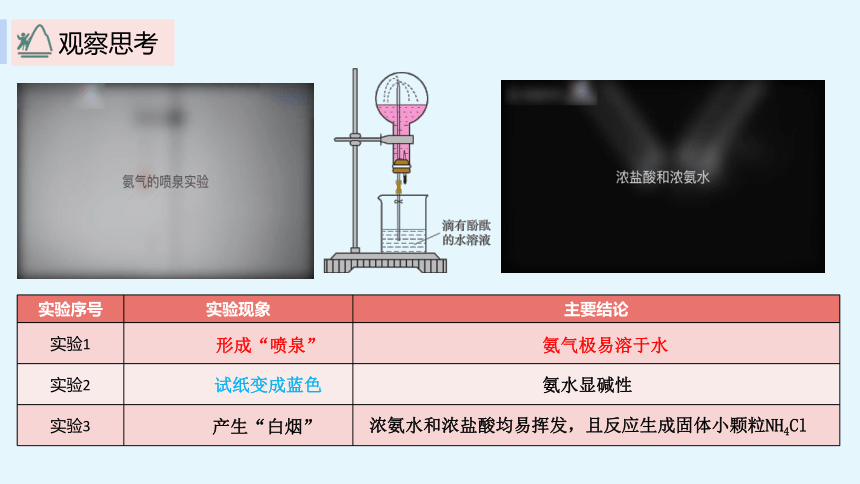
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验序号
实验现象
主要结论
实验1
实验2
实验3
形成“喷泉”
氨气极易溶于水
试纸变成蓝色
氨水显碱性
产生“白烟”
浓氨水和浓盐酸均易挥发,且反应生成固体小颗粒NH4Cl
观察思考
二、氨气的性质
1.物理性质
(1)在通常状况下是无色、具有刺激性气味的气体,密度比空气小(在标准状况下,氨的密度是0.771g·L-1);
(2)易液化,液氨在工业上常用来作制冷剂。
(3)极易溶于水,常温常压下,1体积水大约
可溶解700体积的氨气。
基础梳理
液氨制冷系统
2.化学性质
(1)与水反应
NH3 + H2O NH3·H2O
NH3·H2O NH????+ + OH-
?
氨气溶于水形成的水溶液称为氨水。
思考:氨水中含有哪些微粒?
氨水的成分:NH????+、H+ 、OH-
NH3·H2O、NH3、H2O
?
用氨水作氮肥,成本较低氨水对眼睛、呼吸道等有强烈的刺激作用,贮存、运输和施用的要求也比较高。氨水不稳定,受热易分解,产生氨气和水。
(2)与酸反应
氨水与酸反应,生成铵盐。
NH3 + HCl === NH4Cl 现象:冒“白烟”
①与HCl反应
②与HNO3反应
③与H2SO4反应
④与H3PO4反应
NH3 + HNO3 === NH4NO3 现象:冒“白烟”
2NH3 + H2SO4 ===(NH4)2SO4 无现象
3NH3 + H3PO4 ===(NH4)3PO4 无现象
铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易于被农作物吸收。固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
HNO3、HCl均是挥发性酸
(3)氨的催化氧化反应
NH3是氮的最低价(-3价)化合物,氨中的N可以失去电子,化合价升高,在一定条件下氨与氧化剂作用时作还原剂,表现出还原性。在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在下,氨与氧气反应生成一氧化氮和水,并放出热。
4NH3(g) +5 O2(g) === 4 NO(g) + 6 H2O(g) ΔH = -904 kJ·mol-1
催化剂
△
氨气的检验方法
(1)遇湿润的红色石蕊试纸变蓝色
(2)用蘸有浓盐酸的玻璃棒靠近白烟产生
归纳总结
课堂小结
1.下列有关NH3的说法正确的是( )
A.NH3溶于水后溶液能导电,故NH3是电解质
B.可用湿润的蓝色石蕊试纸检验NH3
C.NH3易液化,且液态NH3汽化时吸收大量的热,故液态NH3可做制冷剂
D.溶于水的NH3分子只有少部分电离
C
当堂过关
2.关于氨的喷泉实验形成的原理解释正确的是( )
A.氨水呈碱性
B.氨气极易溶于水,烧瓶内外形成压强差
C.氨气易液化
D.氨气溶于水后形成的溶液易挥发
B
当堂过关
本节内容结束
第二单元 重要的含氮化工原料
专题7 氮与社会可持续发展
学习目标
1.知道NH3的物理性质特点。
2.理解氨水显碱性的原因。
3.能运用化学变化的规律说明氨气的化学性质。
氨气是人工固氮的产物,也是人类制备各种含氮化合物的基础原料。与化学性质相对稳定的氮气不同,氨气容易参与多种化学反应,转化为其他含氮化合物。氮的许多化合物在工农业生产和人类生活中发挥着极为重要的作用。
硫酸铵
新课导入
硝酸铵
浓硝酸
一、氨气的实验制法
1.药品:
2.反应原理 :
3.实验装置:
4.收集方法:
NH4Cl固体和Ca(OH)2固体
固体 + 固体 → 气体
△
向下排空气法
5.验满方法:
湿润的红色石蕊,变蓝色
2NH4Cl + Ca(OH)2 === CaCl2 + 2NH3↑ + 2H2O
△
6.棉花的作用:
防止NH3与空气对流,提高NH3的纯度和收集速度,浸湿后可吸收多余的氨气防止污染空气
基础梳理
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验序号
实验现象
主要结论
实验1
实验2
实验3
形成“喷泉”
氨气极易溶于水
试纸变成蓝色
氨水显碱性
产生“白烟”
浓氨水和浓盐酸均易挥发,且反应生成固体小颗粒NH4Cl
观察思考
二、氨气的性质
1.物理性质
(1)在通常状况下是无色、具有刺激性气味的气体,密度比空气小(在标准状况下,氨的密度是0.771g·L-1);
(2)易液化,液氨在工业上常用来作制冷剂。
(3)极易溶于水,常温常压下,1体积水大约
可溶解700体积的氨气。
基础梳理
液氨制冷系统
2.化学性质
(1)与水反应
NH3 + H2O NH3·H2O
NH3·H2O NH????+ + OH-
?
氨气溶于水形成的水溶液称为氨水。
思考:氨水中含有哪些微粒?
氨水的成分:NH????+、H+ 、OH-
NH3·H2O、NH3、H2O
?
用氨水作氮肥,成本较低氨水对眼睛、呼吸道等有强烈的刺激作用,贮存、运输和施用的要求也比较高。氨水不稳定,受热易分解,产生氨气和水。
(2)与酸反应
氨水与酸反应,生成铵盐。
NH3 + HCl === NH4Cl 现象:冒“白烟”
①与HCl反应
②与HNO3反应
③与H2SO4反应
④与H3PO4反应
NH3 + HNO3 === NH4NO3 现象:冒“白烟”
2NH3 + H2SO4 ===(NH4)2SO4 无现象
3NH3 + H3PO4 ===(NH4)3PO4 无现象
铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易于被农作物吸收。固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
HNO3、HCl均是挥发性酸
(3)氨的催化氧化反应
NH3是氮的最低价(-3价)化合物,氨中的N可以失去电子,化合价升高,在一定条件下氨与氧化剂作用时作还原剂,表现出还原性。在通常情况下,氨与氧气不易反应,但在加热和催化剂(如铂丝或Cr2O3)存在下,氨与氧气反应生成一氧化氮和水,并放出热。
4NH3(g) +5 O2(g) === 4 NO(g) + 6 H2O(g) ΔH = -904 kJ·mol-1
催化剂
△
氨气的检验方法
(1)遇湿润的红色石蕊试纸变蓝色
(2)用蘸有浓盐酸的玻璃棒靠近白烟产生
归纳总结
课堂小结
1.下列有关NH3的说法正确的是( )
A.NH3溶于水后溶液能导电,故NH3是电解质
B.可用湿润的蓝色石蕊试纸检验NH3
C.NH3易液化,且液态NH3汽化时吸收大量的热,故液态NH3可做制冷剂
D.溶于水的NH3分子只有少部分电离
C
当堂过关
2.关于氨的喷泉实验形成的原理解释正确的是( )
A.氨水呈碱性
B.氨气极易溶于水,烧瓶内外形成压强差
C.氨气易液化
D.氨气溶于水后形成的溶液易挥发
B
当堂过关
本节内容结束
