8.1.3 煤的综合利用 苯 课件(37张PPT)
文档属性
| 名称 | 8.1.3 煤的综合利用 苯 课件(37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-18 00:54:45 | ||
图片预览










文档简介
(共37张PPT)
第3课时 煤的综合利用 苯
专题8 有机化合物的获得与应用
第一单元 化石燃料与有机化合物
1. 认识煤的综合利用的意义。
2. 会写苯的分子式、结构式、结构简式,知道苯分子中的碳碳键是一种介于碳碳单键与碳碳双键之间的特殊的键。
3. 知道苯能够发生氧化反应、加成反应、取代反应,并会书写相应的化学方程式。
学习目标
新课引入
煤的开采
我国是世界上最早发现煤和使用煤的国家
一、 组成
1. 成分:
H、O、N、S
2. 组成元素:
有机物和无机物组成的复杂混合物。
C
(主要)
(少量)
以及无机矿物质。
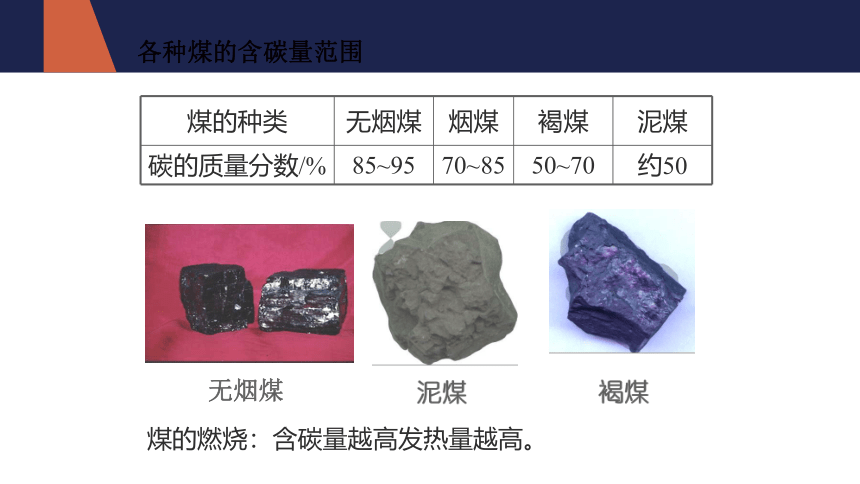
各种煤的含碳量范围
煤的种类 无烟煤 烟煤 褐煤 泥煤
碳的质量分数/% 85~95 70~85 50~70 约50
无烟煤
煤的燃烧:含碳量越高发热量越高。
思考:煤燃烧有哪些缺点?
产生大量的煤灰、煤渣、废气(二氧化硫、氮的氧化物、碳的氧化物和烟尘等)、污染环境,燃烧效率低!
二、 煤的综合利用
煤气化
碳在空气中燃烧
低值热气
中值热气
特点和用途:热值较低,用作冶金、 机械工业的燃烧气
特点和用途:热值较高,可短距离 输送。用作居民使用煤气,也可以用于合成氨
成分:CO、H2 、氮气
成分:CO、H2、少量的CH4
成分:CH4
高热值天然气
碳在氧气中燃烧
CO + 3H2 CH4 + H2O
催化剂
特点和用途:热值很高,可远距离输送
1. 煤气化:
C + H2O ==CO + H2
2. 煤的干馏:
把煤隔绝空气加强热使它分解的过程,叫做煤的干馏。
(2)U形管底部还有还有一种黑褐色粘稠的油状物生成,这是煤焦油。
煤的干馏实验装置
(1)点燃导管尖嘴处,有淡蓝 色火焰燃烧。 焦炉煤气:H2、CH4、C2H4、CO
(3)玻璃管中的烟煤粉最后变成黑灰色固体物质 这是焦炭;
焦炉气
粗氨水
煤焦油
焦炭
气:
油:
水:
固:
H2、CH4、C2H4、CO等
苯的同系物及芳香族化合物等
氨水及铵盐等
C
炼焦产品和产品的用途
“煤变油”是20世纪20年代德国的两位科学家发明的。即煤炭的液化,就是指以煤炭为原料制取汽油、柴油、液化石油气的技术。
目前,我国在建和拟建的“煤变油”项目已达1600万吨,计划投入的资金高达1200亿元。今年国家正着手制订“十一五”规划,很多省份都试图将“煤变油”项目列为重点发展项目。
煤可以变成油吗?
3. 煤的液化
煤的液化
直接液化:
间接液化:
直接液化就是煤在高温高压下加氢催化裂化,转变成油料产品。
煤的液化分直接液化和间接液化两种。
间接液化就是先使煤转化为一氧化碳和氢气,然后在高温、高压以及催化剂的作用下生成液态烃、甲醇等有机物。
煤
干馏
焦炭
煤焦油
焦炉煤气
O2、H2O(g)
水煤气
可燃气体
H2
高温、催化剂
H2O
高温
燃料油
水煤气
液态烃、甲醇等含氧有机物
气化
H2O
液化
化学变化
苯
煤的综合利用小结
19世纪欧洲许多国家都使用煤气照明,煤气通常是压缩在桶里贮运的,人们发现这种桶里总有一种油状液体,但长时间无人问津。英国科学家法拉第对这种液体产生了浓厚兴趣,他花了整整五年时间提取这种液体,从中得到了苯——一种无色油状液体。
Michael Faraday
( 1791﹣ 1867)
法拉第发现苯后,对苯的组成进行测定:他发现苯仅由碳、氢两种元素组成,其中碳的质量分数为92.3%,苯蒸气密度为同温同压下乙炔气体密度的3倍,请确定苯的分子式。
通过计算我们得到:
苯的分子式为:
C6H6
三. 苯的物理性质
1. 颜色:无色;状态:液体;气味:特殊气味。
2. 熔点:5.5℃;沸点:80.1℃(用冰冷却,苯凝结成无色晶体)。
3. 密度:比水小;溶解性:不溶于水,易溶于有机溶剂,本身也能溶解其他一些物质。
4. 毒性:有毒。
现象:
不能与Br2水反应,
但能萃取溴水中的Br2;
实验:验证苯的分子结构
结论:苯与不饱和烃的性质有很大区别。苯分子的结构中不存在碳碳双键或碳碳三键。
实验: 分别往酸性KMnO4和Br2水加入苯,振荡
酸性KMnO4不褪色;
凯库勒苯的结构
那么苯分子到底是怎么的结构呢?
凯库勒发现苯环结构的传奇—— “梦的启示”。
资料:
苯的邻二氯代物:一种
Cl
Cl
Cl
Cl
结论: 苯环中的碳碳键不是一般的单键和双键
C-C :1.54×10-10m
C=C :1.33×10-10m
1.4×10-10m
结论: 苯环中的碳碳键介于单键和双键之间
球棍模型
比例模型
结构特点:
1.具有平面正六边形结构,所有原子(十二原子)均在同一平面上;
2.苯环中所有碳碳键等同,是一种介于单键和双键之间的独特的键,碳碳键的键角是120°;
3.苯中的6个碳原子是等效的,6 个氢原子也是等效。
凯库勒结构式:
四. 苯分子的结构
分子式:
或
C6H6
根据前面研究的苯分子中的碳碳键是介于单键和双键之间的独特的键,那么苯的化学性质如何?
推测:苯具有独特的化学性质,既能发生取代反应, 又可以发生加成反应。
想一想
苯的特殊结构
苯的特殊性质
单键的性质
双键的性质
取代反应
加成反应
五、 化学性质
Br2、HNO3
H2、Cl2
介于单键和双键之间的独特的键
现象:
①导管口有白雾,滴入硝酸银溶液产生浅黄色沉淀。
②瓶底有褐色不溶于水的液体。
1. 苯的取代反应:
(1)卤代反应
-H
+Br-Br
Fe
-Br
+HBr
溴苯
苯与卤素反应比烷烃容易
苯和液溴(不能是溴水)反应,苯和溴水只发生萃取
无色比水重的油状液体
(2)硝化反应
说明:1)硝化反应,属于取代反应。
2)浓硫酸起催化和吸水作用
-H
+HO-NO2
浓H2SO4
500C~600C
-NO2
+H2O
硝基苯
水浴加热的优点:受热均匀,便于控制温度。
纯净硝基苯是无色有苦杏仁味比水重油状液体。
2. 苯的加成反应(比烯烃困难):
+3H2
Ni
加热
环己烷
3. 苯在空气中燃烧:
2C6H6 +15O2 →12CO2 + 6 H2O
现象:燃烧时发生明亮并带有浓烟的火焰
3.发生取代反应(容易);(单键的特性)
总结苯的化学性质:
1.稳定,不易被氧化;(独特的键)
2.可燃;
4.能发生加成反应(很难)。(双键的特性)
苯
苯酚
硝基苯
苯胺
环己烷
二氯苯
氯苯
苯乙烯
……
合成树脂
合成纤维
合成塑料
染料
医药
洗剂剂
炸药
……
六. 苯的用途
对比与归纳
烷 烯 苯 与Br2作用 Br2试剂
反应条件
反应类型
与KMnO4作用 点燃 现象 结论 纯溴(g)
溴水
纯溴
溴水
光照
取代
加成
催化剂
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被MnO4氧化
易被KMnO4氧化
苯环难被MnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
课堂练习
1. 下列各组物质中可以用分液漏斗分离的( )
A. 酒精与碘 B. 溴与四氯化碳
C. 硝基苯与水 D. 苯与溴苯
C
2.下列属于煤的综合利用且说法正确的是( )
A.煤中含有苯、甲苯、二甲苯等有机化合物,可采用先干馏后分馏的方法分离
B.将煤干馏制得煤焦油和焦炭
C.煤的气化和液化为物理变化
D.将煤变为煤饼作燃料
B
3. 下列说法正确的是 ( )
A.从苯的分子组成来看远没有达到饱和,所以它能使溴水褪色
B.由于苯分子组成的含碳量高,所以在空气中燃烧时,会产生明亮并带浓烟的火焰
C.一定条件下苯能发生取代反应和加成反应
D.苯是单、双键交替组成的环状结构
BC
4. 下列反应中,不属于取代反应的是( )
A. 苯与浓硫酸和浓硝酸的混合物共热
B. 苯与液溴后加入铁粉
C. 乙烯通入溴水中
D. 乙烷与氯气混合光照
C
5.下列关于苯分子结构叙述错误的是( )
A. 苯的碳原子间的键是一种介于单双键之间的特殊化学键
B. 苯分子的12个原子共平面
C. 苯环是一个单双键交替形成的六元环
D. 苯分子为一个正六边形
C
6.下列事实能证明苯分子中没有碳碳双键的是( )
A.苯不能使酸性高锰酸钾褪色
B.苯不能与溴水发生反应
C.苯环为正六边形的环
D.苯燃烧时产生大量浓烟
AB
本节内容结束
第3课时 煤的综合利用 苯
专题8 有机化合物的获得与应用
第一单元 化石燃料与有机化合物
1. 认识煤的综合利用的意义。
2. 会写苯的分子式、结构式、结构简式,知道苯分子中的碳碳键是一种介于碳碳单键与碳碳双键之间的特殊的键。
3. 知道苯能够发生氧化反应、加成反应、取代反应,并会书写相应的化学方程式。
学习目标
新课引入
煤的开采
我国是世界上最早发现煤和使用煤的国家
一、 组成
1. 成分:
H、O、N、S
2. 组成元素:
有机物和无机物组成的复杂混合物。
C
(主要)
(少量)
以及无机矿物质。
各种煤的含碳量范围
煤的种类 无烟煤 烟煤 褐煤 泥煤
碳的质量分数/% 85~95 70~85 50~70 约50
无烟煤
煤的燃烧:含碳量越高发热量越高。
思考:煤燃烧有哪些缺点?
产生大量的煤灰、煤渣、废气(二氧化硫、氮的氧化物、碳的氧化物和烟尘等)、污染环境,燃烧效率低!
二、 煤的综合利用
煤气化
碳在空气中燃烧
低值热气
中值热气
特点和用途:热值较低,用作冶金、 机械工业的燃烧气
特点和用途:热值较高,可短距离 输送。用作居民使用煤气,也可以用于合成氨
成分:CO、H2 、氮气
成分:CO、H2、少量的CH4
成分:CH4
高热值天然气
碳在氧气中燃烧
CO + 3H2 CH4 + H2O
催化剂
特点和用途:热值很高,可远距离输送
1. 煤气化:
C + H2O ==CO + H2
2. 煤的干馏:
把煤隔绝空气加强热使它分解的过程,叫做煤的干馏。
(2)U形管底部还有还有一种黑褐色粘稠的油状物生成,这是煤焦油。
煤的干馏实验装置
(1)点燃导管尖嘴处,有淡蓝 色火焰燃烧。 焦炉煤气:H2、CH4、C2H4、CO
(3)玻璃管中的烟煤粉最后变成黑灰色固体物质 这是焦炭;
焦炉气
粗氨水
煤焦油
焦炭
气:
油:
水:
固:
H2、CH4、C2H4、CO等
苯的同系物及芳香族化合物等
氨水及铵盐等
C
炼焦产品和产品的用途
“煤变油”是20世纪20年代德国的两位科学家发明的。即煤炭的液化,就是指以煤炭为原料制取汽油、柴油、液化石油气的技术。
目前,我国在建和拟建的“煤变油”项目已达1600万吨,计划投入的资金高达1200亿元。今年国家正着手制订“十一五”规划,很多省份都试图将“煤变油”项目列为重点发展项目。
煤可以变成油吗?
3. 煤的液化
煤的液化
直接液化:
间接液化:
直接液化就是煤在高温高压下加氢催化裂化,转变成油料产品。
煤的液化分直接液化和间接液化两种。
间接液化就是先使煤转化为一氧化碳和氢气,然后在高温、高压以及催化剂的作用下生成液态烃、甲醇等有机物。
煤
干馏
焦炭
煤焦油
焦炉煤气
O2、H2O(g)
水煤气
可燃气体
H2
高温、催化剂
H2O
高温
燃料油
水煤气
液态烃、甲醇等含氧有机物
气化
H2O
液化
化学变化
苯
煤的综合利用小结
19世纪欧洲许多国家都使用煤气照明,煤气通常是压缩在桶里贮运的,人们发现这种桶里总有一种油状液体,但长时间无人问津。英国科学家法拉第对这种液体产生了浓厚兴趣,他花了整整五年时间提取这种液体,从中得到了苯——一种无色油状液体。
Michael Faraday
( 1791﹣ 1867)
法拉第发现苯后,对苯的组成进行测定:他发现苯仅由碳、氢两种元素组成,其中碳的质量分数为92.3%,苯蒸气密度为同温同压下乙炔气体密度的3倍,请确定苯的分子式。
通过计算我们得到:
苯的分子式为:
C6H6
三. 苯的物理性质
1. 颜色:无色;状态:液体;气味:特殊气味。
2. 熔点:5.5℃;沸点:80.1℃(用冰冷却,苯凝结成无色晶体)。
3. 密度:比水小;溶解性:不溶于水,易溶于有机溶剂,本身也能溶解其他一些物质。
4. 毒性:有毒。
现象:
不能与Br2水反应,
但能萃取溴水中的Br2;
实验:验证苯的分子结构
结论:苯与不饱和烃的性质有很大区别。苯分子的结构中不存在碳碳双键或碳碳三键。
实验: 分别往酸性KMnO4和Br2水加入苯,振荡
酸性KMnO4不褪色;
凯库勒苯的结构
那么苯分子到底是怎么的结构呢?
凯库勒发现苯环结构的传奇—— “梦的启示”。
资料:
苯的邻二氯代物:一种
Cl
Cl
Cl
Cl
结论: 苯环中的碳碳键不是一般的单键和双键
C-C :1.54×10-10m
C=C :1.33×10-10m
1.4×10-10m
结论: 苯环中的碳碳键介于单键和双键之间
球棍模型
比例模型
结构特点:
1.具有平面正六边形结构,所有原子(十二原子)均在同一平面上;
2.苯环中所有碳碳键等同,是一种介于单键和双键之间的独特的键,碳碳键的键角是120°;
3.苯中的6个碳原子是等效的,6 个氢原子也是等效。
凯库勒结构式:
四. 苯分子的结构
分子式:
或
C6H6
根据前面研究的苯分子中的碳碳键是介于单键和双键之间的独特的键,那么苯的化学性质如何?
推测:苯具有独特的化学性质,既能发生取代反应, 又可以发生加成反应。
想一想
苯的特殊结构
苯的特殊性质
单键的性质
双键的性质
取代反应
加成反应
五、 化学性质
Br2、HNO3
H2、Cl2
介于单键和双键之间的独特的键
现象:
①导管口有白雾,滴入硝酸银溶液产生浅黄色沉淀。
②瓶底有褐色不溶于水的液体。
1. 苯的取代反应:
(1)卤代反应
-H
+Br-Br
Fe
-Br
+HBr
溴苯
苯与卤素反应比烷烃容易
苯和液溴(不能是溴水)反应,苯和溴水只发生萃取
无色比水重的油状液体
(2)硝化反应
说明:1)硝化反应,属于取代反应。
2)浓硫酸起催化和吸水作用
-H
+HO-NO2
浓H2SO4
500C~600C
-NO2
+H2O
硝基苯
水浴加热的优点:受热均匀,便于控制温度。
纯净硝基苯是无色有苦杏仁味比水重油状液体。
2. 苯的加成反应(比烯烃困难):
+3H2
Ni
加热
环己烷
3. 苯在空气中燃烧:
2C6H6 +15O2 →12CO2 + 6 H2O
现象:燃烧时发生明亮并带有浓烟的火焰
3.发生取代反应(容易);(单键的特性)
总结苯的化学性质:
1.稳定,不易被氧化;(独特的键)
2.可燃;
4.能发生加成反应(很难)。(双键的特性)
苯
苯酚
硝基苯
苯胺
环己烷
二氯苯
氯苯
苯乙烯
……
合成树脂
合成纤维
合成塑料
染料
医药
洗剂剂
炸药
……
六. 苯的用途
对比与归纳
烷 烯 苯 与Br2作用 Br2试剂
反应条件
反应类型
与KMnO4作用 点燃 现象 结论 纯溴(g)
溴水
纯溴
溴水
光照
取代
加成
催化剂
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被MnO4氧化
易被KMnO4氧化
苯环难被MnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
课堂练习
1. 下列各组物质中可以用分液漏斗分离的( )
A. 酒精与碘 B. 溴与四氯化碳
C. 硝基苯与水 D. 苯与溴苯
C
2.下列属于煤的综合利用且说法正确的是( )
A.煤中含有苯、甲苯、二甲苯等有机化合物,可采用先干馏后分馏的方法分离
B.将煤干馏制得煤焦油和焦炭
C.煤的气化和液化为物理变化
D.将煤变为煤饼作燃料
B
3. 下列说法正确的是 ( )
A.从苯的分子组成来看远没有达到饱和,所以它能使溴水褪色
B.由于苯分子组成的含碳量高,所以在空气中燃烧时,会产生明亮并带浓烟的火焰
C.一定条件下苯能发生取代反应和加成反应
D.苯是单、双键交替组成的环状结构
BC
4. 下列反应中,不属于取代反应的是( )
A. 苯与浓硫酸和浓硝酸的混合物共热
B. 苯与液溴后加入铁粉
C. 乙烯通入溴水中
D. 乙烷与氯气混合光照
C
5.下列关于苯分子结构叙述错误的是( )
A. 苯的碳原子间的键是一种介于单双键之间的特殊化学键
B. 苯分子的12个原子共平面
C. 苯环是一个单双键交替形成的六元环
D. 苯分子为一个正六边形
C
6.下列事实能证明苯分子中没有碳碳双键的是( )
A.苯不能使酸性高锰酸钾褪色
B.苯不能与溴水发生反应
C.苯环为正六边形的环
D.苯燃烧时产生大量浓烟
AB
本节内容结束
