2021-2022学年度人教版九年级化学下册课件 10.1.2 酸的化学性质(共12张PPT内嵌视频)
文档属性
| 名称 | 2021-2022学年度人教版九年级化学下册课件 10.1.2 酸的化学性质(共12张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-18 15:01:11 | ||
图片预览




文档简介
(共12张PPT)
第十单元 酸和碱
课题1 常见的酸和碱
第二课时 酸的化学性质
九年级化学人教版
新课引入
在焊接金属钢板之前,首先要用少量稀盐酸来擦拭金属表面,你能解释其中的道理吗?
金属表面会生锈,不及时除去,会影响焊接的牢固程度。因此,可以使用稀盐酸来除去金属表面的锈。
新课讲解
一、盐酸和硫酸的化学性质
新课讲解
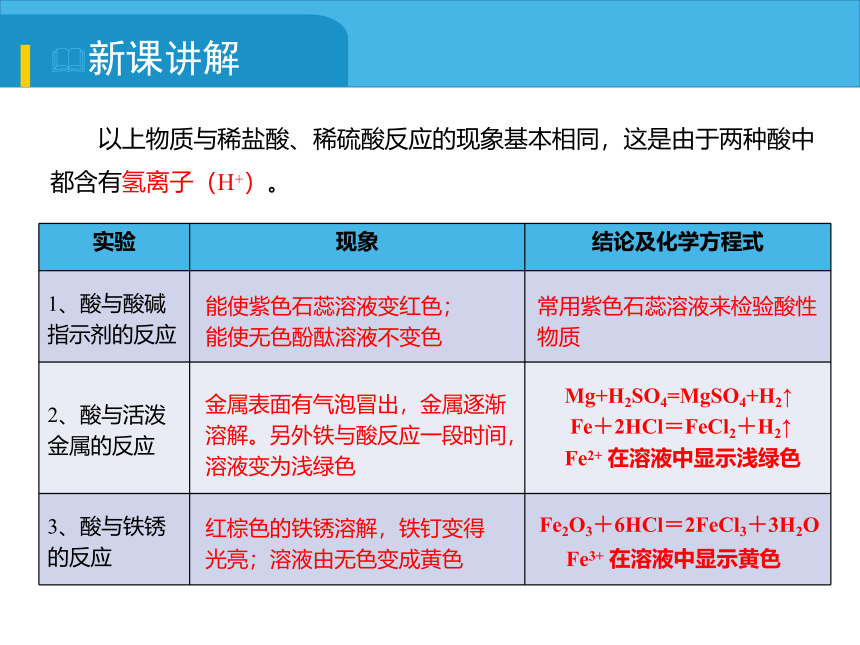
以上物质与稀盐酸、稀硫酸反应的现象基本相同,这是由于两种酸中都含有氢离子(H+)。
实验 现象 结论及化学方程式
1、酸与酸碱指示剂的反应
2、酸与活泼金属的反应
3、酸与铁锈的反应
能使紫色石蕊溶液变红色;
能使无色酚酞溶液不变色
常用紫色石蕊溶液来检验酸性物质
金属表面有气泡冒出,金属逐渐溶解。另外铁与酸反应一段时间,溶液变为浅绿色
红棕色的铁锈溶解,铁钉变得光亮;溶液由无色变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
Fe3+ 在溶液中显示黄色
Mg+H2SO4=MgSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe2+ 在溶液中显示浅绿色
新课讲解
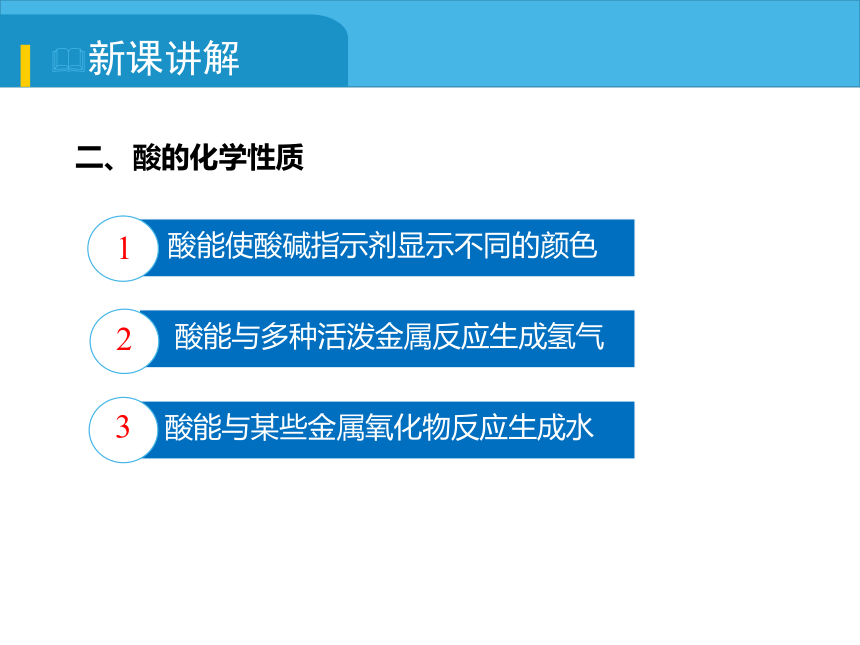
二、酸的化学性质
酸能使酸碱指示剂显示不同的颜色
1
酸能与多种活泼金属反应生成氢气
2
酸能与某些金属氧化物反应生成水
3
新课讲解
【思考】利用稀盐酸可以除去铁制品表面的锈,除锈时能否将铁制品长时间浸在酸中?为什么?
铁锈的主要成分为氧化铁,氧化铁能与稀盐酸反应生成可溶性的氯化铁和水,当铁锈除去后,金属铁会继续与稀盐酸发生反应,导致铁制品被腐蚀。因此除锈时不能将铁制品长时间浸在酸中。
涉及到的化学方程式为:
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
归纳小结
1、稀盐酸、稀硫酸都含有氢离子,因此许多化学性质相似;
2、酸能与酸碱指示剂、活泼金属以及金属氧化物发生化学反应。
强化训练
1、从物质的组成角度解释酸具有相似化学性质的原因是( )
A.酸都含有酸根 B.酸都能在水中解离出H+
C.酸中都含有氢气 D.酸中都含有氧元素
B
【解析】
酸溶液具有相似化学性质的原因是在水溶液中都能解离出氢离子,而不是含有酸根,且酸中不含氢气,也不是酸中都含有氧元素。
强化训练
2、下列试管壁内残留的固体物质不能用稀盐酸除去的是( )
A.盛放过生锈铁钉后留下的红棕色固体
B.装氧化铜粉末后留下的黑色固体
C.用氢气还原氧化铜实验后试管壁上留下的紫红色固体
D.用澄清石灰水检验CO2后留下的白色固体
C
【解析】 A、盛放过生锈铁钉后留下的红棕色固体是铁锈,主要成分是氧化铁,氧化铁能与盐酸反应生成可溶性的氯化铁,故可洗去;
B、装氧化铜粉末后留下的黑色固体是氧化铜,氧化铜可以与盐酸反应生成可溶性的氯化铜,所以能被洗掉;
C、用氢气还原氧化铜实验后试管壁上留下的紫红色固体是铜,铜不能与盐酸反应,因此不能除掉;
D、用澄清石灰水检验CO2后留下的白色固体是碳酸钙,碳酸钙可以与盐酸反应生成可溶性的氯化钙,所以可以除掉。
强化训练
3、向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
A
【解析】A、氧化铁和盐酸反应生成氯化铁和水,所以溶液中铁元素的质量从零开始逐渐增加,然后不变,故A正确;B、氧化铁和盐酸反应生成氯化铁和水,随着盐酸的加入,固体质量会逐渐减小到零,故B错误;C、开始时,氧化铁和盐酸反应生成氯化铁和水,溶液质量增加较快,当氧化铁反应完后,溶液增加较慢,所以图像应该是先陡后缓,故C错误;D、氧化铁和盐酸反应生成氯化铁和水,溶剂的质量开始增加的多,完全反应后,溶剂的质量增加的就少了,故D错误。
布置作业
将铜丝放到酒精灯火焰上加热一段时间后,会观察到什么现象?将变化后的铜丝趁热伸入盛有稀硫酸的试管中,一段时间后,取出铜丝,会观察到哪些现象?请用本节课所学的知识来分析其中的原理吧。
本课结束
第十单元 酸和碱
课题1 常见的酸和碱
第二课时 酸的化学性质
九年级化学人教版
新课引入
在焊接金属钢板之前,首先要用少量稀盐酸来擦拭金属表面,你能解释其中的道理吗?
金属表面会生锈,不及时除去,会影响焊接的牢固程度。因此,可以使用稀盐酸来除去金属表面的锈。
新课讲解
一、盐酸和硫酸的化学性质
新课讲解
以上物质与稀盐酸、稀硫酸反应的现象基本相同,这是由于两种酸中都含有氢离子(H+)。
实验 现象 结论及化学方程式
1、酸与酸碱指示剂的反应
2、酸与活泼金属的反应
3、酸与铁锈的反应
能使紫色石蕊溶液变红色;
能使无色酚酞溶液不变色
常用紫色石蕊溶液来检验酸性物质
金属表面有气泡冒出,金属逐渐溶解。另外铁与酸反应一段时间,溶液变为浅绿色
红棕色的铁锈溶解,铁钉变得光亮;溶液由无色变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
Fe3+ 在溶液中显示黄色
Mg+H2SO4=MgSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe2+ 在溶液中显示浅绿色
新课讲解
二、酸的化学性质
酸能使酸碱指示剂显示不同的颜色
1
酸能与多种活泼金属反应生成氢气
2
酸能与某些金属氧化物反应生成水
3
新课讲解
【思考】利用稀盐酸可以除去铁制品表面的锈,除锈时能否将铁制品长时间浸在酸中?为什么?
铁锈的主要成分为氧化铁,氧化铁能与稀盐酸反应生成可溶性的氯化铁和水,当铁锈除去后,金属铁会继续与稀盐酸发生反应,导致铁制品被腐蚀。因此除锈时不能将铁制品长时间浸在酸中。
涉及到的化学方程式为:
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
归纳小结
1、稀盐酸、稀硫酸都含有氢离子,因此许多化学性质相似;
2、酸能与酸碱指示剂、活泼金属以及金属氧化物发生化学反应。
强化训练
1、从物质的组成角度解释酸具有相似化学性质的原因是( )
A.酸都含有酸根 B.酸都能在水中解离出H+
C.酸中都含有氢气 D.酸中都含有氧元素
B
【解析】
酸溶液具有相似化学性质的原因是在水溶液中都能解离出氢离子,而不是含有酸根,且酸中不含氢气,也不是酸中都含有氧元素。
强化训练
2、下列试管壁内残留的固体物质不能用稀盐酸除去的是( )
A.盛放过生锈铁钉后留下的红棕色固体
B.装氧化铜粉末后留下的黑色固体
C.用氢气还原氧化铜实验后试管壁上留下的紫红色固体
D.用澄清石灰水检验CO2后留下的白色固体
C
【解析】 A、盛放过生锈铁钉后留下的红棕色固体是铁锈,主要成分是氧化铁,氧化铁能与盐酸反应生成可溶性的氯化铁,故可洗去;
B、装氧化铜粉末后留下的黑色固体是氧化铜,氧化铜可以与盐酸反应生成可溶性的氯化铜,所以能被洗掉;
C、用氢气还原氧化铜实验后试管壁上留下的紫红色固体是铜,铜不能与盐酸反应,因此不能除掉;
D、用澄清石灰水检验CO2后留下的白色固体是碳酸钙,碳酸钙可以与盐酸反应生成可溶性的氯化钙,所以可以除掉。
强化训练
3、向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
A
【解析】A、氧化铁和盐酸反应生成氯化铁和水,所以溶液中铁元素的质量从零开始逐渐增加,然后不变,故A正确;B、氧化铁和盐酸反应生成氯化铁和水,随着盐酸的加入,固体质量会逐渐减小到零,故B错误;C、开始时,氧化铁和盐酸反应生成氯化铁和水,溶液质量增加较快,当氧化铁反应完后,溶液增加较慢,所以图像应该是先陡后缓,故C错误;D、氧化铁和盐酸反应生成氯化铁和水,溶剂的质量开始增加的多,完全反应后,溶剂的质量增加的就少了,故D错误。
布置作业
将铜丝放到酒精灯火焰上加热一段时间后,会观察到什么现象?将变化后的铜丝趁热伸入盛有稀硫酸的试管中,一段时间后,取出铜丝,会观察到哪些现象?请用本节课所学的知识来分析其中的原理吧。
本课结束
同课章节目录
