【新教材】高中化学必修一 同步精讲课件 1.3氧化还原反应(共2课时)
文档属性
| 名称 | 【新教材】高中化学必修一 同步精讲课件 1.3氧化还原反应(共2课时) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-19 00:00:00 | ||
图片预览










文档简介
(共32张PPT)
高中化学 RJ版 必修 第一册
1.初步掌握根据化合价的变化和电子转移的观点分析氧化还原反应的方法。
2.会用化合价的变化和电子转移的观点判断氧化还原反应,理解氧化还原反应的实质。
第三 节 氧化还原反应
学习目标
第1课时 氧化还原反应
一 氧化还原反应中概念间的关系
概念间的关系图
记忆口诀:
氧→得→降→还→还
还→失→升→氧→氧
即:氧化剂→得到电子→所含元素化合价降低→被还原→发生还原反应。
还原剂→失去电子→所含元素化合价升高→被氧化→发生氧化反应。
例1
例2
下列反应不属于氧化还原反应的是( )
A.+3HCl═
B.(g)
C.═+NO
D.═HCl+HClO
【解析】A.该反应是复分解反应,无元素化合价变化,则不属于氧化还原反应。
【答案】A
变式
下列反应属于氧化还原反应的是( B )
A.NH3+HCl==NH4Cl
B.Cl2+8NH3==6NH4Cl+N2
C.Na2O2+2H2O==H2O2+2NaOH
D.2NaHCO3 Na2CO3+H2O+CO2↑
二 氧化还原反应电子转移的表示方法
双线桥法
表示意义:表示反应前后同一元素原子间电子转移情况。
基本步骤
如
注意事项
1.箭头、箭尾必须对应化合价变化的同种元素的原子。
2.必须注明“得”或“失”。
3.氧化剂和还原剂得、失电子总数要相等。
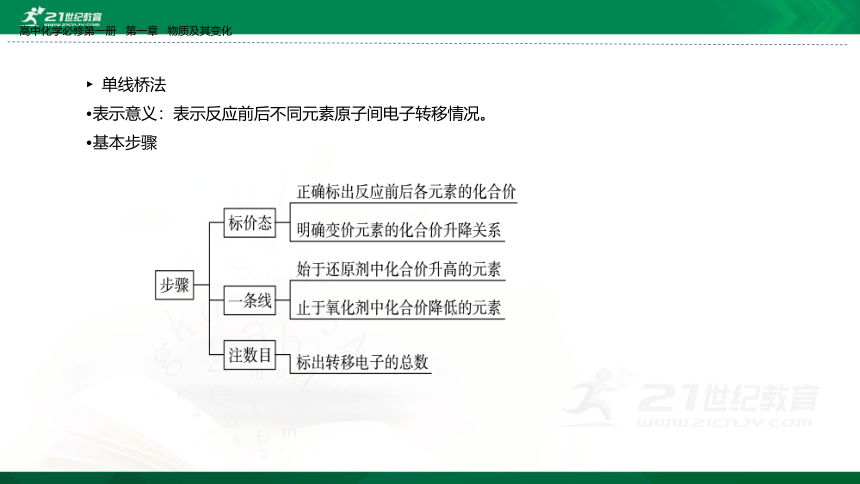
单线桥法
表示意义:表示反应前后不同元素原子间电子转移情况。
基本步骤
如
注意事项:
1.单线桥表示反应物中变价元素原子得失电子的情况。
2.不需标明“得”或“失”,只标明电子转移数目。
3.箭头标明电子转移的方向。
4.单线桥箭头从失电子的元素原子指向得电子的元素原子。
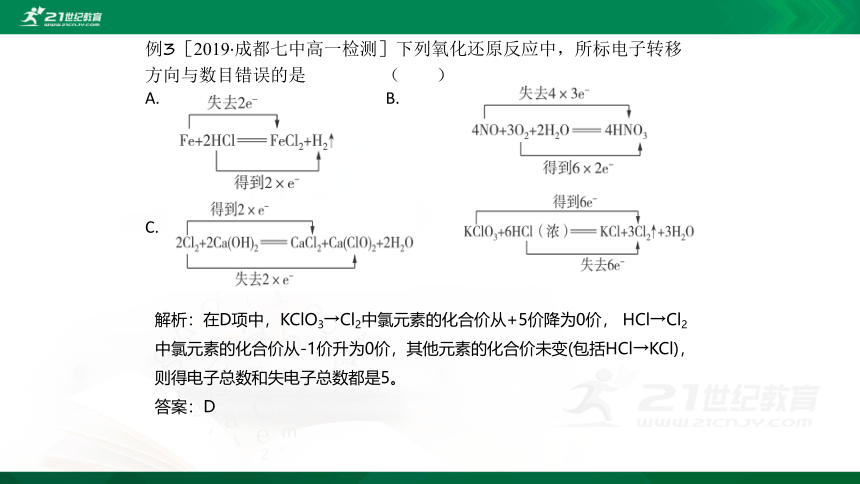
例3[2019·成都七中高一检测]下列氧化还原反应中,所标电子转移方向与数目错误的是 ( )
A. B.
D.
解析:在D项中,KClO3→Cl2中氯元素的化合价从+5价降为0价, HCl→Cl2中氯元素的化合价从-1价升为0价,其他元素的化合价未变(包括HCl→KCl),则得电子总数和失电子总数都是5。
答案:D
例 4
钛和钛合金在航空工业有重要的应用。冶炼钛的过程中发生反应之一是 +2CO。下列说法中正确的是( )
A.该反应中,C元素被还原,Cl元素被氧化
B.该反应中Ti元素的化合价升高
C.和均发生还原反应
D.C发生氧化反应生成CO
【解析】
A错:C元素被氧化,Cl元素被还原。
B错:和中Ti元素均显+4价,则Ti元素的化合价未发生变化。
C错:发生还原反应。
【答案】D
变式 (双选)
+16HCl(浓) ═↑
2。下列说法中正确的是( CD )
A.HCl在反应中被还原
B.在反应中被氧化
C.该反应中的电子转移数可记作10e-
D.在HCl→Cl2中,Cl-的转化率是62.5%
解析: HCl→Cl2中氯元素化合价升高,HCl被氧化;KMnO4→MnCl2中锰元素化合价降低,KMnO4被还原,则A和B均错误。
2KMnO4→2MnCl2中锰元素降价总数是10价,由此展开分析可知C正确。
16HCl→5Cl2,16HCl→2KCl+2MnCl2,则HCl→Cl2中Cl-的转化率:10÷16=
0.625=62.5%。
三 氧化还原反应与四种基本类型反应的关系
关系表解
反应类型 氧化还原 反应实例 非氧化还 原反应实例 结论
化合反应 A+B═AB 有单质参加的化合反应全部是氧化还原反应
分解反应 AB═A+B 有单质生成的分解反应全部是氧化还原反应
置换反应 A+BC═ AC+B — 置换反应全部是氧化还原反应
复分解反应 AB+CD═ AD+CB — 复分解反应都不是氧化还原反应
【说明】 四种基本类型反应不包含所有的化学反应,如+2NaOH═不属于四种基本类型反应中的任何一种,但它有元素化合价的升降,属于氧化还原反应。
关系图解
例5
例6 下列反应中,既属于化合反应,又属于氧化还原反应的是( B )
A.在水溶液中NH3和HCl反应生成NH4Cl
B.和点燃生成
C.溶液与盐酸的反应
D.高温分解生成CaO和
【解析】
属于化合反应的是A和B,其中属于氧化还原反应的是B。
1.学会判断氧化剂、还原剂、氧化产物、还原产物。
2.了解氧化还原反应的应用
第三节 氧化还原反应
学习目标
第2课时 氧化剂和还原剂
一 常见氧化剂和还原剂
常见的氧化剂
注意事项:浓有强氧化性,稀无强氧化性。
常见的还原剂
【说明】 了解常见氧化剂及对应还原产物、常见还原剂及对应氧化产物,有助于书写氧化还原反应方程式。
例1
【解析】H2O作氧化剂的化学反应一定是氧化还原反应,并且是H2O中的+1价H化合价发生了下降。
【答案】A
例 2
在氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与==
+2HBr相比较,水的作用不相同的是( )
A.C 2
B.═
C.═
D.═HCl+HClO
【解析】
═+2HBr中的既不是氧化剂又不是还原剂。A中的
B和D中的既不是氧化剂又不是还原剂。是还原剂。
【答案】C
【拓展】在电解H2O生成H2和O2的反应中,H2O既是氧化剂又是还原剂。
变式
在从海水中提取溴的过程中有化学反应:+
═。下列化学反应中,与上述化学反应最相似的是( C )
A.═
B.═↓+3NaCl
C.═+3S↓
D.
答案:C
解析:题干中的化学反应是氧化还原反应,则排除B。
题干中的化学反应,化合价降低和升高的元素分别是+5价溴和-1价溴,这种氧化还原反应又叫做“归中反应”。C中的化学反应是氧化还原反应,并且化合价降低和升高的元素分别是+4价硫和-2价硫。
二、 氧化还原反应中的概念之间的关系
例3
例4
例5
【走向高考】
例1 [2017·海南卷]在酸性条件下,可发生如下反应:ClO3-+2M3++4H2O =M2O7n-+Cl-+8H+,M2O7n-中M的化合价是 ( )
A. +4 B. +5 C. +6 D. +7
解析:该反应为氧化还原反应,符合得失电子守恒的规律。Cl元素由+5价→ -1价,降低6价,设M2O7n-中M的化合价为x,由得失电子守恒得:6=2×(x-3),则x=6。
答案:C
例2 [2015·海南卷]已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH- =2RO4n-+3Cl-+5H2O,则RO4n-中R的化合价是 ( )
A. +3 B. +4 C. +5 D. +6
解析:根据离子电荷守恒可知n=2,则R的化合价为+6。
答案:D
例3 [高考题组合](1)[2017·江苏卷]NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为 。
(2)[2017·全国Ⅲ卷]工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式 。
解析:(1)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,Ag、O元素的化合价升高,Cl元素的化合价降低,由得失电子守恒、原子守恒可知该反应的化学方程式为4Ag+4NaClO+2H2O= 4AgCl+4NaOH+O2↑。
(2)As2S3与O2反应生成H3AsO4和S,砷元素的化合价由+3价升高为+5价,硫元素的化合价由-2价升高为0价,氧元素的化合价由0价降低为-2价,由得失电子守恒、原子守恒可知该反应的化学方程式为2As2S3+5O2+6H2O =4H3AsO4+6S。
答案:(1)4Ag+4NaClO+2H2O =4AgCl+4NaOH+O2↑
(2)2As2S3+5O2+6H2O= 4H3AsO4+6S
【戮力同心 共赴前程】
生如蝼蚁当立鸿鹄之志
命如纸薄应有不屈之心
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
高中化学 RJ版 必修 第一册
1.初步掌握根据化合价的变化和电子转移的观点分析氧化还原反应的方法。
2.会用化合价的变化和电子转移的观点判断氧化还原反应,理解氧化还原反应的实质。
第三 节 氧化还原反应
学习目标
第1课时 氧化还原反应
一 氧化还原反应中概念间的关系
概念间的关系图
记忆口诀:
氧→得→降→还→还
还→失→升→氧→氧
即:氧化剂→得到电子→所含元素化合价降低→被还原→发生还原反应。
还原剂→失去电子→所含元素化合价升高→被氧化→发生氧化反应。
例1
例2
下列反应不属于氧化还原反应的是( )
A.+3HCl═
B.(g)
C.═+NO
D.═HCl+HClO
【解析】A.该反应是复分解反应,无元素化合价变化,则不属于氧化还原反应。
【答案】A
变式
下列反应属于氧化还原反应的是( B )
A.NH3+HCl==NH4Cl
B.Cl2+8NH3==6NH4Cl+N2
C.Na2O2+2H2O==H2O2+2NaOH
D.2NaHCO3 Na2CO3+H2O+CO2↑
二 氧化还原反应电子转移的表示方法
双线桥法
表示意义:表示反应前后同一元素原子间电子转移情况。
基本步骤
如
注意事项
1.箭头、箭尾必须对应化合价变化的同种元素的原子。
2.必须注明“得”或“失”。
3.氧化剂和还原剂得、失电子总数要相等。
单线桥法
表示意义:表示反应前后不同元素原子间电子转移情况。
基本步骤
如
注意事项:
1.单线桥表示反应物中变价元素原子得失电子的情况。
2.不需标明“得”或“失”,只标明电子转移数目。
3.箭头标明电子转移的方向。
4.单线桥箭头从失电子的元素原子指向得电子的元素原子。
例3[2019·成都七中高一检测]下列氧化还原反应中,所标电子转移方向与数目错误的是 ( )
A. B.
D.
解析:在D项中,KClO3→Cl2中氯元素的化合价从+5价降为0价, HCl→Cl2中氯元素的化合价从-1价升为0价,其他元素的化合价未变(包括HCl→KCl),则得电子总数和失电子总数都是5。
答案:D
例 4
钛和钛合金在航空工业有重要的应用。冶炼钛的过程中发生反应之一是 +2CO。下列说法中正确的是( )
A.该反应中,C元素被还原,Cl元素被氧化
B.该反应中Ti元素的化合价升高
C.和均发生还原反应
D.C发生氧化反应生成CO
【解析】
A错:C元素被氧化,Cl元素被还原。
B错:和中Ti元素均显+4价,则Ti元素的化合价未发生变化。
C错:发生还原反应。
【答案】D
变式 (双选)
+16HCl(浓) ═↑
2。下列说法中正确的是( CD )
A.HCl在反应中被还原
B.在反应中被氧化
C.该反应中的电子转移数可记作10e-
D.在HCl→Cl2中,Cl-的转化率是62.5%
解析: HCl→Cl2中氯元素化合价升高,HCl被氧化;KMnO4→MnCl2中锰元素化合价降低,KMnO4被还原,则A和B均错误。
2KMnO4→2MnCl2中锰元素降价总数是10价,由此展开分析可知C正确。
16HCl→5Cl2,16HCl→2KCl+2MnCl2,则HCl→Cl2中Cl-的转化率:10÷16=
0.625=62.5%。
三 氧化还原反应与四种基本类型反应的关系
关系表解
反应类型 氧化还原 反应实例 非氧化还 原反应实例 结论
化合反应 A+B═AB 有单质参加的化合反应全部是氧化还原反应
分解反应 AB═A+B 有单质生成的分解反应全部是氧化还原反应
置换反应 A+BC═ AC+B — 置换反应全部是氧化还原反应
复分解反应 AB+CD═ AD+CB — 复分解反应都不是氧化还原反应
【说明】 四种基本类型反应不包含所有的化学反应,如+2NaOH═不属于四种基本类型反应中的任何一种,但它有元素化合价的升降,属于氧化还原反应。
关系图解
例5
例6 下列反应中,既属于化合反应,又属于氧化还原反应的是( B )
A.在水溶液中NH3和HCl反应生成NH4Cl
B.和点燃生成
C.溶液与盐酸的反应
D.高温分解生成CaO和
【解析】
属于化合反应的是A和B,其中属于氧化还原反应的是B。
1.学会判断氧化剂、还原剂、氧化产物、还原产物。
2.了解氧化还原反应的应用
第三节 氧化还原反应
学习目标
第2课时 氧化剂和还原剂
一 常见氧化剂和还原剂
常见的氧化剂
注意事项:浓有强氧化性,稀无强氧化性。
常见的还原剂
【说明】 了解常见氧化剂及对应还原产物、常见还原剂及对应氧化产物,有助于书写氧化还原反应方程式。
例1
【解析】H2O作氧化剂的化学反应一定是氧化还原反应,并且是H2O中的+1价H化合价发生了下降。
【答案】A
例 2
在氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与==
+2HBr相比较,水的作用不相同的是( )
A.C 2
B.═
C.═
D.═HCl+HClO
【解析】
═+2HBr中的既不是氧化剂又不是还原剂。A中的
B和D中的既不是氧化剂又不是还原剂。是还原剂。
【答案】C
【拓展】在电解H2O生成H2和O2的反应中,H2O既是氧化剂又是还原剂。
变式
在从海水中提取溴的过程中有化学反应:+
═。下列化学反应中,与上述化学反应最相似的是( C )
A.═
B.═↓+3NaCl
C.═+3S↓
D.
答案:C
解析:题干中的化学反应是氧化还原反应,则排除B。
题干中的化学反应,化合价降低和升高的元素分别是+5价溴和-1价溴,这种氧化还原反应又叫做“归中反应”。C中的化学反应是氧化还原反应,并且化合价降低和升高的元素分别是+4价硫和-2价硫。
二、 氧化还原反应中的概念之间的关系
例3
例4
例5
【走向高考】
例1 [2017·海南卷]在酸性条件下,可发生如下反应:ClO3-+2M3++4H2O =M2O7n-+Cl-+8H+,M2O7n-中M的化合价是 ( )
A. +4 B. +5 C. +6 D. +7
解析:该反应为氧化还原反应,符合得失电子守恒的规律。Cl元素由+5价→ -1价,降低6价,设M2O7n-中M的化合价为x,由得失电子守恒得:6=2×(x-3),则x=6。
答案:C
例2 [2015·海南卷]已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH- =2RO4n-+3Cl-+5H2O,则RO4n-中R的化合价是 ( )
A. +3 B. +4 C. +5 D. +6
解析:根据离子电荷守恒可知n=2,则R的化合价为+6。
答案:D
例3 [高考题组合](1)[2017·江苏卷]NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为 。
(2)[2017·全国Ⅲ卷]工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式 。
解析:(1)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,Ag、O元素的化合价升高,Cl元素的化合价降低,由得失电子守恒、原子守恒可知该反应的化学方程式为4Ag+4NaClO+2H2O= 4AgCl+4NaOH+O2↑。
(2)As2S3与O2反应生成H3AsO4和S,砷元素的化合价由+3价升高为+5价,硫元素的化合价由-2价升高为0价,氧元素的化合价由0价降低为-2价,由得失电子守恒、原子守恒可知该反应的化学方程式为2As2S3+5O2+6H2O =4H3AsO4+6S。
答案:(1)4Ag+4NaClO+2H2O =4AgCl+4NaOH+O2↑
(2)2As2S3+5O2+6H2O= 4H3AsO4+6S
【戮力同心 共赴前程】
生如蝼蚁当立鸿鹄之志
命如纸薄应有不屈之心
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
