第二章 化学物质及其变化
图片预览
文档简介
第二章 化学物质及其变化
教学目的1:
1. 巩固学习化学实验中知识,强化训练。
2. 重点学习混合物的几种分离和提纯方法及离子的检验方法。
3. 树立安全意识。
教学课时:
1.5课时
知识体系 1
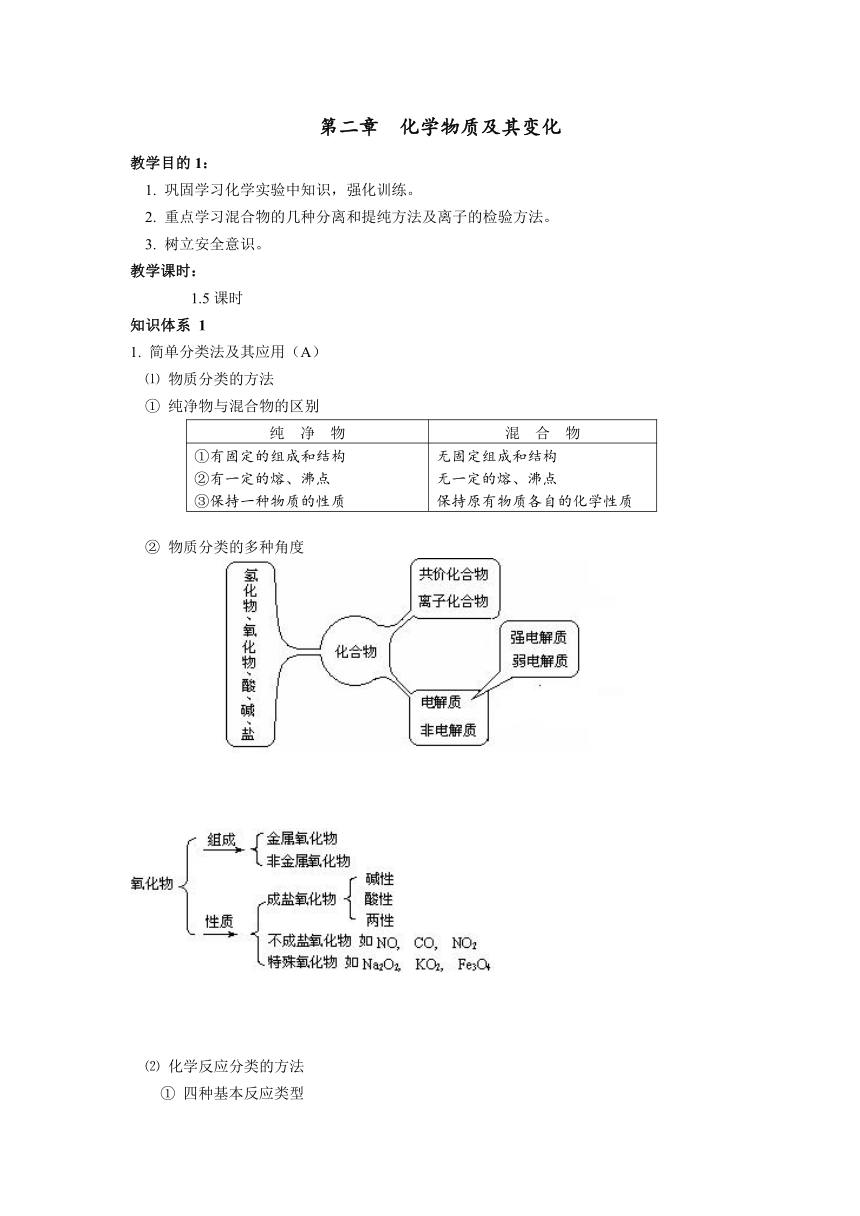
1. 简单分类法及其应用(A)
⑴ 物质分类的方法
① 纯净物与混合物的区别
纯 净 物
混 合 物
①有固定的组成和结构
②有一定的熔、沸点
③保持一种物质的性质
无固定组成和结构
无一定的熔、沸点
保持原有物质各自的化学性质
② 物质分类的多种角度
⑵ 化学反应分类的方法
① 四种基本反应类型
反应类型
举 例
表 示 式
化合反应
C+O2 CO2
A+B==AB
分解反应
CaCO3 CaO+CO2↑
AB==A+B
置换反应
C+CuO Cu+CO↑
A+BC==AC+B
复分解反应
AgNO3+NaCl==AgCl↓+NaNO3
AB+CD==AD+CB
② 根据化合价是否变化 —— 氧化还原反应和非氧化还原反应
③ 四种基本反应类型与氧化还原反应(或非氧化还原反应)的关系
④ 根据反应中是否有离子参与 —— 离子反应和分子反应
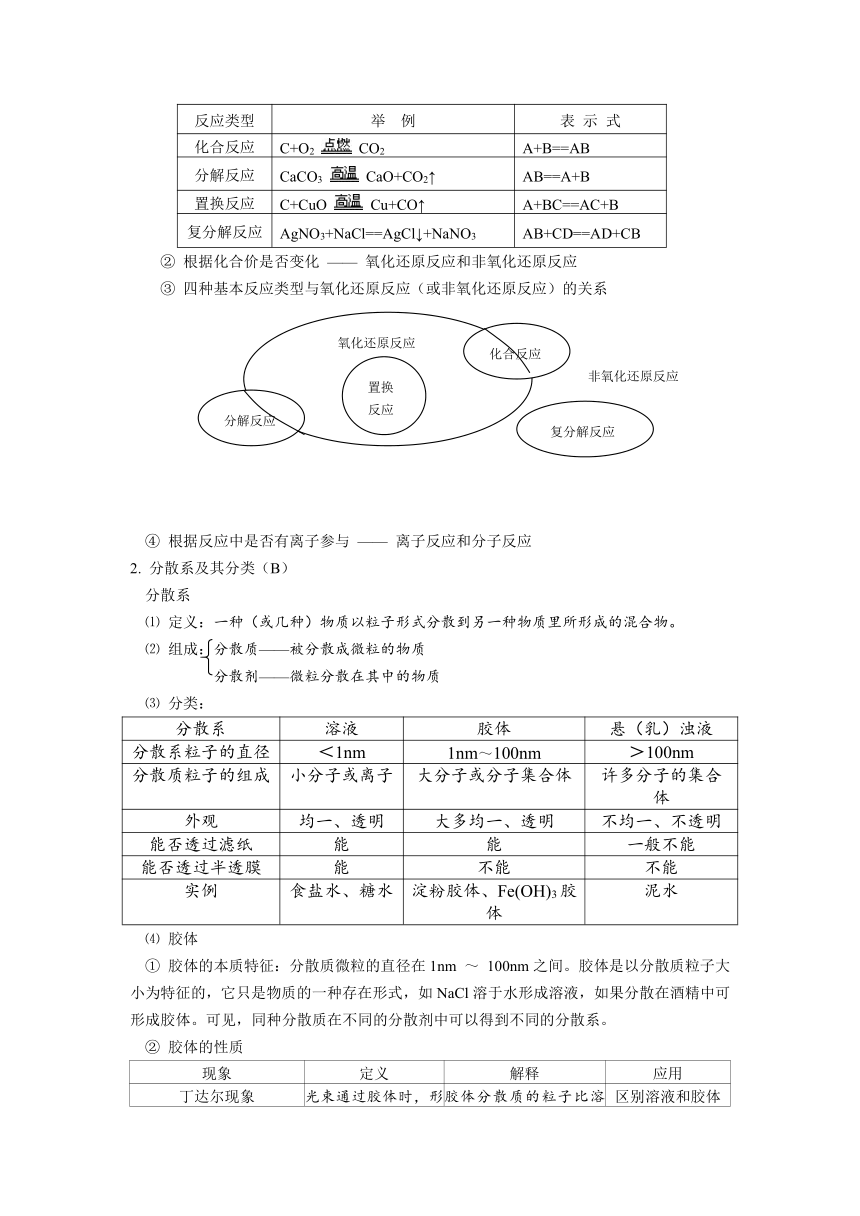
2. 分散系及其分类(B)
分散系
⑴ 定义:一种(或几种)物质以粒子形式分散到另一种物质里所形成的混合物。
⑵ 组成:分散质——被分散成微粒的物质
分散剂——微粒分散在其中的物质
⑶ 分类:
分散系
溶液
胶体
悬(乳)浊液
分散系粒子的直径
<1nm
1nm~100nm
>100nm
分散质粒子的组成
小分子或离子
大分子或分子集合体
许多分子的集合体
外观
均一、透明
大多均一、透明
不均一、不透明
能否透过滤纸
能
能
一般不能
能否透过半透膜
能
不能
不能
实例
食盐水、糖水
淀粉胶体、Fe(OH)3胶体
泥水
⑷ 胶体
① 胶体的本质特征:分散质微粒的直径在1nm ~ 100nm之间。胶体是以分散质粒子大小为特征的,它只是物质的一种存在形式,如NaCl溶于水形成溶液,如果分散在酒精中可形成胶体。可见,同种分散质在不同的分散剂中可以得到不同的分散系。
② 胶体的性质
现象
定义
解释
应用
丁达尔现象
光束通过胶体时,形成光亮的通路的现象
胶体分散质的粒子比溶液中溶质的微粒大,使光波发生散射
区别溶液和胶体
布朗运动
在超显微镜下可观察到胶体粒子在做不停的、无秩序的运动,叫做布朗运动
水分子从各个方向撞击胶体粒子,而每一瞬间胶体粒子在不同方向受的力是不相同的
——
电泳现象
在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象
胶体粒子具有相对较大的表面积,能吸附离子而带电荷
分离蛋白质、氨基酸;血清电泳用于诊断疾病;电泳电镀
聚 沉
中和胶体粒子所带的电荷,使胶体粒子聚集长大,形成颗粒较大的沉淀从分散剂里析出的过程
胶体粒子带电,加电解质或带相反电荷的胶体,中和了胶体粒子所带的电荷,从而使分散质聚集成较大的微粒,在重力作用下沉淀析出
制豆腐、果冻等
③ 胶体的分类
类 型
分散剂状态
实 例
固溶胶
固态
有色玻璃、烟水晶
液溶胶
液态
淀粉溶液、Fe(OH)3胶体
气溶胶
气态
烟、云、雾
④ 胶体稳定存在的原因
胶体粒子具有相对较大的表面积,能吸附离子而带电荷,所以胶体粒子带电。同种胶体粒子带同种电荷,互相排斥而稳定存在。
一般说来,金属的氢氧化物、金属氧化物的胶体粒子带正电荷;非金属氧化物、金属硫化物、硅酸胶体的胶体粒子带负电荷。
⑤ 净化胶体的方法——渗析法
将胶体放入半透膜袋里,再将此袋放入水中,胶粒不能透过半透膜,而分子、离子可以透过半透膜,从而使杂质分子或离子进入水中而除去。
⑥ 胶体的应用:
土壤的保肥作用、制豆腐的化学原理、江河入海口处形成三角洲、明矾净水等。
注意:
① 胶体中的分散质——可以是单个分子或离子或分子集合体
② 胶体聚沉后一般情况下都生成沉淀,但有些胶体聚沉后,胶体粒子和分散剂凝聚在一起,成为不流动的冻状物,这类物质叫凝胶。
③ 电泳现象是由于胶体能带有电荷,在外加电场作用下能向阳极或阴极移动。而有些胶体如淀粉溶液,胶粒为中性分子,无电泳现象。
[基础达标1]
1. 下列物质属于纯净物的是
饮用天然水理化指标
矿物元素 测定结果
钙≥4.0 mg/L
镁≥0.5 mg/L
钾≥0.35 mg/L
钠≥0.8 mg/L
偏硅酸≥1.8 mg/L
pH (25℃) 7.1
A.液氯 B.漂白粉 C.盐酸 D.碘酒
2.右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指
A. 原子 B. 分子 C. 单质 D.元素
3.下列符号能同时表示一个原子、一种元素和一种物质的是
A( O2 B( Zn C( N D( Ca2+
4.下列家庭小实验不能制得溶液的是
5.科学家在2000年8月10日出版的英国《自然》杂志上报告说,他们用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合.下列分散系中分散质的微粒直径与纳米粒子具有相同数量级的是
A.溶液 B.胶体 C. 悬浊液 D.乳浊液
6.下列不存在丁达尔效应的分散系是①有尘埃的空气、②溴水、③蒸馏水、④沸水中加几滴FeCl3浓溶液、⑤淀粉溶液
A.② B.②③⑤ C.②③ D.①②③⑤
7.自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式。火炬的可燃物是丁烷(化学式为C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见。下列关于丁烷的叙述不正确的是
A.丁烷由碳、氢两种元素组成 B.丁烷分子由碳原子和氢原子构成
C.丁烷中碳、氢元素的质量比是4:10 D.丁烷由4个碳原子和10氢原子构成
8.不能用有关胶体的观点解释的现象是
A. 在江河入海处易形成三角洲
B. 0.01mol/LAgNO3溶液中滴入同浓度NaI溶液,看不到黄色沉淀
C. 在NaF溶液中滴入AgNO3溶液看不到沉淀
D. 同一钢笔同时使用不同牌号的墨水易发生堵塞
9.下列各组混合物的分离和提纯的方法正确的是
A. 用过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物
B. 用重结晶的方法分离NaCl和KNO3的混合物
C. 用加热的方法分离Na2CO3和NaHCO3的混合物
D. 用盐析的方法分离淀粉和NaCl的混合液
10.能证明胶体微粒比溶液中电解质微粒大的操作是
A.丁达尔现象 B.布朗运动 C.渗析 D.电泳现象
11.将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,则该溶液是
A. 2mol/L的H2SO4溶液 B. 2mol/L的NaOH溶液 C. 2mol/L的MgSO4溶液 D. 硅酸溶胶
12.下列物质分离的方法中,根据粒子的大小进行分离的是
A. 结晶 B. 过滤 C. 蒸馏 D. 渗析
13.下列化学反应基本类型中一定是氧化还原反就的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
教学目的1:
1. 巩固学习化学实验中知识,强化训练。
2. 重点学习混合物的几种分离和提纯方法及离子的检验方法。
3. 树立安全意识。
教学课时:
1.5课时
知识体系 1
1. 简单分类法及其应用(A)
⑴ 物质分类的方法
① 纯净物与混合物的区别
纯 净 物
混 合 物
①有固定的组成和结构
②有一定的熔、沸点
③保持一种物质的性质
无固定组成和结构
无一定的熔、沸点
保持原有物质各自的化学性质
② 物质分类的多种角度
⑵ 化学反应分类的方法
① 四种基本反应类型
反应类型
举 例
表 示 式
化合反应
C+O2 CO2
A+B==AB
分解反应
CaCO3 CaO+CO2↑
AB==A+B
置换反应
C+CuO Cu+CO↑
A+BC==AC+B
复分解反应
AgNO3+NaCl==AgCl↓+NaNO3
AB+CD==AD+CB
② 根据化合价是否变化 —— 氧化还原反应和非氧化还原反应
③ 四种基本反应类型与氧化还原反应(或非氧化还原反应)的关系
④ 根据反应中是否有离子参与 —— 离子反应和分子反应
2. 分散系及其分类(B)
分散系
⑴ 定义:一种(或几种)物质以粒子形式分散到另一种物质里所形成的混合物。
⑵ 组成:分散质——被分散成微粒的物质
分散剂——微粒分散在其中的物质
⑶ 分类:
分散系
溶液
胶体
悬(乳)浊液
分散系粒子的直径
<1nm
1nm~100nm
>100nm
分散质粒子的组成
小分子或离子
大分子或分子集合体
许多分子的集合体
外观
均一、透明
大多均一、透明
不均一、不透明
能否透过滤纸
能
能
一般不能
能否透过半透膜
能
不能
不能
实例
食盐水、糖水
淀粉胶体、Fe(OH)3胶体
泥水
⑷ 胶体
① 胶体的本质特征:分散质微粒的直径在1nm ~ 100nm之间。胶体是以分散质粒子大小为特征的,它只是物质的一种存在形式,如NaCl溶于水形成溶液,如果分散在酒精中可形成胶体。可见,同种分散质在不同的分散剂中可以得到不同的分散系。
② 胶体的性质
现象
定义
解释
应用
丁达尔现象
光束通过胶体时,形成光亮的通路的现象
胶体分散质的粒子比溶液中溶质的微粒大,使光波发生散射
区别溶液和胶体
布朗运动
在超显微镜下可观察到胶体粒子在做不停的、无秩序的运动,叫做布朗运动
水分子从各个方向撞击胶体粒子,而每一瞬间胶体粒子在不同方向受的力是不相同的
——
电泳现象
在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象
胶体粒子具有相对较大的表面积,能吸附离子而带电荷
分离蛋白质、氨基酸;血清电泳用于诊断疾病;电泳电镀
聚 沉
中和胶体粒子所带的电荷,使胶体粒子聚集长大,形成颗粒较大的沉淀从分散剂里析出的过程
胶体粒子带电,加电解质或带相反电荷的胶体,中和了胶体粒子所带的电荷,从而使分散质聚集成较大的微粒,在重力作用下沉淀析出
制豆腐、果冻等
③ 胶体的分类
类 型
分散剂状态
实 例
固溶胶
固态
有色玻璃、烟水晶
液溶胶
液态
淀粉溶液、Fe(OH)3胶体
气溶胶
气态
烟、云、雾
④ 胶体稳定存在的原因
胶体粒子具有相对较大的表面积,能吸附离子而带电荷,所以胶体粒子带电。同种胶体粒子带同种电荷,互相排斥而稳定存在。
一般说来,金属的氢氧化物、金属氧化物的胶体粒子带正电荷;非金属氧化物、金属硫化物、硅酸胶体的胶体粒子带负电荷。
⑤ 净化胶体的方法——渗析法
将胶体放入半透膜袋里,再将此袋放入水中,胶粒不能透过半透膜,而分子、离子可以透过半透膜,从而使杂质分子或离子进入水中而除去。
⑥ 胶体的应用:
土壤的保肥作用、制豆腐的化学原理、江河入海口处形成三角洲、明矾净水等。
注意:
① 胶体中的分散质——可以是单个分子或离子或分子集合体
② 胶体聚沉后一般情况下都生成沉淀,但有些胶体聚沉后,胶体粒子和分散剂凝聚在一起,成为不流动的冻状物,这类物质叫凝胶。
③ 电泳现象是由于胶体能带有电荷,在外加电场作用下能向阳极或阴极移动。而有些胶体如淀粉溶液,胶粒为中性分子,无电泳现象。
[基础达标1]
1. 下列物质属于纯净物的是
饮用天然水理化指标
矿物元素 测定结果
钙≥4.0 mg/L
镁≥0.5 mg/L
钾≥0.35 mg/L
钠≥0.8 mg/L
偏硅酸≥1.8 mg/L
pH (25℃) 7.1
A.液氯 B.漂白粉 C.盐酸 D.碘酒
2.右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指
A. 原子 B. 分子 C. 单质 D.元素
3.下列符号能同时表示一个原子、一种元素和一种物质的是
A( O2 B( Zn C( N D( Ca2+
4.下列家庭小实验不能制得溶液的是
5.科学家在2000年8月10日出版的英国《自然》杂志上报告说,他们用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合.下列分散系中分散质的微粒直径与纳米粒子具有相同数量级的是
A.溶液 B.胶体 C. 悬浊液 D.乳浊液
6.下列不存在丁达尔效应的分散系是①有尘埃的空气、②溴水、③蒸馏水、④沸水中加几滴FeCl3浓溶液、⑤淀粉溶液
A.② B.②③⑤ C.②③ D.①②③⑤
7.自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式。火炬的可燃物是丁烷(化学式为C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见。下列关于丁烷的叙述不正确的是
A.丁烷由碳、氢两种元素组成 B.丁烷分子由碳原子和氢原子构成
C.丁烷中碳、氢元素的质量比是4:10 D.丁烷由4个碳原子和10氢原子构成
8.不能用有关胶体的观点解释的现象是
A. 在江河入海处易形成三角洲
B. 0.01mol/LAgNO3溶液中滴入同浓度NaI溶液,看不到黄色沉淀
C. 在NaF溶液中滴入AgNO3溶液看不到沉淀
D. 同一钢笔同时使用不同牌号的墨水易发生堵塞
9.下列各组混合物的分离和提纯的方法正确的是
A. 用过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物
B. 用重结晶的方法分离NaCl和KNO3的混合物
C. 用加热的方法分离Na2CO3和NaHCO3的混合物
D. 用盐析的方法分离淀粉和NaCl的混合液
10.能证明胶体微粒比溶液中电解质微粒大的操作是
A.丁达尔现象 B.布朗运动 C.渗析 D.电泳现象
11.将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,则该溶液是
A. 2mol/L的H2SO4溶液 B. 2mol/L的NaOH溶液 C. 2mol/L的MgSO4溶液 D. 硅酸溶胶
12.下列物质分离的方法中,根据粒子的大小进行分离的是
A. 结晶 B. 过滤 C. 蒸馏 D. 渗析
13.下列化学反应基本类型中一定是氧化还原反就的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
