第三章 第二节几种重要的金属化合物
文档属性
| 名称 | 第三章 第二节几种重要的金属化合物 |  | |
| 格式 | zip | ||
| 文件大小 | 30.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-02-28 21:22:23 | ||
图片预览

文档简介
第三章 第二节几种重要的金属化合物
教学目的2:
1. 巩固学习铁、铜等金属重要化合物的主要性质,强化训练。
教学课时:
2.5课时
知识体系 2
4. Fe的性质(B)
⑴ 周期表中的位置
位于第4周期 第Ⅷ族,是过渡元素的代表。它是一种变价元素,通常显示+2价、+3价,其化合物和其水溶液往往带有颜色。
⑵ Fe与O2反应,随着外界条件和两者量的相对多少不同,生成的产物不同。
3Fe + 2O2 (纯) Fe3O4(黑色、有磁性)
2Fe (过量) + O2 2FeO(黑色,该反应在炼钢过程中发生)
4Fe + 3O2 2Fe2O3(红棕色)
生成Fe3O4的反应还有:3Fe+4H2O(g) Fe3O4+4H2
⑶ 铁锈的成分及形成
钢铁发生电化腐蚀时,Fe 参与电极反应的产物为Fe2+,后与OH—反应生成Fe(OH)2;因其不稳定,又转变成Fe(OH)3失去部分水变成Fe2O3·nH2O。(在常温下,铁和水不反应。但在水和空气里的氧气、二氧化碳的共同作用下,铁很容易生锈而被腐蚀。)
⑷ 铁与酸的反应:
铁与盐酸、稀硫酸的反应:Fe + 2H+ == Fe2+ + H2O(反应后溶液呈浅绿色)
铁与过量稀硝酸的反应: Fe + 4H+ + NO3- == Fe3+ + NO↑+ 5H2O(反应后溶液呈棕黄色)
Fe +4HNO3 (稀) =Fe(NO3)3 +NO↑+2H2O
铁粉过量: 3Fe +8HNO3 (稀) =3Fe(NO3)2 +2NO↑+4H2O
铁与浓硫酸的反应:常温下,Fe在浓硫酸中被钝化,即由于浓硫酸的强氧化性,使Fe的表面生成一层致密的氧化物薄膜,阻止了内部的金属继续跟浓硫酸反应。
金属钠与金属铁的性质比较
性 质
相 同 点
不 同 点
物理性质
都是银白色的金属,
都能导电、导热。
密度:ρ(Fe)>ρ(Na)
硬度:Fe>Na
熔沸点:Fe>Na
化学性质
都能跟氧气、水等反应
钠更易与氧气、与水等反应
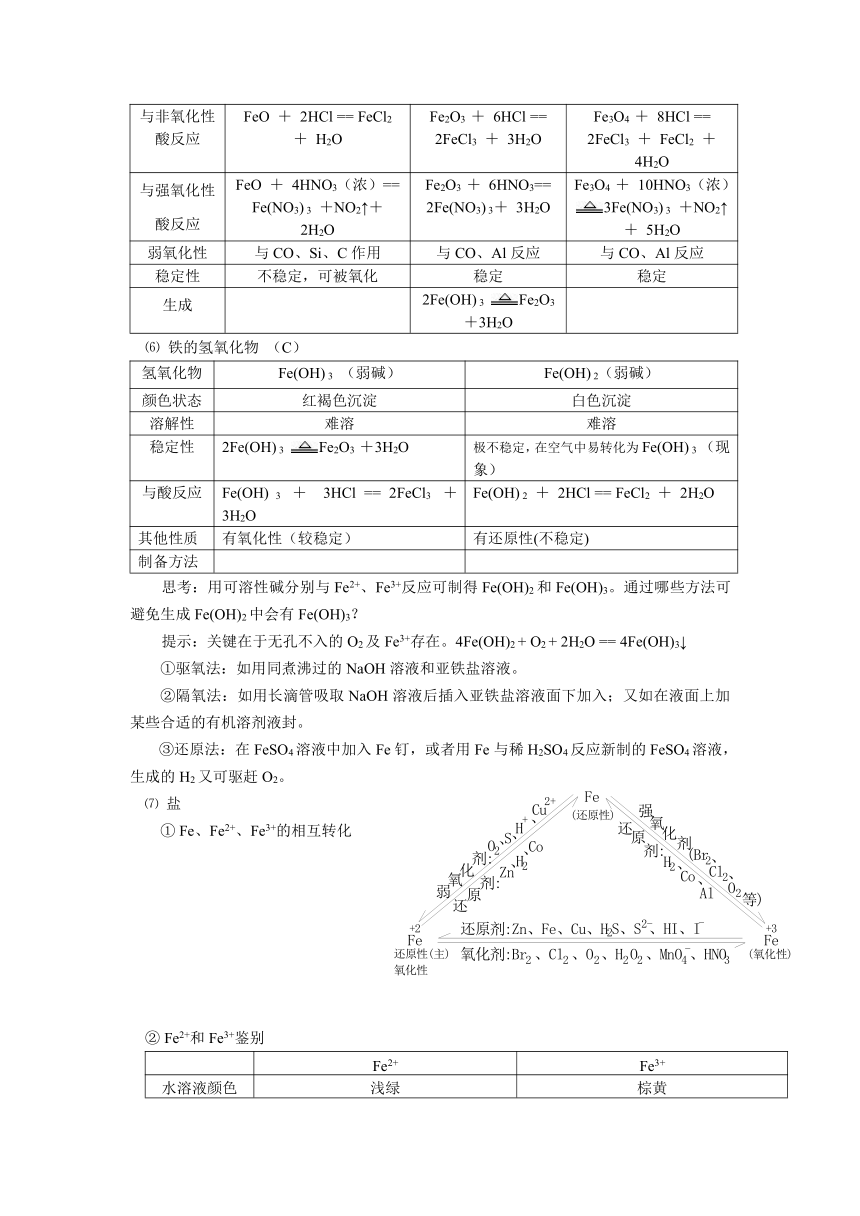
⑸ 铁的氧化物
氧化物
FeO(碱性氧化物)
Fe2O3(碱性氧化物)
Fe3O4
颜色状态
黑色粉末
红棕色粉末
黑色晶体
溶解性
不 溶 于 水
磁性
无
无
有
与非氧化性酸反应
FeO + 2HCl == FeCl2 + H2O
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Fe3O4 + 8HCl == 2FeCl3 + FeCl2 + 4H2O
与强氧化性酸反应
FeO + 4HNO3(浓)== Fe(NO3) 3 +NO2↑+ 2H2O
Fe2O3 + 6HNO3== 2Fe(NO3) 3+ 3H2O
Fe3O4 + 10HNO3(浓)3Fe(NO3) 3 +NO2↑+ 5H2O
弱氧化性
与CO、Si、C作用
与CO、Al反应
与CO、Al反应
稳定性
不稳定,可被氧化
稳定
稳定
生成
2Fe(OH) 3 Fe2O3 +3H2O
⑹ 铁的氢氧化物 (C)
氢氧化物
Fe(OH) 3 (弱碱)
Fe(OH) 2(弱碱)
颜色状态
红褐色沉淀
白色沉淀
溶解性
难溶
难溶
稳定性
2Fe(OH) 3 Fe2O3 +3H2O
极不稳定,在空气中易转化为Fe(OH) 3 (现象)
与酸反应
Fe(OH) 3 + 3HCl == 2FeCl3 + 3H2O
Fe(OH) 2 + 2HCl == FeCl2 + 2H2O
其他性质
有氧化性(较稳定)
有还原性(不稳定)
制备方法
思考:用可溶性碱分别与Fe2+、Fe3+反应可制得Fe(OH)2和Fe(OH)3。通过哪些方法可避免生成Fe(OH)2中会有Fe(OH)3?
提示:关键在于无孔不入的O2及Fe3+存在。4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3↓
①驱氧法:如用同煮沸过的NaOH溶液和亚铁盐溶液。
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液面下加入;又如在液面上加某些合适的有机溶剂液封。
③还原法:在FeSO4溶液中加入Fe钉,或者用Fe与稀H2SO4反应新制的FeSO4溶液,生成的H2又可驱赶O2。
⑺ 盐
① Fe、Fe2+、Fe3+的相互转化
② Fe2+和Fe3+鉴别
Fe2+
Fe3+
水溶液颜色
浅绿
棕黄
加入NaOH
Fe2+ + 2OH- == Fe(OH)2↓(白色)
4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3↓
白 →灰绿 → 红褐色
Fe3+ + 3OH- == Fe(OH)3↓
(红褐色)
加入KSCN
Fe2+ + 2SCN- Fe(SCN)2
无色
Fe3+ + SCN- [Fe(SCN)]2+
血红色
通入Cl2
2Fe2++Cl2=2Fe3++2Cl—
5. 下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将杂质除去:
物质
杂质
试剂或方法
化学方程式
(1)FeCl3溶液
FeCl2
(2)FeCl2溶液
FeCl3
(3)FeSO4溶液
CuSO4
(4)Fe2O3
Al2O3
(5)Fe2O3
Fe(OH)3
(6)Fe(OH)3
Al(OH)3
注意:1.NO3-与Fe2+在酸性条件下,不能共存。
2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
5.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
[基础达标2]
1.常温下可盛放浓硫酸的容器是
A. Na B. Fe C. Al D. Mg
2. 久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓HNO3 B.氯化亚铁溶液 C.溴苯 D.溴化银
3. 下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸
4. 把过量的铁粉加入稀硝酸中,其结果是
A. 不反应 B. 生成硝酸铵 C. 生成硝酸亚铁 D. 生成硝酸铁
5. 某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
A. NH4+ B. Mg2+ C. Fe2+ D. Al3+
6. 要除去FeCl2溶液中的少量FeCl3,可行的办法是
A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉
7.某运输用铁船,在水中行驶,最易生锈的部位是
A.水面上的船头部分 B.水面附近的船体部分
C.水面下的船底部分 D.各部分都一样速度生锈
8.苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
9.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH)3 ;Fe2O3 B.Fe(OH)2 ;FeO
C.Fe(OH)2、Fe(OH)3 ;Fe3O4 D.Fe2O3 ;Fe(OH)3
10.把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是
A.H+ B. Cu2+ C.Fe3+ D. Fe2+
11. 向溴化铁溶液中加入足量新制氯水,将溶液蒸干充分灼烧,最后得到的固体是
A.Fe2O3???? ??? ?? ??B. ?FeCl3?? C.FeCl3?和Br2??????? ??D. Fe(OH)3
12.下列物质不能通过化合反应得到的物质是
A. CuCl2 B. FeCl2 C. FeS D. CuS
13. 将铁片投入下列溶液中,铁片溶解且可使溶液的质量增加的是
A. Na2SO4溶液 B. FeCl3溶液 C. Cu(NO3)2 溶液 D. 稀硫酸
14. 在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是
A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
15.将FeCl3溶液加热蒸干之后灼烧,最后得到的固体物质是
A.FeCl3 B.Fe(OH)3 C.Fe2O3 D.FeCl3和Fe2O3
16. 下列反应发生后,溶液的颜色变深,但无沉淀产生的是
A. FeCl2溶液与Fe粉混合后静置 B. 向FeCl2溶液中滴入KSCN溶液
C. 向FeCl3溶液中滴入KSCN溶液 D. 向AgNO3溶液中滴加过量的氯水
17. 氯化镁溶液中含有氯化铁杂质,若要制得纯净的氯化镁溶液,可向溶液中加入:①MgO②NaO③MgCO3④Mg(NO3)2⑤NH3·H2O,正确的选择是
A.⑤?? ? B.②③? ? C.①③???? D.②④
18. 波尔多液不能用铁制的容器盛放,是因为铁能与农药中的硫酸铜起反应。在该反应中,铁是
A. 氧化剂 B. 是还原剂 C. 被还原 D. 还原产物
19.将铁片分别投入下列溶液中,无气体放出,但铁片溶解,溶液质量减轻,此溶液是
A.稀HNO3????? B.ZnCl2溶液 C.CuSO4溶液??? D.Fe2(SO4)3溶液
20. ?要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水?? ②加入足量KMnO4溶液?? ③加入少量NH4SCN溶液
A.①③??? B.③②??? C. ③①??? D. ①②③
教学目的2:
1. 巩固学习铁、铜等金属重要化合物的主要性质,强化训练。
教学课时:
2.5课时
知识体系 2
4. Fe的性质(B)
⑴ 周期表中的位置
位于第4周期 第Ⅷ族,是过渡元素的代表。它是一种变价元素,通常显示+2价、+3价,其化合物和其水溶液往往带有颜色。
⑵ Fe与O2反应,随着外界条件和两者量的相对多少不同,生成的产物不同。
3Fe + 2O2 (纯) Fe3O4(黑色、有磁性)
2Fe (过量) + O2 2FeO(黑色,该反应在炼钢过程中发生)
4Fe + 3O2 2Fe2O3(红棕色)
生成Fe3O4的反应还有:3Fe+4H2O(g) Fe3O4+4H2
⑶ 铁锈的成分及形成
钢铁发生电化腐蚀时,Fe 参与电极反应的产物为Fe2+,后与OH—反应生成Fe(OH)2;因其不稳定,又转变成Fe(OH)3失去部分水变成Fe2O3·nH2O。(在常温下,铁和水不反应。但在水和空气里的氧气、二氧化碳的共同作用下,铁很容易生锈而被腐蚀。)
⑷ 铁与酸的反应:
铁与盐酸、稀硫酸的反应:Fe + 2H+ == Fe2+ + H2O(反应后溶液呈浅绿色)
铁与过量稀硝酸的反应: Fe + 4H+ + NO3- == Fe3+ + NO↑+ 5H2O(反应后溶液呈棕黄色)
Fe +4HNO3 (稀) =Fe(NO3)3 +NO↑+2H2O
铁粉过量: 3Fe +8HNO3 (稀) =3Fe(NO3)2 +2NO↑+4H2O
铁与浓硫酸的反应:常温下,Fe在浓硫酸中被钝化,即由于浓硫酸的强氧化性,使Fe的表面生成一层致密的氧化物薄膜,阻止了内部的金属继续跟浓硫酸反应。
金属钠与金属铁的性质比较
性 质
相 同 点
不 同 点
物理性质
都是银白色的金属,
都能导电、导热。
密度:ρ(Fe)>ρ(Na)
硬度:Fe>Na
熔沸点:Fe>Na
化学性质
都能跟氧气、水等反应
钠更易与氧气、与水等反应
⑸ 铁的氧化物
氧化物
FeO(碱性氧化物)
Fe2O3(碱性氧化物)
Fe3O4
颜色状态
黑色粉末
红棕色粉末
黑色晶体
溶解性
不 溶 于 水
磁性
无
无
有
与非氧化性酸反应
FeO + 2HCl == FeCl2 + H2O
Fe2O3 + 6HCl == 2FeCl3 + 3H2O
Fe3O4 + 8HCl == 2FeCl3 + FeCl2 + 4H2O
与强氧化性酸反应
FeO + 4HNO3(浓)== Fe(NO3) 3 +NO2↑+ 2H2O
Fe2O3 + 6HNO3== 2Fe(NO3) 3+ 3H2O
Fe3O4 + 10HNO3(浓)3Fe(NO3) 3 +NO2↑+ 5H2O
弱氧化性
与CO、Si、C作用
与CO、Al反应
与CO、Al反应
稳定性
不稳定,可被氧化
稳定
稳定
生成
2Fe(OH) 3 Fe2O3 +3H2O
⑹ 铁的氢氧化物 (C)
氢氧化物
Fe(OH) 3 (弱碱)
Fe(OH) 2(弱碱)
颜色状态
红褐色沉淀
白色沉淀
溶解性
难溶
难溶
稳定性
2Fe(OH) 3 Fe2O3 +3H2O
极不稳定,在空气中易转化为Fe(OH) 3 (现象)
与酸反应
Fe(OH) 3 + 3HCl == 2FeCl3 + 3H2O
Fe(OH) 2 + 2HCl == FeCl2 + 2H2O
其他性质
有氧化性(较稳定)
有还原性(不稳定)
制备方法
思考:用可溶性碱分别与Fe2+、Fe3+反应可制得Fe(OH)2和Fe(OH)3。通过哪些方法可避免生成Fe(OH)2中会有Fe(OH)3?
提示:关键在于无孔不入的O2及Fe3+存在。4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3↓
①驱氧法:如用同煮沸过的NaOH溶液和亚铁盐溶液。
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液面下加入;又如在液面上加某些合适的有机溶剂液封。
③还原法:在FeSO4溶液中加入Fe钉,或者用Fe与稀H2SO4反应新制的FeSO4溶液,生成的H2又可驱赶O2。
⑺ 盐
① Fe、Fe2+、Fe3+的相互转化
② Fe2+和Fe3+鉴别
Fe2+
Fe3+
水溶液颜色
浅绿
棕黄
加入NaOH
Fe2+ + 2OH- == Fe(OH)2↓(白色)
4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3↓
白 →灰绿 → 红褐色
Fe3+ + 3OH- == Fe(OH)3↓
(红褐色)
加入KSCN
Fe2+ + 2SCN- Fe(SCN)2
无色
Fe3+ + SCN- [Fe(SCN)]2+
血红色
通入Cl2
2Fe2++Cl2=2Fe3++2Cl—
5. 下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将杂质除去:
物质
杂质
试剂或方法
化学方程式
(1)FeCl3溶液
FeCl2
(2)FeCl2溶液
FeCl3
(3)FeSO4溶液
CuSO4
(4)Fe2O3
Al2O3
(5)Fe2O3
Fe(OH)3
(6)Fe(OH)3
Al(OH)3
注意:1.NO3-与Fe2+在酸性条件下,不能共存。
2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
5.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
[基础达标2]
1.常温下可盛放浓硫酸的容器是
A. Na B. Fe C. Al D. Mg
2. 久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓HNO3 B.氯化亚铁溶液 C.溴苯 D.溴化银
3. 下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸
4. 把过量的铁粉加入稀硝酸中,其结果是
A. 不反应 B. 生成硝酸铵 C. 生成硝酸亚铁 D. 生成硝酸铁
5. 某溶液中有NH4+、Mg2+、Fe2+和Al3+4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
A. NH4+ B. Mg2+ C. Fe2+ D. Al3+
6. 要除去FeCl2溶液中的少量FeCl3,可行的办法是
A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉
7.某运输用铁船,在水中行驶,最易生锈的部位是
A.水面上的船头部分 B.水面附近的船体部分
C.水面下的船底部分 D.各部分都一样速度生锈
8.苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
9.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH)3 ;Fe2O3 B.Fe(OH)2 ;FeO
C.Fe(OH)2、Fe(OH)3 ;Fe3O4 D.Fe2O3 ;Fe(OH)3
10.把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是
A.H+ B. Cu2+ C.Fe3+ D. Fe2+
11. 向溴化铁溶液中加入足量新制氯水,将溶液蒸干充分灼烧,最后得到的固体是
A.Fe2O3???? ??? ?? ??B. ?FeCl3?? C.FeCl3?和Br2??????? ??D. Fe(OH)3
12.下列物质不能通过化合反应得到的物质是
A. CuCl2 B. FeCl2 C. FeS D. CuS
13. 将铁片投入下列溶液中,铁片溶解且可使溶液的质量增加的是
A. Na2SO4溶液 B. FeCl3溶液 C. Cu(NO3)2 溶液 D. 稀硫酸
14. 在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是
A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
15.将FeCl3溶液加热蒸干之后灼烧,最后得到的固体物质是
A.FeCl3 B.Fe(OH)3 C.Fe2O3 D.FeCl3和Fe2O3
16. 下列反应发生后,溶液的颜色变深,但无沉淀产生的是
A. FeCl2溶液与Fe粉混合后静置 B. 向FeCl2溶液中滴入KSCN溶液
C. 向FeCl3溶液中滴入KSCN溶液 D. 向AgNO3溶液中滴加过量的氯水
17. 氯化镁溶液中含有氯化铁杂质,若要制得纯净的氯化镁溶液,可向溶液中加入:①MgO②NaO③MgCO3④Mg(NO3)2⑤NH3·H2O,正确的选择是
A.⑤?? ? B.②③? ? C.①③???? D.②④
18. 波尔多液不能用铁制的容器盛放,是因为铁能与农药中的硫酸铜起反应。在该反应中,铁是
A. 氧化剂 B. 是还原剂 C. 被还原 D. 还原产物
19.将铁片分别投入下列溶液中,无气体放出,但铁片溶解,溶液质量减轻,此溶液是
A.稀HNO3????? B.ZnCl2溶液 C.CuSO4溶液??? D.Fe2(SO4)3溶液
20. ?要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水?? ②加入足量KMnO4溶液?? ③加入少量NH4SCN溶液
A.①③??? B.③②??? C. ③①??? D. ①②③
