人教版(2019)高中化学必修第二册5.1硫及其化合物 第一课时 课件(共32张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修第二册5.1硫及其化合物 第一课时 课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-20 16:32:13 | ||
图片预览








文档简介
(共32张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫和二氧化硫
1
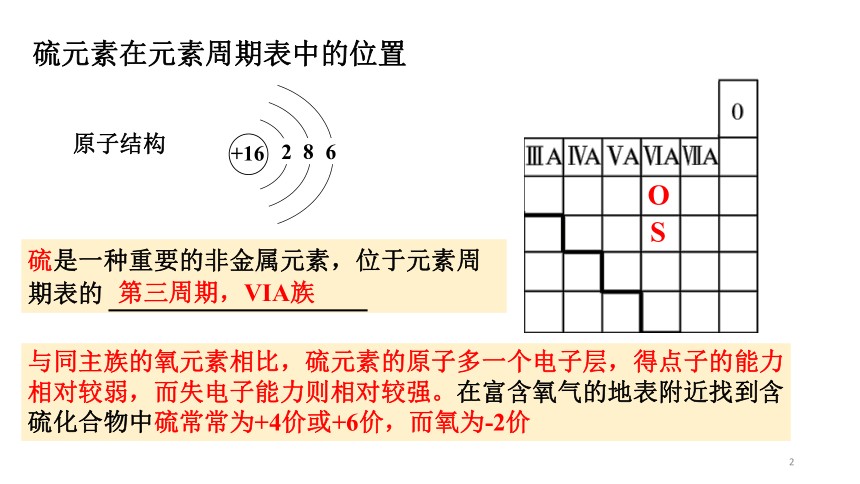
硫元素在元素周期表中的位置
硫是一种重要的非金属元素,位于元素周期表的
O
S
原子结构
+16
2
8
6
与同主族的氧元素相比,硫元素的原子多一个电子层,得点子的能力
相对较弱,而失电子能力则相对较强。在富含氧气的地表附近找到含
硫化合物中硫常常为+4价或+6价,而氧为-2价
第三周期,VIA族
2
硫酸盐
游离态:
存在于火山喷口附近或地壳的岩层里
化合态:
硫化物
有机物
硫铁矿(FeS2),黄铜矿(CuFeS2)
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
石油、天然气、煤、蛋白质等
1、硫元素的存在形态
一、单质硫
3
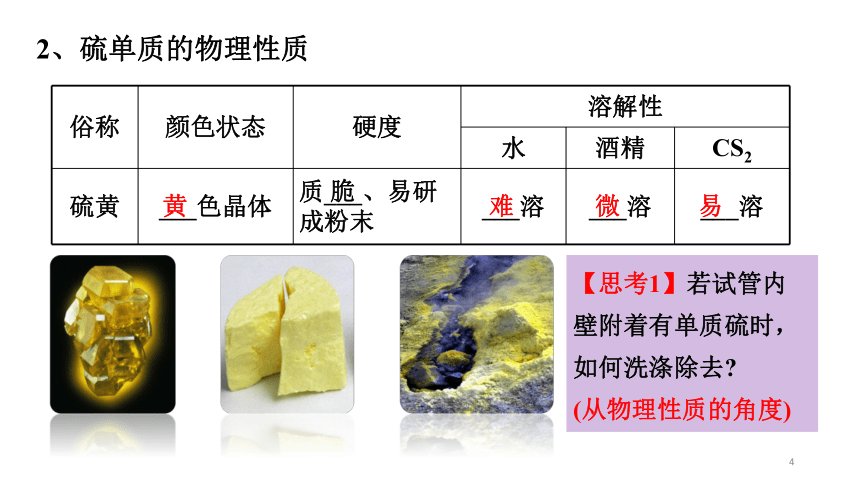
2、硫单质的物理性质
俗称 颜色状态 硬度 溶解性
水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
难
微
易
【思考1】若试管内壁附着有单质硫时,如何洗涤除去
(从物理性质的角度)
4
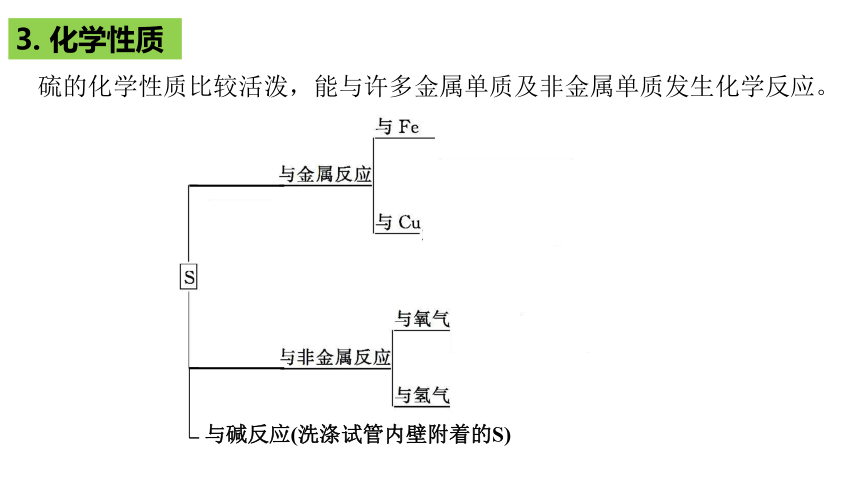
3. 化学性质
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
与碱反应(洗涤试管内壁附着的S)
(1) 氧化性
硫与常见金属、氢气等反应时表现出氧化性
Fe + S = FeS
△
(硫化亚铁,黑色难溶物质)
2Cu + S = Cu2S
△
(硫化亚铜,黑色难溶物质)
Hg + S = HgS
(硫化汞,此反应用于除去洒落的汞)
H2 + S = H2S
△
(硫化氢,有臭鸡蛋气味的气体)
硫的氧化性弱,与变价金属反应生成低价态的化合物
3. 化学性质
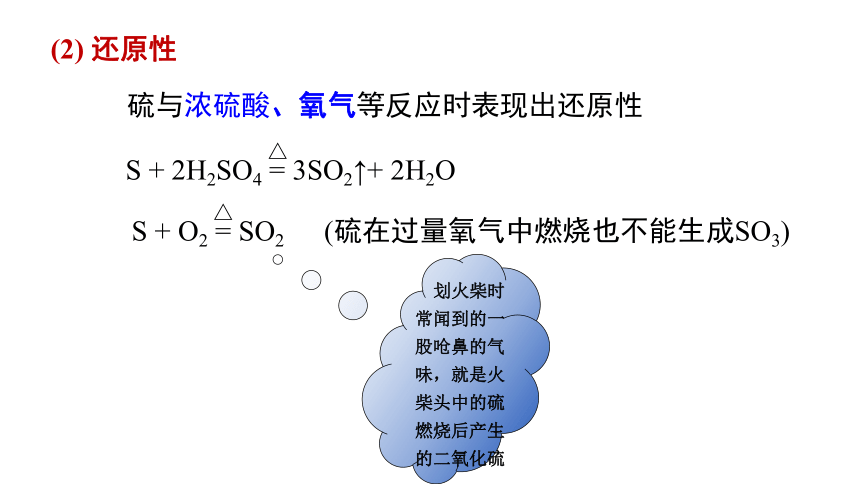
(2) 还原性
S + O2 = SO2
△
(硫在过量氧气中燃烧也不能生成SO3)
硫与浓硫酸、氧气等反应时表现出还原性
S + 2H2SO4 = 3SO2↑+ 2H2O
△
划火柴时常闻到的一股呛鼻的气 味,就是火柴头中的硫燃烧后产生的二氧化硫
(3) 氧化性和还原性
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O (硫单质的歧化反应)
△
硫与热的碱液反应时既表现出氧化性又表现出还原性
试管壁上沾有的硫磺可用二硫化碳(CS2)或热的NaOH溶液清洗
用于医药、农药、火药、火柴
医疗上,硫还可用来制硫黄软膏,医治某些皮肤病。
黑火药:S+2KNO3+3C==K2S+N2↑+3CO2↑
硫也是生产橡胶制品的重要原料。硫还被用来杀菌,用做化肥。硫还可用于制造黑色火药、焰火、火柴等。硫又是制造某些农药(如石灰硫黄合剂)的原料。
4、用途
思考与交流:
1. 为什么硫与铁、铜反应生成的化合物中硫化合价为-2价,而与氧气反应生成二氧化硫中硫的化合价为+4价?
硫原子最外层电子有6个,在化学反应中容易得到2个电子,形成-2价硫的化合物。而与同族氧元素比较,硫元素多了一个电子层,得电子能力相对较弱,而失电子能力相对较强。
2.能不能根据Fe、Cu与S、Cl2反应的产物判断S和Cl2的氧化性的强弱
可以。Fe、Cu与S反应生成低价的化合物,Fe、Cu与Cl2反应生成高价的化合物,故Cl2的氧化性大于S。
1、下列化合物能由两种单质直接化合生成的是( )
A.Fe2S3 B.CuS
C.SO3 D.SO2
D
2、下列说法不正确的是( )
A.硫是一种淡黄色的不溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫易燃烧,其燃烧产物是大气污染物之一
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是
三氧化硫
D
二、二氧化硫
色、态、味 密度 溶解性 毒性
________________________ 比空气____ ___________________ _____
无色有刺激性气味的气体
大
易溶于水, 1:40
有毒
12
2、化学性质
把充满SO2,塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验5-2使用)
【实验5-1】
现象 结论
SO2易溶水
试管水位上升
试纸变红色
溶液呈酸性
SO2+H2O H2SO3
13
①SO2+H2O H2SO3
2、化学性质
(1) 酸性氧化物的通性,性质类似CO2
弱酸,不稳定,容易分解
可逆反应
①正反应:向_______方向进行的反应;
②逆反应:向_______方向进行的反应;
③可逆反应:在_________下,既能向正反应方向进行,_____又能向逆反应方向进行的反应。
生成物
反应物
同一条件
同时
2.化学性质
②与碱反应
SO2过量:SO2+NaHCO3===NaHSO3+CO2
2NaOH+SO2==Na2SO3+H2O
Na2SO3+SO2+H2O==2NaHSO3
NaOH+SO2==NaHSO3
Ca(OH)2+SO2==CaSO3↓+H2O
CaSO3+SO2+H2O==2Ca(HSO3) 2
Ca(OH) 2+2SO2==Ca(HSO3) 2
CaO+SO2=CaSO3
与碱性氧化物反应
SO2不足:SO2+2NaHCO3===Na2SO3+2CO2+H2O
与盐反应
(2) SO2的漂白性
实验操作 实验现象 实验结论
用试管取2mLSO2的水溶液,向其中滴入1-2滴品红溶液,振荡,观察溶液的颜色变化
溶液褪色
SO2能使品红褪色
加热试管,注意通风,再观察溶液的颜色变化
溶液恢复原来的颜色
SO2与品红结合生成的无色物质不稳定,加热易分解而使溶液恢复原来的颜色
① 酸性氧化物的通性
SO2+2NaOH===Na2SO3+H2O
SO2 +CaO===CaSO3
SO2+H2O H2SO3
(1)从物质类别角度分析SO2的化学性质
SO2 + Ca(OH)2 == CaSO3 ↓+H2O
2SO2 + Ca(OH)2 = Ca(HSO3)2
SO2 + NaOH = NaHSO3
c.与碱性氧化物如:CaO反应
a. SO2与H2O 的反应:
b. SO2能与碱(NaOH)反应
17
SO2+Cl2+2H2O===H2SO4+2HCl
5SO2+2KMnO4+2H2O===K2SO4 + 2MnSO4+2H2SO4
SO2+2H2S===3S+2H2O
② 还原性(+4 → +6)
SO2可使氯水、KMnO4溶液褪色,可用于吸收或鉴别SO2
③ 氧化性(+4 → 0)
(2)从元素化合价角度分析SO2的化学性质
S
H2S
氧化性
SO2
+4
还原性
SO3
2SO2+O2 2SO3
催化剂
鉴别
强还原剂
强氧化剂
18
④漂白性【实验5-2】
用试管取2mL 在实验5-1中得到的溶液,向其中滴入1-2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,在观察溶液的变化。
现象:使品红溶液的红色褪去;加热后,溶液又恢复红色,可用于检验或鉴别SO2
漂白原理
SO2能与某些有色物质结合成不稳定的无色物质而具有漂白性---暂时性(当加热或久置后,恢复原来的颜色)
选择性:使紫色石蕊试液变红,不可褪色
19
常见漂白剂的漂白原理及特点
类型 原理 特点 举例
氧化型 漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色 加热时不能恢复原有的颜色 Cl2、Ca(ClO)2、ClO2、H2O2、O3等
化合型 漂白剂与有色物质结合生成新的无色物质,使之失去原来的颜色 加热时能恢复原来的颜色 二氧化硫等
吸附型 有些固体物质疏松、多孔,具有较大的比表面积,可以吸附有色物质使之失去原来的颜色 部分吸附剂可以重复使用 活性炭、胶体等
20
二氧化硫与氯水的漂白性比较
【对比提升】
21
思考与讨论:
品红溶液不褪色
2.SO2与Cl2按1:1混合通入品红溶液会有什么变化?
3.CO2和SO2均为酸性氧化物,在性质上具有一定的相似性,能否用澄清石灰水鉴别CO2和SO2,为什么?
不能。少量的CO2和SO2通入澄清石灰水中,均产生白色沉淀;足量的CO2和SO2通入澄清石灰水中现象都是先变浑浊后变澄清。
1.报纸放久了为什么会变黄?
SO2 漂白暂时性
22
3、下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4
溶液、石蕊试液褪色
B.能使品红褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相
同
D.盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性
B
二氧化硫和二氧化碳性质的异同
SO2 CO2
物理性质 气味 有刺激性气味 无味
毒性 有毒 无毒
溶解性 易溶(体积比1∶40) 可溶(体积比1∶1)
SO2 CO2
化学性质 与水的反应 SO2+H2O H2SO3 CO2+H2O H2CO3
与碱的反应 SO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解: Ca(OH)2+SO2===CaSO3↓+H2O CaSO3+SO2+H2O===Ca(HSO3)2 CO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解:
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O===Ca(HCO3)2
与碱性氧化物反应 SO2+CaO===CaSO3 CO2+CaO===CaCO3
弱氧化性 SO2+2H2S===3S↓+2H2O CO2+C 2CO
还原性 二氧化硫能被酸性高锰酸钾、Cl2、Br2、I2等氧化剂氧化 无
漂白性 有,不稳定 无
SO2 CO2
对环境的影响 形成酸雨 引起温室效应
鉴别 ①闻气味 ②利用二氧化硫的漂白性,用品红溶液鉴别 ③利用二氧化硫的还原性,用酸性高锰酸钾溶液或溴水看是否褪色鉴别 ④利用二氧化硫的氧化性,用氢硫酸鉴别
4、检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.先通过足量NaOH溶液,再通入澄清石灰水
C.通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
D
5、下列溶液中,不能鉴别CO2、SO2气体的是( )
①石灰水 ②H2S水溶液 ③酸性KMnO4溶液 ④溴水 ⑤氯水 ⑥品红溶液
A.①⑤ B.②③④⑤⑥
C.只有① D.③④
C
6、在括号中填写二氧化硫在下列反应中表现的性质
A.氧化性 B.还原性
C.漂白性 D.酸性氧化物的性质
(1)SO2+Br2+2H2O===2HBr+H2SO4( )
(2)SO2+2H2S===3S↓+2H2O( )
(3)SO2+2NaOH===Na2SO3+H2O( )
(4)SO2+Ca(OH)2===CaSO3↓+H2O( )
B
A
D
D
反应原理
反应特点
发生装置
干燥
收集方法
尾气处理
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
固液不加热制气体
向上排空气法
用浓H2SO4或P2O5干燥剂(不可用碱石灰)
用NaOH等碱溶液吸收多余的SO2
分液漏斗、圆底烧瓶
3、SO2的实验室制法
2SO2 + O2 2SO3
催化剂
△
SO3 + H2O = H2SO4
⑵ 漂白纸浆、毛、丝、草编制品等。
⑶ 用于杀菌消毒。
⑷ 用作食品添加剂:防腐和抗氧化。
⑴ 制造硫酸:
4、二氧化硫的用途
三、三氧化硫
1、物理性质
常温下:无色液体
标准状况下:无色固体
2、化学性质
酸性氧化物的通性
①与水反应生成对应的酸
②与碱反应生成对应的盐和水
③与碱性氧化物反应生成对应的盐
④与某些盐反应
SO3 + Ca(OH)2 = CaSO4↓ + H2O
SO3 + CaO = CaSO4
SO3 + BaCl2 + H2O = BaSO4↓ + 2HCl
SO3 + H2O = H2SO4
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫和二氧化硫
1
硫元素在元素周期表中的位置
硫是一种重要的非金属元素,位于元素周期表的
O
S
原子结构
+16
2
8
6
与同主族的氧元素相比,硫元素的原子多一个电子层,得点子的能力
相对较弱,而失电子能力则相对较强。在富含氧气的地表附近找到含
硫化合物中硫常常为+4价或+6价,而氧为-2价
第三周期,VIA族
2
硫酸盐
游离态:
存在于火山喷口附近或地壳的岩层里
化合态:
硫化物
有机物
硫铁矿(FeS2),黄铜矿(CuFeS2)
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
石油、天然气、煤、蛋白质等
1、硫元素的存在形态
一、单质硫
3
2、硫单质的物理性质
俗称 颜色状态 硬度 溶解性
水 酒精 CS2
硫黄 ___色晶体 质___、易研成粉末 ___溶 ___溶 ___溶
黄
脆
难
微
易
【思考1】若试管内壁附着有单质硫时,如何洗涤除去
(从物理性质的角度)
4
3. 化学性质
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
与碱反应(洗涤试管内壁附着的S)
(1) 氧化性
硫与常见金属、氢气等反应时表现出氧化性
Fe + S = FeS
△
(硫化亚铁,黑色难溶物质)
2Cu + S = Cu2S
△
(硫化亚铜,黑色难溶物质)
Hg + S = HgS
(硫化汞,此反应用于除去洒落的汞)
H2 + S = H2S
△
(硫化氢,有臭鸡蛋气味的气体)
硫的氧化性弱,与变价金属反应生成低价态的化合物
3. 化学性质
(2) 还原性
S + O2 = SO2
△
(硫在过量氧气中燃烧也不能生成SO3)
硫与浓硫酸、氧气等反应时表现出还原性
S + 2H2SO4 = 3SO2↑+ 2H2O
△
划火柴时常闻到的一股呛鼻的气 味,就是火柴头中的硫燃烧后产生的二氧化硫
(3) 氧化性和还原性
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O (硫单质的歧化反应)
△
硫与热的碱液反应时既表现出氧化性又表现出还原性
试管壁上沾有的硫磺可用二硫化碳(CS2)或热的NaOH溶液清洗
用于医药、农药、火药、火柴
医疗上,硫还可用来制硫黄软膏,医治某些皮肤病。
黑火药:S+2KNO3+3C==K2S+N2↑+3CO2↑
硫也是生产橡胶制品的重要原料。硫还被用来杀菌,用做化肥。硫还可用于制造黑色火药、焰火、火柴等。硫又是制造某些农药(如石灰硫黄合剂)的原料。
4、用途
思考与交流:
1. 为什么硫与铁、铜反应生成的化合物中硫化合价为-2价,而与氧气反应生成二氧化硫中硫的化合价为+4价?
硫原子最外层电子有6个,在化学反应中容易得到2个电子,形成-2价硫的化合物。而与同族氧元素比较,硫元素多了一个电子层,得电子能力相对较弱,而失电子能力相对较强。
2.能不能根据Fe、Cu与S、Cl2反应的产物判断S和Cl2的氧化性的强弱
可以。Fe、Cu与S反应生成低价的化合物,Fe、Cu与Cl2反应生成高价的化合物,故Cl2的氧化性大于S。
1、下列化合物能由两种单质直接化合生成的是( )
A.Fe2S3 B.CuS
C.SO3 D.SO2
D
2、下列说法不正确的是( )
A.硫是一种淡黄色的不溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫易燃烧,其燃烧产物是大气污染物之一
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是
三氧化硫
D
二、二氧化硫
色、态、味 密度 溶解性 毒性
________________________ 比空气____ ___________________ _____
无色有刺激性气味的气体
大
易溶于水, 1:40
有毒
12
2、化学性质
把充满SO2,塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内液面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定试管中溶液的酸碱度(保留该溶液供实验5-2使用)
【实验5-1】
现象 结论
SO2易溶水
试管水位上升
试纸变红色
溶液呈酸性
SO2+H2O H2SO3
13
①SO2+H2O H2SO3
2、化学性质
(1) 酸性氧化物的通性,性质类似CO2
弱酸,不稳定,容易分解
可逆反应
①正反应:向_______方向进行的反应;
②逆反应:向_______方向进行的反应;
③可逆反应:在_________下,既能向正反应方向进行,_____又能向逆反应方向进行的反应。
生成物
反应物
同一条件
同时
2.化学性质
②与碱反应
SO2过量:SO2+NaHCO3===NaHSO3+CO2
2NaOH+SO2==Na2SO3+H2O
Na2SO3+SO2+H2O==2NaHSO3
NaOH+SO2==NaHSO3
Ca(OH)2+SO2==CaSO3↓+H2O
CaSO3+SO2+H2O==2Ca(HSO3) 2
Ca(OH) 2+2SO2==Ca(HSO3) 2
CaO+SO2=CaSO3
与碱性氧化物反应
SO2不足:SO2+2NaHCO3===Na2SO3+2CO2+H2O
与盐反应
(2) SO2的漂白性
实验操作 实验现象 实验结论
用试管取2mLSO2的水溶液,向其中滴入1-2滴品红溶液,振荡,观察溶液的颜色变化
溶液褪色
SO2能使品红褪色
加热试管,注意通风,再观察溶液的颜色变化
溶液恢复原来的颜色
SO2与品红结合生成的无色物质不稳定,加热易分解而使溶液恢复原来的颜色
① 酸性氧化物的通性
SO2+2NaOH===Na2SO3+H2O
SO2 +CaO===CaSO3
SO2+H2O H2SO3
(1)从物质类别角度分析SO2的化学性质
SO2 + Ca(OH)2 == CaSO3 ↓+H2O
2SO2 + Ca(OH)2 = Ca(HSO3)2
SO2 + NaOH = NaHSO3
c.与碱性氧化物如:CaO反应
a. SO2与H2O 的反应:
b. SO2能与碱(NaOH)反应
17
SO2+Cl2+2H2O===H2SO4+2HCl
5SO2+2KMnO4+2H2O===K2SO4 + 2MnSO4+2H2SO4
SO2+2H2S===3S+2H2O
② 还原性(+4 → +6)
SO2可使氯水、KMnO4溶液褪色,可用于吸收或鉴别SO2
③ 氧化性(+4 → 0)
(2)从元素化合价角度分析SO2的化学性质
S
H2S
氧化性
SO2
+4
还原性
SO3
2SO2+O2 2SO3
催化剂
鉴别
强还原剂
强氧化剂
18
④漂白性【实验5-2】
用试管取2mL 在实验5-1中得到的溶液,向其中滴入1-2滴品红溶液,振荡,观察溶液的颜色变化。然后加热试管,注意通风,在观察溶液的变化。
现象:使品红溶液的红色褪去;加热后,溶液又恢复红色,可用于检验或鉴别SO2
漂白原理
SO2能与某些有色物质结合成不稳定的无色物质而具有漂白性---暂时性(当加热或久置后,恢复原来的颜色)
选择性:使紫色石蕊试液变红,不可褪色
19
常见漂白剂的漂白原理及特点
类型 原理 特点 举例
氧化型 漂白剂本身是氧化剂,利用其氧化性氧化有色物质,使之失去原有的颜色 加热时不能恢复原有的颜色 Cl2、Ca(ClO)2、ClO2、H2O2、O3等
化合型 漂白剂与有色物质结合生成新的无色物质,使之失去原来的颜色 加热时能恢复原来的颜色 二氧化硫等
吸附型 有些固体物质疏松、多孔,具有较大的比表面积,可以吸附有色物质使之失去原来的颜色 部分吸附剂可以重复使用 活性炭、胶体等
20
二氧化硫与氯水的漂白性比较
【对比提升】
21
思考与讨论:
品红溶液不褪色
2.SO2与Cl2按1:1混合通入品红溶液会有什么变化?
3.CO2和SO2均为酸性氧化物,在性质上具有一定的相似性,能否用澄清石灰水鉴别CO2和SO2,为什么?
不能。少量的CO2和SO2通入澄清石灰水中,均产生白色沉淀;足量的CO2和SO2通入澄清石灰水中现象都是先变浑浊后变澄清。
1.报纸放久了为什么会变黄?
SO2 漂白暂时性
22
3、下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4
溶液、石蕊试液褪色
B.能使品红褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相
同
D.盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性
B
二氧化硫和二氧化碳性质的异同
SO2 CO2
物理性质 气味 有刺激性气味 无味
毒性 有毒 无毒
溶解性 易溶(体积比1∶40) 可溶(体积比1∶1)
SO2 CO2
化学性质 与水的反应 SO2+H2O H2SO3 CO2+H2O H2CO3
与碱的反应 SO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解: Ca(OH)2+SO2===CaSO3↓+H2O CaSO3+SO2+H2O===Ca(HSO3)2 CO2气体通入澄清的石灰水中,先生成沉淀,当气体过量时沉淀又溶解:
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+CO2+H2O===Ca(HCO3)2
与碱性氧化物反应 SO2+CaO===CaSO3 CO2+CaO===CaCO3
弱氧化性 SO2+2H2S===3S↓+2H2O CO2+C 2CO
还原性 二氧化硫能被酸性高锰酸钾、Cl2、Br2、I2等氧化剂氧化 无
漂白性 有,不稳定 无
SO2 CO2
对环境的影响 形成酸雨 引起温室效应
鉴别 ①闻气味 ②利用二氧化硫的漂白性,用品红溶液鉴别 ③利用二氧化硫的还原性,用酸性高锰酸钾溶液或溴水看是否褪色鉴别 ④利用二氧化硫的氧化性,用氢硫酸鉴别
4、检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过品红溶液
B.先通过足量NaOH溶液,再通入澄清石灰水
C.通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
D
5、下列溶液中,不能鉴别CO2、SO2气体的是( )
①石灰水 ②H2S水溶液 ③酸性KMnO4溶液 ④溴水 ⑤氯水 ⑥品红溶液
A.①⑤ B.②③④⑤⑥
C.只有① D.③④
C
6、在括号中填写二氧化硫在下列反应中表现的性质
A.氧化性 B.还原性
C.漂白性 D.酸性氧化物的性质
(1)SO2+Br2+2H2O===2HBr+H2SO4( )
(2)SO2+2H2S===3S↓+2H2O( )
(3)SO2+2NaOH===Na2SO3+H2O( )
(4)SO2+Ca(OH)2===CaSO3↓+H2O( )
B
A
D
D
反应原理
反应特点
发生装置
干燥
收集方法
尾气处理
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
固液不加热制气体
向上排空气法
用浓H2SO4或P2O5干燥剂(不可用碱石灰)
用NaOH等碱溶液吸收多余的SO2
分液漏斗、圆底烧瓶
3、SO2的实验室制法
2SO2 + O2 2SO3
催化剂
△
SO3 + H2O = H2SO4
⑵ 漂白纸浆、毛、丝、草编制品等。
⑶ 用于杀菌消毒。
⑷ 用作食品添加剂:防腐和抗氧化。
⑴ 制造硫酸:
4、二氧化硫的用途
三、三氧化硫
1、物理性质
常温下:无色液体
标准状况下:无色固体
2、化学性质
酸性氧化物的通性
①与水反应生成对应的酸
②与碱反应生成对应的盐和水
③与碱性氧化物反应生成对应的盐
④与某些盐反应
SO3 + Ca(OH)2 = CaSO4↓ + H2O
SO3 + CaO = CaSO4
SO3 + BaCl2 + H2O = BaSO4↓ + 2HCl
SO3 + H2O = H2SO4
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
