第四单元我们周围的空气单元复习—2021-2022学年九年级化学鲁教版上册(共22张PPT)
文档属性
| 名称 | 第四单元我们周围的空气单元复习—2021-2022学年九年级化学鲁教版上册(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 672.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-19 12:17:24 | ||
图片预览






文档简介
(共22张PPT)
第四单元
我们周围的空气
单元复习
复习目标:
1.了解空气的主要成分和空气的污染防治。
2.掌握有关氧气的实验室制法及检验。
3.了解氧气的物理性质、用途;掌握氧气的化学性质。
1
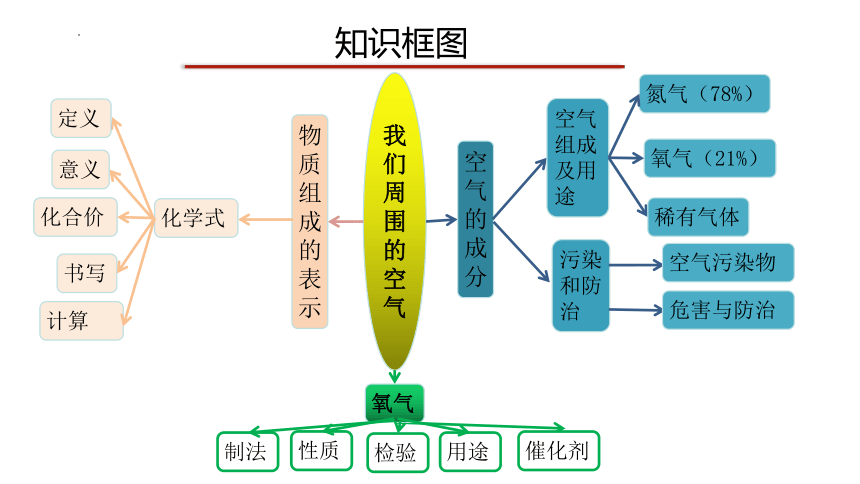
知识框图
我们周围的空气
空气的成分
物质组成的表示
空气组成及用途
污染和防治
化学式
氮气(78%)
氧气(21%)
氧气
制法
性质
检验
用途
催化剂
稀有气体
空气污染物
危害与防治
意义
计算
书写
化合价
定义
知识回顾
一. 空气的成分
1.空气中各种成分的分离:
(1)原理:利用空气中各成分的_____不同来分离液态
空气,属于_____变化。
沸点
物理
空气的 成分 氮气(78%) 氧气(21%) 氩气等稀
有气体
用途 ①用作生产氮肥 和硝酸的原料 ②化学性质不活 泼,用作_______ ③液态氮可作 _______ ①________ ②支持燃烧 ③用于冶炼和金属焊接 ①化学性质稳定,
常用作_______
②通电时发出不
同颜色的光,用
于制造_______
保护气
制冷剂
供给呼吸
保护气
电光源
(2)空气各组分含量及用途
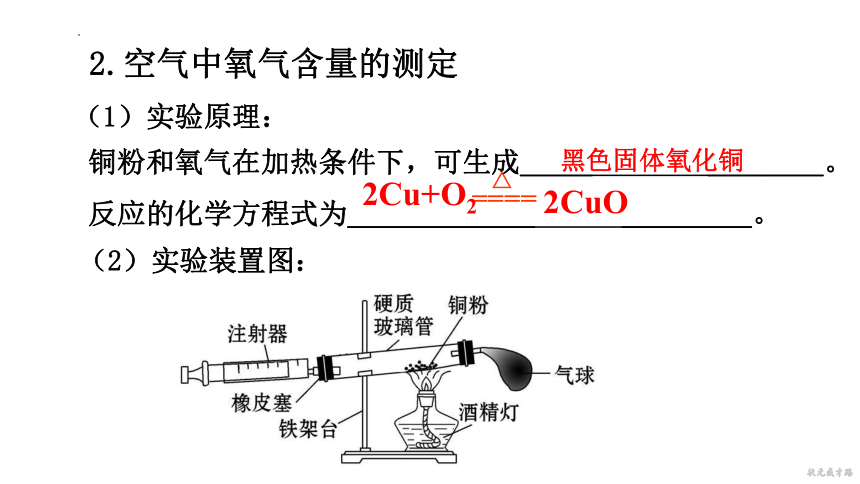
2.空气中氧气含量的测定
铜粉和氧气在加热条件下,可生成_____ ________。
反应的化学方程式为_____________ _________。
(1)实验原理:
(2)实验装置图:
△
====
2Cu+O2
2CuO
黑色固体氧化铜
(3)实验现象:红色的铜粉变成_____,注射器内气体体
积_____,减少的体积约为反应前硬质玻璃管和注射器
内空气总体积的____。
(4)实验结论:氧气约占空气总体积的____。
黑色
减少
1/5
1/5
3.空气的污染及防治
(1)空气污染物:
①来源:工业生产和交通运输产生的废气。
②种类:_________和_____。
(2)计入空气污染指数的项目。
①_________ ②_________ ③_________ ④臭氧
⑤可吸入颗粒物 ⑥总悬浮颗粒物
(3)空气质量级别数目越大,空气质量越差。
二氧化硫
一氧化碳
二氧化氮
有害气体
烟尘
二. 氧气
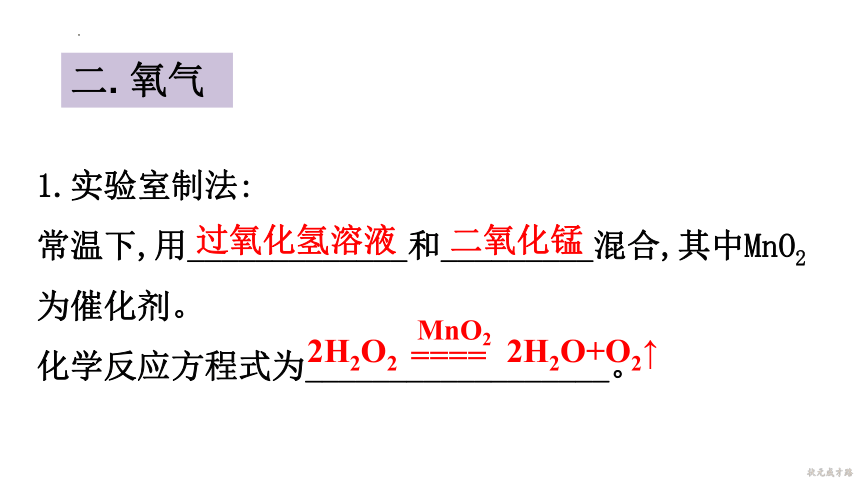
1.实验室制法:
常温下,用_____________和_________混合,其中MnO2
为催化剂。
化学反应方程式为__________________。
过氧化氢溶液
二氧化锰
2H2O2 2H2O+O2↑
MnO2
====
2.实验装置
发生装置:固液常温型
向上排空气法
排水集气法
收集装置:
排水法收集到的气体比排空气法纯净!
3.检验氧气的方法
检验方法: 将带火星的木条放在集气瓶内,如果木条复燃,则说明该气体就是氧气。
在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。
4.催化剂与催化作用
“二不变”:本身的质量和化学性质在反应前后都没有改变
“一变”:改变其他物质的化学反应速率(改变≠加快)
加快或减慢
催化作用:催化剂在化学反应中所起的作用。
5.氧气的物理性质
颜色 气味 状态 密度 溶解性
_____ _____ _____ 比空气_____ _____
溶于水
大
不易
无色
无味
气态
5.氧气的化学性质
在空气中,发出_____,在氧气中,发出_____
红光
白光
C+O2 CO2
点燃
====
在空气中:__________________;在氧气中:剧烈燃烧,_________,放出大量的热,生成一种_____
只能
红热不能燃烧
火星四射
黑色固体
3Fe+2O2 Fe3O4
点燃
====
6.氧化反应和缓慢氧化:
(1)氧化反应:_______________的化学反应,如物质的
燃烧等。
(2)缓慢氧化:进行得很慢甚至不容易被察觉的氧化反
应,如钢铁生锈、呼吸作用、食物腐烂等。
7.氧化物:由_____元素组成且其中一种元素是_______
的_______,如:CO2、H2O、MgO等。
氧元素
化合物
两种
物质与氧气发生
三. 物质组成的表示
化学式及其意义
1.化学式
(1)概念:用_________和_____表示_________的式子。
(2)意义:
宏观:表示一种物质,表示物质的组成元素。
微观:表示物质的一个_____、表示物质的分子构成。
元素符号
数字
物质组成
分子
2.化合价
(1)意义:用以表示元素原子之间相互化合的数目,元素
的化合价有_____和_____之分。
正价
负价
(2)表示方法:通常在元素符号或原子团的_______用
“+n”或“-n”表示,n为1时不能省略。
如:O 表示-2价的氧元素;
正上方
-2
3.一般规律:
(1)金属元素跟非金属元素化合时,金属元素显_____,
非金属元素显_____。
(2)一些元素在不同的化合物中可显不同的化合价。
(3)在化合物中,各元素正、负化合价的代数和等于___。
(4)单质中,元素的化合价为__。
正价
负价
零
0
4.常见原子团的化合价:
铵根离子( ):___价、氢氧根离子(OH-):___价、
硝酸根离子( ):___价、硫酸根离子( ):___价、
碳酸根离子( ):___价。
表示方法如:
+1
-1
-1
-2
-2
5.化学符号周围数字的含义
微粒的个数
分子、原子、离子
每个分子中该元
素原子的个数
每个离子所
带的电荷数
d
元素的化合价
四、有关化学式的计算
1.计算化学式量(相对原子质量):
化学式量=化学式中各原子的_____________×相应_________乘积的总和。
2.计算物质组成元素的质量比:
化合物中各元素的质量比=化学式中各原子的______________与相应_________乘积之比。
3.计算物质中某元素的质量分数:
化合物中某元素的质量分数=___________________________
相对原子质量
原子个数
相对原子质量
原子个数
同学们辛苦了
第四单元
我们周围的空气
单元复习
复习目标:
1.了解空气的主要成分和空气的污染防治。
2.掌握有关氧气的实验室制法及检验。
3.了解氧气的物理性质、用途;掌握氧气的化学性质。
1
知识框图
我们周围的空气
空气的成分
物质组成的表示
空气组成及用途
污染和防治
化学式
氮气(78%)
氧气(21%)
氧气
制法
性质
检验
用途
催化剂
稀有气体
空气污染物
危害与防治
意义
计算
书写
化合价
定义
知识回顾
一. 空气的成分
1.空气中各种成分的分离:
(1)原理:利用空气中各成分的_____不同来分离液态
空气,属于_____变化。
沸点
物理
空气的 成分 氮气(78%) 氧气(21%) 氩气等稀
有气体
用途 ①用作生产氮肥 和硝酸的原料 ②化学性质不活 泼,用作_______ ③液态氮可作 _______ ①________ ②支持燃烧 ③用于冶炼和金属焊接 ①化学性质稳定,
常用作_______
②通电时发出不
同颜色的光,用
于制造_______
保护气
制冷剂
供给呼吸
保护气
电光源
(2)空气各组分含量及用途
2.空气中氧气含量的测定
铜粉和氧气在加热条件下,可生成_____ ________。
反应的化学方程式为_____________ _________。
(1)实验原理:
(2)实验装置图:
△
====
2Cu+O2
2CuO
黑色固体氧化铜
(3)实验现象:红色的铜粉变成_____,注射器内气体体
积_____,减少的体积约为反应前硬质玻璃管和注射器
内空气总体积的____。
(4)实验结论:氧气约占空气总体积的____。
黑色
减少
1/5
1/5
3.空气的污染及防治
(1)空气污染物:
①来源:工业生产和交通运输产生的废气。
②种类:_________和_____。
(2)计入空气污染指数的项目。
①_________ ②_________ ③_________ ④臭氧
⑤可吸入颗粒物 ⑥总悬浮颗粒物
(3)空气质量级别数目越大,空气质量越差。
二氧化硫
一氧化碳
二氧化氮
有害气体
烟尘
二. 氧气
1.实验室制法:
常温下,用_____________和_________混合,其中MnO2
为催化剂。
化学反应方程式为__________________。
过氧化氢溶液
二氧化锰
2H2O2 2H2O+O2↑
MnO2
====
2.实验装置
发生装置:固液常温型
向上排空气法
排水集气法
收集装置:
排水法收集到的气体比排空气法纯净!
3.检验氧气的方法
检验方法: 将带火星的木条放在集气瓶内,如果木条复燃,则说明该气体就是氧气。
在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。
4.催化剂与催化作用
“二不变”:本身的质量和化学性质在反应前后都没有改变
“一变”:改变其他物质的化学反应速率(改变≠加快)
加快或减慢
催化作用:催化剂在化学反应中所起的作用。
5.氧气的物理性质
颜色 气味 状态 密度 溶解性
_____ _____ _____ 比空气_____ _____
溶于水
大
不易
无色
无味
气态
5.氧气的化学性质
在空气中,发出_____,在氧气中,发出_____
红光
白光
C+O2 CO2
点燃
====
在空气中:__________________;在氧气中:剧烈燃烧,_________,放出大量的热,生成一种_____
只能
红热不能燃烧
火星四射
黑色固体
3Fe+2O2 Fe3O4
点燃
====
6.氧化反应和缓慢氧化:
(1)氧化反应:_______________的化学反应,如物质的
燃烧等。
(2)缓慢氧化:进行得很慢甚至不容易被察觉的氧化反
应,如钢铁生锈、呼吸作用、食物腐烂等。
7.氧化物:由_____元素组成且其中一种元素是_______
的_______,如:CO2、H2O、MgO等。
氧元素
化合物
两种
物质与氧气发生
三. 物质组成的表示
化学式及其意义
1.化学式
(1)概念:用_________和_____表示_________的式子。
(2)意义:
宏观:表示一种物质,表示物质的组成元素。
微观:表示物质的一个_____、表示物质的分子构成。
元素符号
数字
物质组成
分子
2.化合价
(1)意义:用以表示元素原子之间相互化合的数目,元素
的化合价有_____和_____之分。
正价
负价
(2)表示方法:通常在元素符号或原子团的_______用
“+n”或“-n”表示,n为1时不能省略。
如:O 表示-2价的氧元素;
正上方
-2
3.一般规律:
(1)金属元素跟非金属元素化合时,金属元素显_____,
非金属元素显_____。
(2)一些元素在不同的化合物中可显不同的化合价。
(3)在化合物中,各元素正、负化合价的代数和等于___。
(4)单质中,元素的化合价为__。
正价
负价
零
0
4.常见原子团的化合价:
铵根离子( ):___价、氢氧根离子(OH-):___价、
硝酸根离子( ):___价、硫酸根离子( ):___价、
碳酸根离子( ):___价。
表示方法如:
+1
-1
-1
-2
-2
5.化学符号周围数字的含义
微粒的个数
分子、原子、离子
每个分子中该元
素原子的个数
每个离子所
带的电荷数
d
元素的化合价
四、有关化学式的计算
1.计算化学式量(相对原子质量):
化学式量=化学式中各原子的_____________×相应_________乘积的总和。
2.计算物质组成元素的质量比:
化合物中各元素的质量比=化学式中各原子的______________与相应_________乘积之比。
3.计算物质中某元素的质量分数:
化合物中某元素的质量分数=___________________________
相对原子质量
原子个数
相对原子质量
原子个数
同学们辛苦了
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
