【新教材】高中化学必修一 同步精讲课件 3.2.2物质的量在化学方程式计算中的应用
文档属性
| 名称 | 【新教材】高中化学必修一 同步精讲课件 3.2.2物质的量在化学方程式计算中的应用 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-19 10:54:25 | ||
图片预览






文档简介
(共16张PPT)
高中化学 RJ版 必修 第一册
1.掌握物质的量在化学方程式计算中的应用,定量研究化学反应中各物质之间的量的关系;
2.了解有关化学方程式的计算技巧。
第二节 金属材料
学习目标
第2课时 物质的量在化学方程式计 算中的应用
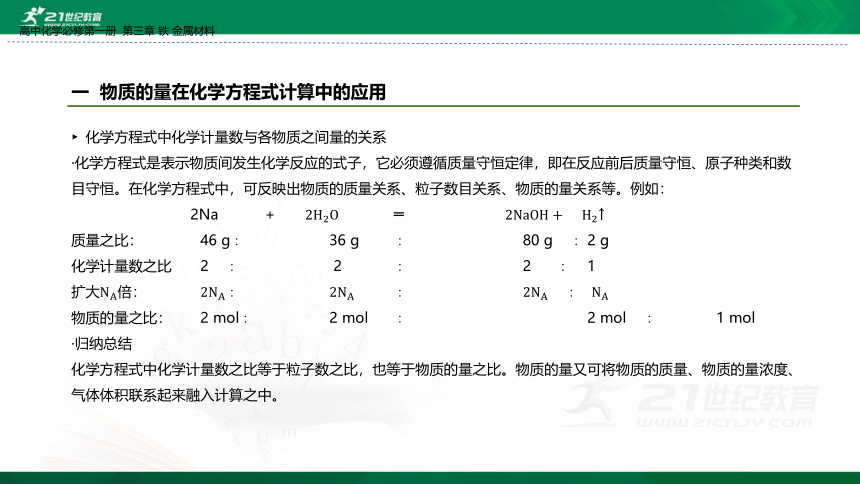
化学方程式中化学计量数与各物质之间量的关系
·化学方程式是表示物质间发生化学反应的式子,它必须遵循质量守恒定律,即在反应前后质量守恒、原子种类和数目守恒。在化学方程式中,可反映出物质的质量关系、粒子数目关系、物质的量关系等。例如:
2Na + ═ ↑
质量之比: 46 g∶ 36 g ∶ 80 g ∶ 2 g
化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1
扩大倍: ∶ ∶ ∶
物质的量之比: 2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol
·归纳总结
化学方程式中化学计量数之比等于粒子数之比,也等于物质的量之比。物质的量又可将物质的质量、物质的量浓度、气体体积联系起来融入计算之中。
一 物质的量在化学方程式计算中的应用
例题解析
[例1] 把6.5 g Zn放入足量盐酸中,锌完全反应。计算:
(1)6.5 g Zn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成的体积(标准状况)。
[分析]根据物质的量、质量和摩尔质量的关系,先计算出6.5 g Zn的物质的量,然后根据化学反应中各物质之间的化学计量数之比,计算出参加反应的HCl的物质的量和生成的体积(标准状况)。
(1)Zn的摩尔质量是65 g·。
n(Zn)===0.1 mol
(2)Zn + 2HCl═↑
1 2
0.1 mol n(HCl)
=
n(HCl)==0.2 mol
(3)Zn + 2HCl═↑
1 mol 22.4 L
0.1 mol
=
==2.24 L
答:(1)6.5 g Zn的物质的量是0.1 mol;
(2)有0.2 mol HCl参加了反应;
(3)生成的体积在标准状况下是2.24 L。
归纳总结
·物质的量用于化学方程式的计算题,一般应遵循下列步骤:
1.写出化学方程式或离子方程式(要确保正确)。
2.在物质化学式的下面列出四个相关量。
某物质A的未知量,可用m(A)、n(A)、V(A)这样的物理量符号表示,也可用x、y这样的字母表示。
在列出的四个相关量中,必须符合“左右量值相当,上下单位相同”原则,否则就是错的。“左右量值相当”,如在上述例题中,1 mol Zn与标准状况下22.4 L (也是1 mol )相当,65 g Zn(也是1 mol Zn)与标准状况下22.4 L 相当。
3.用列出的四个相关量组成比例式或比例式的变式,求出未知量。
4.写出答案。
例1
变式1
变式2
81%
52.9%
1:1
11.2L
关系式法
当已知物和未知物之间是靠多个反应来联系时只需直接确定已知量和未知量之间的比例关系,即“关系式”。
·根据化学方程式确定关系式。写出发生反应的化学方程式,根据量的关系写出关系式。例如,把CO还原生成的通入澄清石灰水中,求生成沉淀的量。发生反应的化学方程式如下:
═↓
则关系式为3CO~~,即CO~。
·根据原子守恒确定关系式。上述例子中也可直接根据碳原子守恒得出CO~。
二 化学计算常用的方法
例2
守恒法
·质量守恒:反应前后元素质量、原子个数不变。
·电子守恒:在氧化还原反应中,还原剂失电子总数=氧化剂得电子总数。
·电荷守恒:在电解质溶液中,所有阳离子所带正电荷总数=所有阴离子所带负电荷总数。
例4
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol
【解析】反应的实质为═↑,═↑,==0.2 mol,则参加反应的= 0.4 mol。若换成稀硫酸,同样产生0.2 mol 。依据得失电子守恒,由→得电子总数为0.2 mol×2=0.4 mol,则Mg、Al在反应中共失去0.4 mol 。0.2 mol Mg提供0.4 mol电子,0.2 mol Al则提供0.6 mol电子,0.2 mol Mg、Al混合物提供的电子数大于0.4 mol小于0.6 mol。
【答案】A
例[2013·山东卷第9题改编]足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是[提示:铝与稀硝酸反应,不产生氢气] ( )
A.氢氧化钠溶液 B.稀硫酸
C.盐酸 D.稀硝酸
解析:Al与硝酸反应不产生H2。
方法一:设Al的质量为54 g,即2 mol
2Al + 2NaOH+2H2O 2NaAlO2+3H2↑
2 2
2 mol 2 mol
2Al + 3H2SO4 Al2(SO4)3+3H2↑
2 3
2 mol 3 mol
【走向高考】
2Al + 6HCl 2AlCl3+3H2↑
2 6
2 mol 6 mol
综上可知,符合题意的为氢氧化钠溶液。
方法二:根据关系式2Al~2NaOH,2Al~3H2SO4,2Al~6HCl及Al与稀硝酸反应不产生氢气可知,A项符合题意。
答案:A
方法技巧:金属与酸反应的规律
金属与酸反应时,金属失去电子的物质的量等于酸得到电子的物质的量,则:
【戮力同心 共赴前程】
生如蝼蚁当立鸿鹄之志
命如纸薄应有不屈之心
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
高中化学 RJ版 必修 第一册
1.掌握物质的量在化学方程式计算中的应用,定量研究化学反应中各物质之间的量的关系;
2.了解有关化学方程式的计算技巧。
第二节 金属材料
学习目标
第2课时 物质的量在化学方程式计 算中的应用
化学方程式中化学计量数与各物质之间量的关系
·化学方程式是表示物质间发生化学反应的式子,它必须遵循质量守恒定律,即在反应前后质量守恒、原子种类和数目守恒。在化学方程式中,可反映出物质的质量关系、粒子数目关系、物质的量关系等。例如:
2Na + ═ ↑
质量之比: 46 g∶ 36 g ∶ 80 g ∶ 2 g
化学计量数之比 2 ∶ 2 ∶ 2 ∶ 1
扩大倍: ∶ ∶ ∶
物质的量之比: 2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol
·归纳总结
化学方程式中化学计量数之比等于粒子数之比,也等于物质的量之比。物质的量又可将物质的质量、物质的量浓度、气体体积联系起来融入计算之中。
一 物质的量在化学方程式计算中的应用
例题解析
[例1] 把6.5 g Zn放入足量盐酸中,锌完全反应。计算:
(1)6.5 g Zn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成的体积(标准状况)。
[分析]根据物质的量、质量和摩尔质量的关系,先计算出6.5 g Zn的物质的量,然后根据化学反应中各物质之间的化学计量数之比,计算出参加反应的HCl的物质的量和生成的体积(标准状况)。
(1)Zn的摩尔质量是65 g·。
n(Zn)===0.1 mol
(2)Zn + 2HCl═↑
1 2
0.1 mol n(HCl)
=
n(HCl)==0.2 mol
(3)Zn + 2HCl═↑
1 mol 22.4 L
0.1 mol
=
==2.24 L
答:(1)6.5 g Zn的物质的量是0.1 mol;
(2)有0.2 mol HCl参加了反应;
(3)生成的体积在标准状况下是2.24 L。
归纳总结
·物质的量用于化学方程式的计算题,一般应遵循下列步骤:
1.写出化学方程式或离子方程式(要确保正确)。
2.在物质化学式的下面列出四个相关量。
某物质A的未知量,可用m(A)、n(A)、V(A)这样的物理量符号表示,也可用x、y这样的字母表示。
在列出的四个相关量中,必须符合“左右量值相当,上下单位相同”原则,否则就是错的。“左右量值相当”,如在上述例题中,1 mol Zn与标准状况下22.4 L (也是1 mol )相当,65 g Zn(也是1 mol Zn)与标准状况下22.4 L 相当。
3.用列出的四个相关量组成比例式或比例式的变式,求出未知量。
4.写出答案。
例1
变式1
变式2
81%
52.9%
1:1
11.2L
关系式法
当已知物和未知物之间是靠多个反应来联系时只需直接确定已知量和未知量之间的比例关系,即“关系式”。
·根据化学方程式确定关系式。写出发生反应的化学方程式,根据量的关系写出关系式。例如,把CO还原生成的通入澄清石灰水中,求生成沉淀的量。发生反应的化学方程式如下:
═↓
则关系式为3CO~~,即CO~。
·根据原子守恒确定关系式。上述例子中也可直接根据碳原子守恒得出CO~。
二 化学计算常用的方法
例2
守恒法
·质量守恒:反应前后元素质量、原子个数不变。
·电子守恒:在氧化还原反应中,还原剂失电子总数=氧化剂得电子总数。
·电荷守恒:在电解质溶液中,所有阳离子所带正电荷总数=所有阴离子所带负电荷总数。
例4
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2 mol
B.参加反应的HCl为0.4 mol
C.Mg、Al在反应中共失去0.4 mol电子
D.若与足量的稀硫酸反应能产生0.2 mol
【解析】反应的实质为═↑,═↑,==0.2 mol,则参加反应的= 0.4 mol。若换成稀硫酸,同样产生0.2 mol 。依据得失电子守恒,由→得电子总数为0.2 mol×2=0.4 mol,则Mg、Al在反应中共失去0.4 mol 。0.2 mol Mg提供0.4 mol电子,0.2 mol Al则提供0.6 mol电子,0.2 mol Mg、Al混合物提供的电子数大于0.4 mol小于0.6 mol。
【答案】A
例[2013·山东卷第9题改编]足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是[提示:铝与稀硝酸反应,不产生氢气] ( )
A.氢氧化钠溶液 B.稀硫酸
C.盐酸 D.稀硝酸
解析:Al与硝酸反应不产生H2。
方法一:设Al的质量为54 g,即2 mol
2Al + 2NaOH+2H2O 2NaAlO2+3H2↑
2 2
2 mol 2 mol
2Al + 3H2SO4 Al2(SO4)3+3H2↑
2 3
2 mol 3 mol
【走向高考】
2Al + 6HCl 2AlCl3+3H2↑
2 6
2 mol 6 mol
综上可知,符合题意的为氢氧化钠溶液。
方法二:根据关系式2Al~2NaOH,2Al~3H2SO4,2Al~6HCl及Al与稀硝酸反应不产生氢气可知,A项符合题意。
答案:A
方法技巧:金属与酸反应的规律
金属与酸反应时,金属失去电子的物质的量等于酸得到电子的物质的量,则:
【戮力同心 共赴前程】
生如蝼蚁当立鸿鹄之志
命如纸薄应有不屈之心
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
