冲刺2022中考必刷解答题(6)金属与酸反应、金属冶炼(含答案)
文档属性
| 名称 | 冲刺2022中考必刷解答题(6)金属与酸反应、金属冶炼(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-04-21 12:07:50 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中考必刷解答题(6)金属与酸反应、金属冶炼
一、金属与酸反应
1.(2021九上·临海期末)为测定黄铜(铜锌合金)样品中铜的质量分数,某同学先将样品粉碎,再加入足量稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示。请回答:
(1)黄铜属于 (填“金属材料”或“有机材料”)。
(2)样品中铜的质量是 克。
(3)恰好完全反应时,所得溶液中溶质的质量分数是多少?(计算结果精确到0.1%)
2.(2021九上·新昌期末)在5.6g铁粉中,先逐滴加入M1克Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量(生成溶质均未达到饱和状态)与所加溶液总质量的关系如图所示。
请根据题目所给信息回答下列问题:
(1)写出ab段发生的反应的化学方程式: 。
(2)e点对应的固体为 ,溶液中的溶质有 种。
(3)若c点所得溶液质量为100克,请计算c点溶质的质量分数。
3.(2022九上·慈溪竞赛)已知钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑。质量均为mg的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应。
(1)由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn。请按以上表示,写出所有可能情况。
(2)试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围 。
(3)m=4.6时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图。请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线。(在图线上用元素符号注明)
4.(2021九上·舟山月考)日常生活中接触的金属材料,大多属于合金。其中黄铜是以锌作为主要添加元素的铜合金。已知组成某蛋壳的黄铜中只含有锌和铜,现将22g该弹壳碾成粉末后放入盛有足量的稀硫酸烧杯中,测的反应过程中生成的氢气的质量(单位为g)与反应时间(单位为min)的关系如图所示。试计算:
(1)由题意可知,反应生成氢气的质量共 g;
(2)若欲计算反应后所得溶液的质量,你认为至少还应该补充的一个条件是 。
(3)弹壳中铜的质量(计算结果精确至0.1,情书写出计算过程)?
5.(2021九上·温州期中)“银粉”常用作化工颜料的添加剂。通过调查,小明知道“银粉”可能是银或铝。为探究“银粉”的成分,小明购买了某厂家的“银粉”进行实验,将一定量的“银粉”放在烧杯中,放在电子天平上,向其中加入稀盐酸(如图甲)。
(1)小明观察到 现象,说明“银粉”是金属铝。
(2)若要测定“银粉”中金属的相对原子质量,从而确定“银粉”中的金属是铝,则在实验中应该测量的数据是 。
(3)长期放置,“银粉”中的铝可能被部分氧化,小明取一定量的的“银粉”分三次加入相同质量的稀盐酸中,记录每次烧杯中剩余物质的总质量,并绘制成如图乙所示曲线。图乙中,a点表示烧杯中的稀盐酸恰好完全反应。若“银粉”中的铝被氧化程度越大,则a点的位置会向①②③④中哪个方向移到,并说明理由。
6.(2021九上·龙湾期中)小科看到同桌在喝可乐,想到老师曾说过易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应)。为探究铝镁合金的组成,取16g铝镁合金样品,将80g氢氧化钠溶液平均分成四份依次加入到样品中(镁与氢氧化钠溶液不反应),铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数 第一次 第二次 第三次 第四次
剩余固体的质量/克 10.6 m 4.0 4.0
试计算:
(1)分析表中数据可知,第二次反应结束后,剩余固体质量m是 克。
(2)该铝镁合金中铝的质量分数 。
(3)所用氢氧化钠溶液中溶质的质量分数?
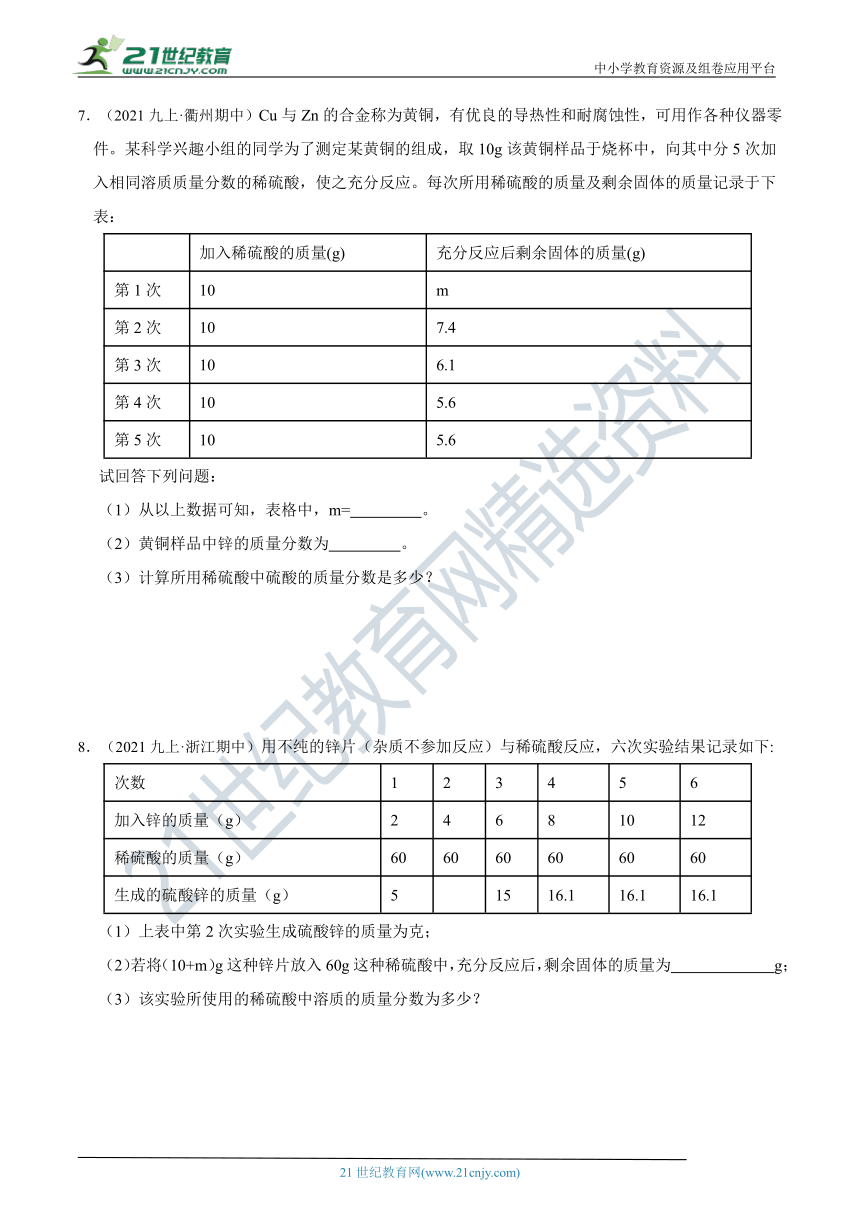
7.(2021九上·衢州期中)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某科学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 10 m
第2次 10 7.4
第3次 10 6.1
第4次 10 5.6
第5次 10 5.6
试回答下列问题:
(1)从以上数据可知,表格中,m= 。
(2)黄铜样品中锌的质量分数为 。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
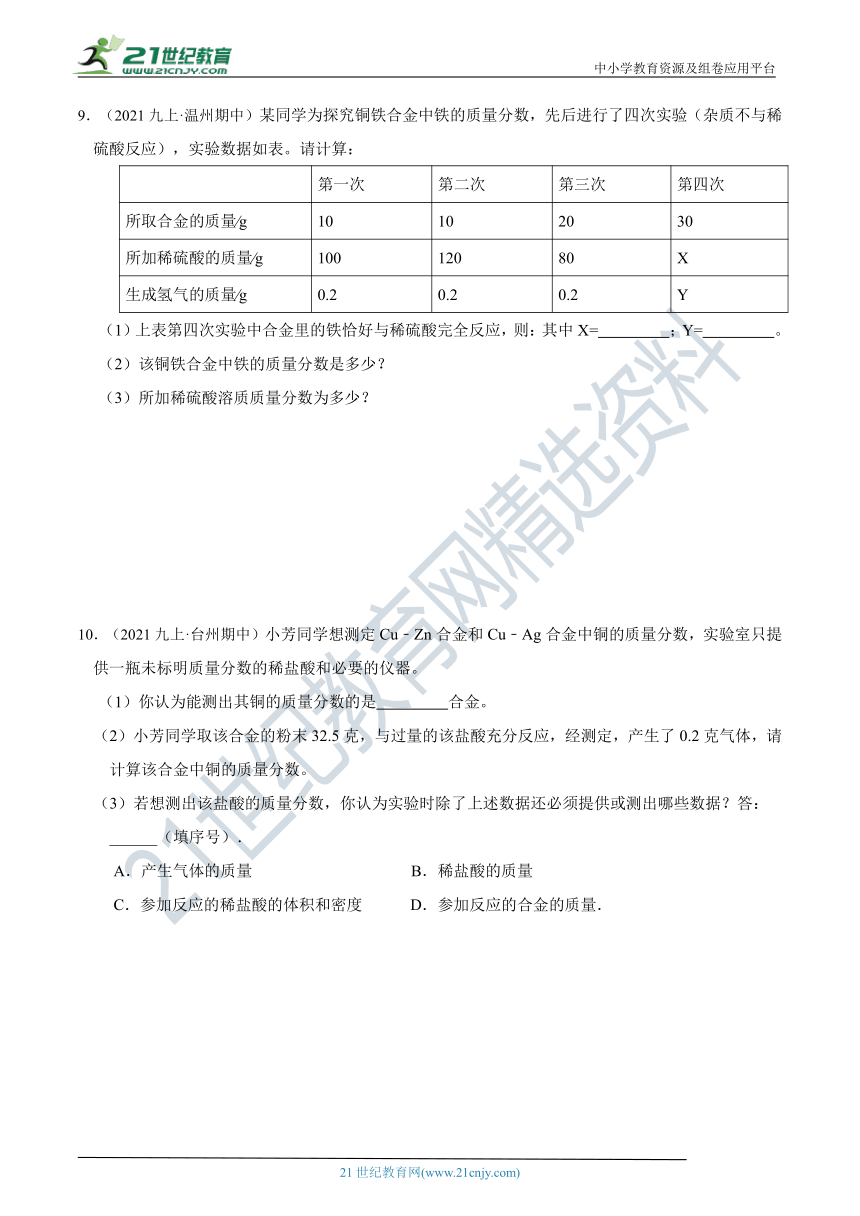
8.(2021九上·浙江期中)用不纯的锌片(杂质不参加反应)与稀硫酸反应,六次实验结果记录如下:
次数 1 2 3 4 5 6
加入锌的质量(g) 2 4 6 8 10 12
稀硫酸的质量(g) 60 60 60 60 60 60
生成的硫酸锌的质量(g) 5
15 16.1 16.1 16.1
(1)上表中第2次实验生成硫酸锌的质量为克;
(2)若将(10+m)g这种锌片放入60g这种稀硫酸中,充分反应后,剩余固体的质量为 g;
(3)该实验所使用的稀硫酸中溶质的质量分数为多少?
9.(2021九上·温州期中)某同学为探究铜铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如表。请计算:
第一次 第二次 第三次 第四次
所取合金的质量∕g 10 10 20 30
所加稀硫酸的质量∕g 100 120 80 X
生成氢气的质量∕g 0.2 0.2 0.2 Y
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则:其中X= ;Y= 。
(2)该铜铁合金中铁的质量分数是多少?
(3)所加稀硫酸溶质质量分数为多少?
10.(2021九上·台州期中)小芳同学想测定Cu﹣Zn合金和Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是 合金。
(2)小芳同学取该合金的粉末32.5克,与过量的该盐酸充分反应,经测定,产生了0.2克气体,请计算该合金中铜的质量分数。
(3)若想测出该盐酸的质量分数,你认为实验时除了上述数据还必须提供或测出哪些数据?答:______(填序号).
A.产生气体的质量 B.稀盐酸的质量
C.参加反应的稀盐酸的体积和密度 D.参加反应的合金的质量.
11.(2021九上·新昌期中)小柯同学想测定Cu﹣Zn合金和Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是 合金;
(2)小柯同学取该合金的粉末32.5克,与足量的该盐酸充分反应,经测定,产生了0.2克气体,请计算该合金中铜的质量分数。(列式计算)
二、金属冶炼
12.(2021九上·嵊州期末)某化肥厂以“钾泻盐”(MgSO4·KCl·nH20)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:
试可答下列问题;
(1)加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了 外,还生成了微溶的Ag2SO4。
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)外,一定含有的溶质是 。
(3)该钾泻盐样品中KCl的质量分数为多少 (精确到1%)
(4)该钾泻盐化学式中n的值是多少 (要写出计算过程)
13.(2021九上·温州期中)某矿石由MgO、Fe2O3和SiO2组成其制备氢氧化镁的流程示意图如图:
(1)加入稀盐酸反应后,能采用过滤方法分离A与SiO2的原因是 。
(2)在溶液A中加入熟石灰固体调节溶液的.pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。现调节溶液B的pH值范围是4- 8,目的是 。
氢氧化物 Fe(OH)3 Mg(OH)2
开始沉淀的 pH 1.5 8.6
完全沉淀的 pH 3.2 11.1
(3)该实验过程中,熟石灰固体比氢氧化钠固体能更精确地调节溶液的pH,理由是 。
14.(2021九上·衢州期中)实验室可用下图装置模拟工业炼铁.
(1)装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是 。
(2)若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨?(计算结果保留一位小数)
15.(2021九上·萧山期中)某科学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了 13.6g 固体样品,用图 a 所示的装置继续实验,测定的部分数据如图 b 所示。
(1)请写出玻璃管内发生的化学方 程式 。
(2)固体样品中氧化铁的质量是 克。
16.(2021九上·绍兴期中)工业上利用Fe2O3和CO在高温下炼制铁(3CO+Fe2O3 2Fe+3CO2),试通过计算回答
(1)用80吨Fe2O3和足量CO反应可炼得多少铁
(2)现在治铁得到56吨铁需80%的赤铁矿石多少吨
17.(2021九上·洞头期中)实验室模拟炼铁的实验装置如图所示。
(1)实验中看到的现象:玻璃管中的粉末 。
(2)用600吨含氧化铁质量分数为80%的赤铁矿,可以炼出含杂质4%的生铁多少吨?(反应的化学方程式为3CO+Fe2O3 2Fe+3CO2)
18.(2021九上·新昌期中)为测定含杂质(杂质不参加反应)的氧化铜样品中氧化铜的质量分数。小柯同学取了10克氧化铜样品利用下图所示装置进行了实验,并分别称量了部分装置反应前后的质量情况,得到下表中的两组数据:
反应前 完全反应后
A组 玻璃管和固体物质的质量共42.5克 玻璃管和固体物质的质量共40.9克
B组 U形管和其中物质的质量共180.0克 U形管和其中物质的质量共182.3克
请回答下列问题:
(1)小柯分析后决定用A组数据进行计算,且得出A组中玻璃管和固体物质反应前后减少的质量是 元素的质量,并计算得出样品中氧化铜的质量为 ;
(2)小柯不选择“B组”实验数据来计算样品中的氧化铜的质量分数,原因是 ;
(3)若要使两组数据计算得到的结果一样,应将图中装有 (写试剂名称)的E装置连接在图中A和B装置之间。
第1次 第2次 第3次 第4次
加入稀硫酸质量(g) 200 200 200 200
剩余固体质量(g) 37.6 15.2 4 4
19.(2021九上·定海月考)某化学兴趣小组为了分析铁碳混合物中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:
(1)第2次测得剩余固体中铁和碳的质量分别是 、 .
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)计算所用稀硫酸的溶质质量分数为多少?(写出计算过程,结果保留到小数点后一位)
并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
20.(2021九上·温州期中)为了探究氧化铜与木炭的反应及反应产物,小联将氧化铜粉末和木炭充分混合,取少许混合物平铺于试管底,如图所示连接好整个实验装置。
(1)实验开始前,对装置进行气密性检查,其检验方法是 。
(2)实验过程中,当观察到 现象,可判断一定发生化 学反应。
(3)实验开始前,称量试管与其内固体总质量为40克,实验结束后称量试管与剩余固体总质量为35.6克,求该实验生成铜单质的质量。
21.(2021九上·长兴期中)某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据图2所示.请计算:
(1)固体样品中氧化铁的质量是多少克?
(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.
答案解析部分
1.【答案】(1)金属材料
(2)7
(3)解:设生成的ZnSO4质量为x,生成H2质量为y
Zn+H2SO4= H2↑+ ZnSO4
65 2 161
13g y x
解得x=0.4g
y=32.2g
A%= ×100%= ×100%=28.6%
2.【答案】(1)Fe+Cu(NO ) =Fe(NO ) +Cu
(2)Ag;3
(3)解:ac段反生的反应有:Fe+Cu(NO ) =Fe(NO ) +Cu
Fe+AgNO =Fe(NO ) +2Ag
可知c点所得溶液中的溶质为Fe(NO ) ,设生成Fe(NO ) 的质量为x,
且5.6克铁粉全部反应,则可得出:
Fe~ Fe(NO )
56 180
5.6克 x
得出x=18克
Fe(NO ) %=
3.【答案】(1)Na>Mg>Zn Na=Mg>Zn Mg>Na>Zn
(2)m≥3.25(3)
4.【答案】(1)0.2
(2)稀硫酸的质量
(3)设黄铜中锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
;
解得:x=6.5g。
弹壳中铜的质量为:22g-6.5g=15.5g。
5.【答案】(1)产生大量的气泡
(2)参加反应的“银粉”质量、氢气的体积(或质量)
(3)解:向③移到。铝被氧化的程度越大,铝的质量越少,产生的氢气质量越少,剩余溶液的质量越大; 等质量的铝比等质量的氧化铝消耗的盐酸质量更多,因此铝质量越少,消耗相同质量的盐酸,需要的“银粉”质量更多。
6.【答案】(1)5.2
(2)75%
(3)第一次所加20g氢氧化钠溶液能反应的铝的质量为:16g 10.6g=5.4g
设20g氢氧化钠溶液中溶质的质量为x
2Al+ 2NaOH+2H2O═2NaAlO2+3H2↑
54 80
5.4g x
列比例式: ,
解得x=8g
所用氢氧化钠溶液中溶质的质量分数= ×100%=40%
答:所用氢氧化钠溶液中溶质的质量分数为40%.
7.【答案】(1)8.7
(2)44%
(3)设所用稀硫酸中硫酸的质量分数为x
H2SO4 + Zn═ZnSO4+H2↑
98 65
10g·x 1.3g
=
x=19.6%(溶液具有均一性,用其它合理数据计算都可以)
8.【答案】(1)由表中数据可知,每多加入2克锌完全反应,产生硫酸锌的质量为5克,同第2次实验生成硫酸锌质量为10克;
(2)(m+3.5)g
(3)设该硫酸中溶质质量分数为y
Zn+H2SO4=ZnSO4+H2
98 161
60gy 16.1g
98:161=60gy:16.1g
y= 16.3%
9.【答案】(1)240;0.6
(2)解:设第四次实验所取合金中铁的质量为x,参加反应的硫酸质量为y
Fe+ H2SO4=FeSO4+ H2↑
56 98 2
x y 0.6g
x=16.8g
y=29.4g
铁合金中铁的质量分数为 =56%
答:该铜铁合金中铁的质量分数是56%;
(3)解:所加稀硫酸溶质质量分数为 =12.25%
答:所加稀硫酸溶质质量分数为12.25%。
10.【答案】(1)Cu﹣Zn
(2)解:设32.5克粉末中锌的质量为xx。
Zn+2HCl=ZnCl2+ H2↑
65 2
x 0.2g
解得:X=6.5g
铜的质量分数= %=80%
答:合金中铜的质量分数为80%。
(3)C
11.【答案】(1)Cu-Zn
(2)解:设合金中的锌的质量为Xg;
Zn+2HCl=ZnCl2+H2↑
65 2
X g 0.2g
=
X=6.5g
故铜的质量=32.5g-6.5g=26g,
Cu%=×100%=×100%=80%
答: 该合金中铜的质量分数80% 。
12.【答案】(1)AgCl
(2)KCl和Mg(NO3)2
(3)解: 钾泻盐样品中KCl的质量分数
AgNO3+KCl=AgCl+KNO3,
74.5 143.5
x 14.35克
x =7.45克
KCl%=
(4)解: 先出MgSO4的质量 和 结晶水的质量 ,再进行分析计算。
MgSO4+Ba(NO3)2 =BaSO4 +Mg(NO3)2
120 233
X 23.3g
x=12g
结晶水的质量 =24.85g-12g-7.45g=5.4g
水的相对分子质量为18,故n=3。
13.【答案】(1)A中溶质可溶,而二氧化硅不溶
(2)使铁离子完全沉淀,镁离子不能沉淀
(3)氧化钙溶解度远小于氢氧化钠的溶解度,便于控制固体用量
14.【答案】(1)处理尾气
(2)解:设可提炼出含铁的质量分数为 96% 的生铁的质量为 x。
3CO+ Fe2O3= 2Fe+3CO2
160 112
100t×80% x×96%
x =58.3t
本题还可以根据化学式直接计算:
解:铁矿石中含Fe2O3的质量mFe2O3=100t×80%=80吨
80t×2Fe/Fe2O3=80t×112/160=56t
=58.3t
答:提炼出的生铁质量约为 58.3t吨。
15.【答案】(1)3CO+Fe2O3=2Fe+3CO2(2)8
16.【答案】(1)设用80吨Fe2O3和足量CO反应可炼铁的质量为x
3CO+Fe2O3 2Fe+3CO2
160 112
80吨 x
x=56吨;
答:用80吨Fe2O3和足量CO反应可炼得56吨铁
(2)设得到56t铁需要80%的赤铁矿石质量为y,
3CO+Fe2O3 2Fe+3CO2
160 112
80%y 56
y=100吨;
答:治铁得到56吨铁需80%的赤铁矿石100吨。
17.【答案】(1)由红棕色逐渐变黑
(2)解:600吨含氧化铁质量分数80%的赤铁矿中氧化铁的质量为600吨×80%=480吨,
设理论上可炼出含杂质4%的生铁的质量为x
3CO+ Fe2O3 2Fe+3CO2
160 112
480吨 (1-4%)x
x=350吨
答:理论上可炼出含杂质4%的生铁350吨。
18.【答案】(1)氧;8g
(2)A装置中产生的氢气中带有水蒸气
(3)浓H2SO4
19.【答案】(1)11.2g;4g
(2)根据表格分析可得碳的质量是4g,则铁的质量为 60g -4g=56g
生铁中铁的质量分数为:
(3)19.6%
20.【答案】(1)把导管口浸入液体中,用手握住试管,若导管口有气泡冒出,则装置气密性好
(2)试管内出现黑色物质变红或澄清石灰水变浑浊
(3)解:设铜单质的质量为x
C+ 2CuO=2Cu+ CO2↑
128 44
x 40克-35.6克
x=12.8克
21.【答案】(1)解:设固体样品中氧化铁的质量为x,则
Fe2O3+3CO 2Fe+3CO2 固体减重
160 112 160-112
x 13.6g-11.2g
解得:x=8g
(2)解:设生成的氯化铁和氢气质量分别为y、z,则
Fe+2HCl= FeCl2+ H2↑
56 127 2
11.2g y z
解得y=25.4g;z=0.4g
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
中考必刷解答题(6)金属与酸反应、金属冶炼
一、金属与酸反应
1.(2021九上·临海期末)为测定黄铜(铜锌合金)样品中铜的质量分数,某同学先将样品粉碎,再加入足量稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示。请回答:
(1)黄铜属于 (填“金属材料”或“有机材料”)。
(2)样品中铜的质量是 克。
(3)恰好完全反应时,所得溶液中溶质的质量分数是多少?(计算结果精确到0.1%)
2.(2021九上·新昌期末)在5.6g铁粉中,先逐滴加入M1克Cu(NO3)2溶液,充分反应后再逐滴加入AgNO3溶液,剩余固体质量(生成溶质均未达到饱和状态)与所加溶液总质量的关系如图所示。
请根据题目所给信息回答下列问题:
(1)写出ab段发生的反应的化学方程式: 。
(2)e点对应的固体为 ,溶液中的溶质有 种。
(3)若c点所得溶液质量为100克,请计算c点溶质的质量分数。
3.(2022九上·慈溪竞赛)已知钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑。质量均为mg的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应。
(1)由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn。请按以上表示,写出所有可能情况。
(2)试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围 。
(3)m=4.6时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图。请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线。(在图线上用元素符号注明)
4.(2021九上·舟山月考)日常生活中接触的金属材料,大多属于合金。其中黄铜是以锌作为主要添加元素的铜合金。已知组成某蛋壳的黄铜中只含有锌和铜,现将22g该弹壳碾成粉末后放入盛有足量的稀硫酸烧杯中,测的反应过程中生成的氢气的质量(单位为g)与反应时间(单位为min)的关系如图所示。试计算:
(1)由题意可知,反应生成氢气的质量共 g;
(2)若欲计算反应后所得溶液的质量,你认为至少还应该补充的一个条件是 。
(3)弹壳中铜的质量(计算结果精确至0.1,情书写出计算过程)?
5.(2021九上·温州期中)“银粉”常用作化工颜料的添加剂。通过调查,小明知道“银粉”可能是银或铝。为探究“银粉”的成分,小明购买了某厂家的“银粉”进行实验,将一定量的“银粉”放在烧杯中,放在电子天平上,向其中加入稀盐酸(如图甲)。
(1)小明观察到 现象,说明“银粉”是金属铝。
(2)若要测定“银粉”中金属的相对原子质量,从而确定“银粉”中的金属是铝,则在实验中应该测量的数据是 。
(3)长期放置,“银粉”中的铝可能被部分氧化,小明取一定量的的“银粉”分三次加入相同质量的稀盐酸中,记录每次烧杯中剩余物质的总质量,并绘制成如图乙所示曲线。图乙中,a点表示烧杯中的稀盐酸恰好完全反应。若“银粉”中的铝被氧化程度越大,则a点的位置会向①②③④中哪个方向移到,并说明理由。
6.(2021九上·龙湾期中)小科看到同桌在喝可乐,想到老师曾说过易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应)。为探究铝镁合金的组成,取16g铝镁合金样品,将80g氢氧化钠溶液平均分成四份依次加入到样品中(镁与氢氧化钠溶液不反应),铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数 第一次 第二次 第三次 第四次
剩余固体的质量/克 10.6 m 4.0 4.0
试计算:
(1)分析表中数据可知,第二次反应结束后,剩余固体质量m是 克。
(2)该铝镁合金中铝的质量分数 。
(3)所用氢氧化钠溶液中溶质的质量分数?
7.(2021九上·衢州期中)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某科学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第1次 10 m
第2次 10 7.4
第3次 10 6.1
第4次 10 5.6
第5次 10 5.6
试回答下列问题:
(1)从以上数据可知,表格中,m= 。
(2)黄铜样品中锌的质量分数为 。
(3)计算所用稀硫酸中硫酸的质量分数是多少?
8.(2021九上·浙江期中)用不纯的锌片(杂质不参加反应)与稀硫酸反应,六次实验结果记录如下:
次数 1 2 3 4 5 6
加入锌的质量(g) 2 4 6 8 10 12
稀硫酸的质量(g) 60 60 60 60 60 60
生成的硫酸锌的质量(g) 5
15 16.1 16.1 16.1
(1)上表中第2次实验生成硫酸锌的质量为克;
(2)若将(10+m)g这种锌片放入60g这种稀硫酸中,充分反应后,剩余固体的质量为 g;
(3)该实验所使用的稀硫酸中溶质的质量分数为多少?
9.(2021九上·温州期中)某同学为探究铜铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如表。请计算:
第一次 第二次 第三次 第四次
所取合金的质量∕g 10 10 20 30
所加稀硫酸的质量∕g 100 120 80 X
生成氢气的质量∕g 0.2 0.2 0.2 Y
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则:其中X= ;Y= 。
(2)该铜铁合金中铁的质量分数是多少?
(3)所加稀硫酸溶质质量分数为多少?
10.(2021九上·台州期中)小芳同学想测定Cu﹣Zn合金和Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是 合金。
(2)小芳同学取该合金的粉末32.5克,与过量的该盐酸充分反应,经测定,产生了0.2克气体,请计算该合金中铜的质量分数。
(3)若想测出该盐酸的质量分数,你认为实验时除了上述数据还必须提供或测出哪些数据?答:______(填序号).
A.产生气体的质量 B.稀盐酸的质量
C.参加反应的稀盐酸的体积和密度 D.参加反应的合金的质量.
11.(2021九上·新昌期中)小柯同学想测定Cu﹣Zn合金和Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是 合金;
(2)小柯同学取该合金的粉末32.5克,与足量的该盐酸充分反应,经测定,产生了0.2克气体,请计算该合金中铜的质量分数。(列式计算)
二、金属冶炼
12.(2021九上·嵊州期末)某化肥厂以“钾泻盐”(MgSO4·KCl·nH20)为原料制造高质量钾肥,化肥中KCl含量的高低会直接影响着化肥的品质。某兴趣小组为了测定“钾泻盐”中KCl的质量分数及n的值,设计了如下两种实验方案:
试可答下列问题;
(1)加入足量AgNO3溶液后,方案二中生成固体的成量大于方案一,原为是方案二中所得28.7克固体物质中除生成了 外,还生成了微溶的Ag2SO4。
(2)方案一中,滴加足量的Ba(NO3)2溶液,过滤后所得滤液中除可能含有Ba(NO)外,一定含有的溶质是 。
(3)该钾泻盐样品中KCl的质量分数为多少 (精确到1%)
(4)该钾泻盐化学式中n的值是多少 (要写出计算过程)
13.(2021九上·温州期中)某矿石由MgO、Fe2O3和SiO2组成其制备氢氧化镁的流程示意图如图:
(1)加入稀盐酸反应后,能采用过滤方法分离A与SiO2的原因是 。
(2)在溶液A中加入熟石灰固体调节溶液的.pH,可以使溶液中的阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。现调节溶液B的pH值范围是4- 8,目的是 。
氢氧化物 Fe(OH)3 Mg(OH)2
开始沉淀的 pH 1.5 8.6
完全沉淀的 pH 3.2 11.1
(3)该实验过程中,熟石灰固体比氢氧化钠固体能更精确地调节溶液的pH,理由是 。
14.(2021九上·衢州期中)实验室可用下图装置模拟工业炼铁.
(1)装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是 。
(2)若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨?(计算结果保留一位小数)
15.(2021九上·萧山期中)某科学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了 13.6g 固体样品,用图 a 所示的装置继续实验,测定的部分数据如图 b 所示。
(1)请写出玻璃管内发生的化学方 程式 。
(2)固体样品中氧化铁的质量是 克。
16.(2021九上·绍兴期中)工业上利用Fe2O3和CO在高温下炼制铁(3CO+Fe2O3 2Fe+3CO2),试通过计算回答
(1)用80吨Fe2O3和足量CO反应可炼得多少铁
(2)现在治铁得到56吨铁需80%的赤铁矿石多少吨
17.(2021九上·洞头期中)实验室模拟炼铁的实验装置如图所示。
(1)实验中看到的现象:玻璃管中的粉末 。
(2)用600吨含氧化铁质量分数为80%的赤铁矿,可以炼出含杂质4%的生铁多少吨?(反应的化学方程式为3CO+Fe2O3 2Fe+3CO2)
18.(2021九上·新昌期中)为测定含杂质(杂质不参加反应)的氧化铜样品中氧化铜的质量分数。小柯同学取了10克氧化铜样品利用下图所示装置进行了实验,并分别称量了部分装置反应前后的质量情况,得到下表中的两组数据:
反应前 完全反应后
A组 玻璃管和固体物质的质量共42.5克 玻璃管和固体物质的质量共40.9克
B组 U形管和其中物质的质量共180.0克 U形管和其中物质的质量共182.3克
请回答下列问题:
(1)小柯分析后决定用A组数据进行计算,且得出A组中玻璃管和固体物质反应前后减少的质量是 元素的质量,并计算得出样品中氧化铜的质量为 ;
(2)小柯不选择“B组”实验数据来计算样品中的氧化铜的质量分数,原因是 ;
(3)若要使两组数据计算得到的结果一样,应将图中装有 (写试剂名称)的E装置连接在图中A和B装置之间。
第1次 第2次 第3次 第4次
加入稀硫酸质量(g) 200 200 200 200
剩余固体质量(g) 37.6 15.2 4 4
19.(2021九上·定海月考)某化学兴趣小组为了分析铁碳混合物中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:
(1)第2次测得剩余固体中铁和碳的质量分别是 、 .
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)计算所用稀硫酸的溶质质量分数为多少?(写出计算过程,结果保留到小数点后一位)
并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
20.(2021九上·温州期中)为了探究氧化铜与木炭的反应及反应产物,小联将氧化铜粉末和木炭充分混合,取少许混合物平铺于试管底,如图所示连接好整个实验装置。
(1)实验开始前,对装置进行气密性检查,其检验方法是 。
(2)实验过程中,当观察到 现象,可判断一定发生化 学反应。
(3)实验开始前,称量试管与其内固体总质量为40克,实验结束后称量试管与剩余固体总质量为35.6克,求该实验生成铜单质的质量。
21.(2021九上·长兴期中)某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成,他们称取了13.6g固体样品,用图1所示的装置继续实验,测定的部分数据图2所示.请计算:
(1)固体样品中氧化铁的质量是多少克?
(2)在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.
答案解析部分
1.【答案】(1)金属材料
(2)7
(3)解:设生成的ZnSO4质量为x,生成H2质量为y
Zn+H2SO4= H2↑+ ZnSO4
65 2 161
13g y x
解得x=0.4g
y=32.2g
A%= ×100%= ×100%=28.6%
2.【答案】(1)Fe+Cu(NO ) =Fe(NO ) +Cu
(2)Ag;3
(3)解:ac段反生的反应有:Fe+Cu(NO ) =Fe(NO ) +Cu
Fe+AgNO =Fe(NO ) +2Ag
可知c点所得溶液中的溶质为Fe(NO ) ,设生成Fe(NO ) 的质量为x,
且5.6克铁粉全部反应,则可得出:
Fe~ Fe(NO )
56 180
5.6克 x
得出x=18克
Fe(NO ) %=
3.【答案】(1)Na>Mg>Zn Na=Mg>Zn Mg>Na>Zn
(2)m≥3.25(3)
4.【答案】(1)0.2
(2)稀硫酸的质量
(3)设黄铜中锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
;
解得:x=6.5g。
弹壳中铜的质量为:22g-6.5g=15.5g。
5.【答案】(1)产生大量的气泡
(2)参加反应的“银粉”质量、氢气的体积(或质量)
(3)解:向③移到。铝被氧化的程度越大,铝的质量越少,产生的氢气质量越少,剩余溶液的质量越大; 等质量的铝比等质量的氧化铝消耗的盐酸质量更多,因此铝质量越少,消耗相同质量的盐酸,需要的“银粉”质量更多。
6.【答案】(1)5.2
(2)75%
(3)第一次所加20g氢氧化钠溶液能反应的铝的质量为:16g 10.6g=5.4g
设20g氢氧化钠溶液中溶质的质量为x
2Al+ 2NaOH+2H2O═2NaAlO2+3H2↑
54 80
5.4g x
列比例式: ,
解得x=8g
所用氢氧化钠溶液中溶质的质量分数= ×100%=40%
答:所用氢氧化钠溶液中溶质的质量分数为40%.
7.【答案】(1)8.7
(2)44%
(3)设所用稀硫酸中硫酸的质量分数为x
H2SO4 + Zn═ZnSO4+H2↑
98 65
10g·x 1.3g
=
x=19.6%(溶液具有均一性,用其它合理数据计算都可以)
8.【答案】(1)由表中数据可知,每多加入2克锌完全反应,产生硫酸锌的质量为5克,同第2次实验生成硫酸锌质量为10克;
(2)(m+3.5)g
(3)设该硫酸中溶质质量分数为y
Zn+H2SO4=ZnSO4+H2
98 161
60gy 16.1g
98:161=60gy:16.1g
y= 16.3%
9.【答案】(1)240;0.6
(2)解:设第四次实验所取合金中铁的质量为x,参加反应的硫酸质量为y
Fe+ H2SO4=FeSO4+ H2↑
56 98 2
x y 0.6g
x=16.8g
y=29.4g
铁合金中铁的质量分数为 =56%
答:该铜铁合金中铁的质量分数是56%;
(3)解:所加稀硫酸溶质质量分数为 =12.25%
答:所加稀硫酸溶质质量分数为12.25%。
10.【答案】(1)Cu﹣Zn
(2)解:设32.5克粉末中锌的质量为xx。
Zn+2HCl=ZnCl2+ H2↑
65 2
x 0.2g
解得:X=6.5g
铜的质量分数= %=80%
答:合金中铜的质量分数为80%。
(3)C
11.【答案】(1)Cu-Zn
(2)解:设合金中的锌的质量为Xg;
Zn+2HCl=ZnCl2+H2↑
65 2
X g 0.2g
=
X=6.5g
故铜的质量=32.5g-6.5g=26g,
Cu%=×100%=×100%=80%
答: 该合金中铜的质量分数80% 。
12.【答案】(1)AgCl
(2)KCl和Mg(NO3)2
(3)解: 钾泻盐样品中KCl的质量分数
AgNO3+KCl=AgCl+KNO3,
74.5 143.5
x 14.35克
x =7.45克
KCl%=
(4)解: 先出MgSO4的质量 和 结晶水的质量 ,再进行分析计算。
MgSO4+Ba(NO3)2 =BaSO4 +Mg(NO3)2
120 233
X 23.3g
x=12g
结晶水的质量 =24.85g-12g-7.45g=5.4g
水的相对分子质量为18,故n=3。
13.【答案】(1)A中溶质可溶,而二氧化硅不溶
(2)使铁离子完全沉淀,镁离子不能沉淀
(3)氧化钙溶解度远小于氢氧化钠的溶解度,便于控制固体用量
14.【答案】(1)处理尾气
(2)解:设可提炼出含铁的质量分数为 96% 的生铁的质量为 x。
3CO+ Fe2O3= 2Fe+3CO2
160 112
100t×80% x×96%
x =58.3t
本题还可以根据化学式直接计算:
解:铁矿石中含Fe2O3的质量mFe2O3=100t×80%=80吨
80t×2Fe/Fe2O3=80t×112/160=56t
=58.3t
答:提炼出的生铁质量约为 58.3t吨。
15.【答案】(1)3CO+Fe2O3=2Fe+3CO2(2)8
16.【答案】(1)设用80吨Fe2O3和足量CO反应可炼铁的质量为x
3CO+Fe2O3 2Fe+3CO2
160 112
80吨 x
x=56吨;
答:用80吨Fe2O3和足量CO反应可炼得56吨铁
(2)设得到56t铁需要80%的赤铁矿石质量为y,
3CO+Fe2O3 2Fe+3CO2
160 112
80%y 56
y=100吨;
答:治铁得到56吨铁需80%的赤铁矿石100吨。
17.【答案】(1)由红棕色逐渐变黑
(2)解:600吨含氧化铁质量分数80%的赤铁矿中氧化铁的质量为600吨×80%=480吨,
设理论上可炼出含杂质4%的生铁的质量为x
3CO+ Fe2O3 2Fe+3CO2
160 112
480吨 (1-4%)x
x=350吨
答:理论上可炼出含杂质4%的生铁350吨。
18.【答案】(1)氧;8g
(2)A装置中产生的氢气中带有水蒸气
(3)浓H2SO4
19.【答案】(1)11.2g;4g
(2)根据表格分析可得碳的质量是4g,则铁的质量为 60g -4g=56g
生铁中铁的质量分数为:
(3)19.6%
20.【答案】(1)把导管口浸入液体中,用手握住试管,若导管口有气泡冒出,则装置气密性好
(2)试管内出现黑色物质变红或澄清石灰水变浑浊
(3)解:设铜单质的质量为x
C+ 2CuO=2Cu+ CO2↑
128 44
x 40克-35.6克
x=12.8克
21.【答案】(1)解:设固体样品中氧化铁的质量为x,则
Fe2O3+3CO 2Fe+3CO2 固体减重
160 112 160-112
x 13.6g-11.2g
解得:x=8g
(2)解:设生成的氯化铁和氢气质量分别为y、z,则
Fe+2HCl= FeCl2+ H2↑
56 127 2
11.2g y z
解得y=25.4g;z=0.4g
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
