2022年化学中考备考复习专题突破——实验探究(一)(课件48页)
文档属性
| 名称 | 2022年化学中考备考复习专题突破——实验探究(一)(课件48页) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-22 09:53:33 | ||
图片预览









文档简介
(共48张PPT)
2022年化学中考备考复习专题突破——
实验探究(一)
夯实基础
科学探究的基本要素包括:提出问题、猜想与假设、制定计划、进行实验、收集证据、解释与结论、反思与评价、表达与交流。考题设计以高中和初中的衔接知识为主。
1.命题思路:“高中起点,初中落点”,题型新颖,素材较为陌生。
2.试题设计:问题的设置一般较为基础,多以定性分析为主。
(1)基础内容:简单的判断(如物质、物质的分类),化学式,化学方程式书写,完善或补充猜想或对猜想的评价,填写实验现象(要结合题目的信息)。
(2)较易设计:叙述实验步骤,根据信息分析评价、反思等。
(3)较难设计:定性、定量相结合的分析判断。
夯实基础
3.答题思路
(1)必须读懂、会运用题干所给的信息,才能成功突围,得出正确答案。
(2)书写的化学方程式较为常见,若是没有学过的反应,则需紧扣题目所给信息。
(3)定性检验与定量分析相结合的题,需寻找所给质量所对应的物质,注意分析反应前后质量变化的原因,从而找到解题的突破口。题目的数据通常比较容易计算。
4.难点突破
(1)通常解题的步骤如下:
①浏览题目,弄清该题要问的是什么,最好清楚是属于哪类的探究题,使得我们解题更有针对性。
夯实基础
②细心审题,清楚实验的目的和原理,并自始至终把握实验目的。
③认真分析是重点。分析材料和原理;分析现象和结论的关系;分析所要回答的问题与它们之间的关系等。
④掌握正确的表达。要注意回答时有没有抓住了知识点,是否和实验的目的和原理相联系,按格式答题,以提高得分率。
夯实基础
②细心审题,清楚实验的目的和原理,并自始至终把握实验目的。
③认真分析是重点。分析材料和原理;分析现象和结论的关系;分析所要回答的问题与它们之间的关系等。
④掌握正确的表达。要注意回答时有没有抓住了知识点,是否和实验的目的和原理相联系,按格式答题,以提高得分率。
(2)规范答题,形成一定的答题模式:
Ⅰ.按照顺序,一步步往下做。
Ⅱ.对探究中的①提出问题;②猜想与假设;③制定计划;④进行实验;⑤收集证据;⑥解释与结论;⑦反思与评价;⑧表达与交流等这几个步骤也有一定的技巧。
夯实基础
例:
a.提出问题、猜想与假设、结论基本一致,只要稍作修改即可填入;
b.制定计划和实验过程题目都会有样式,照着填没问题;
c.解释一般是对实验现象的判定,不在材料中就是普通知识点;
d.反思与评价一般考实验的优劣判断和改进。
实验探究是广东中考化学的必考内容,分值10分左右。由于科学探究对学生的综合能力要求较高,往往成为学生夺取高分的关键所在,要培养学生科学探究的思维方法,让实验探究成为学生主动获取化学知识、认识和解决化学问题的重要途径和方式。
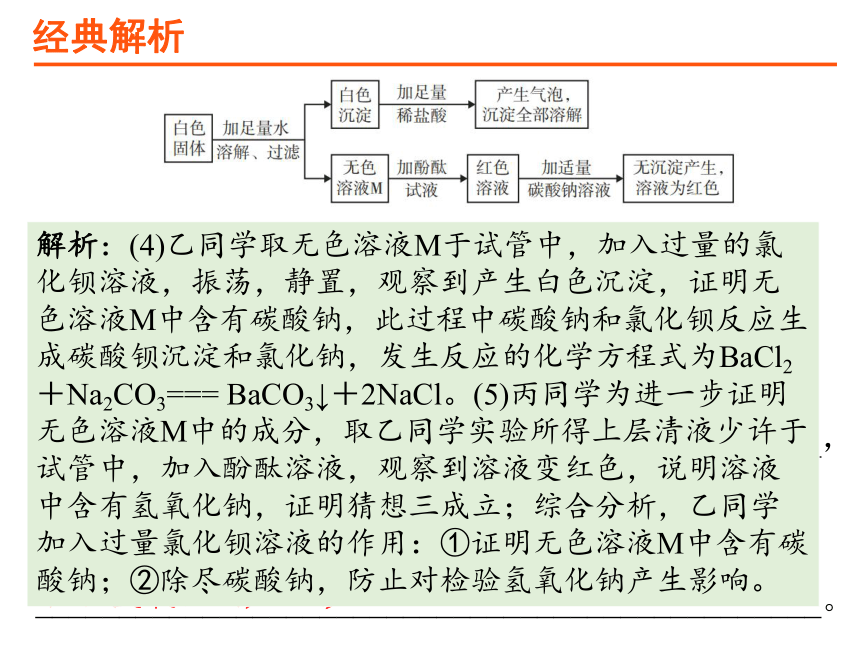
【例题1】(2020·大庆市)某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4、Fe3O4中的一种或几种物质组成。同学们为了确定该白色固体的成分,进行了如下实验探究:
资料卡片:BaCl2溶液显中性。
【初步结论】
(1)甲同学根据固体的描述确定样品中肯定没有____(填化学式),原因是______________________________。
【初步探究】
同学们设计的实验过程及现象如图所示。
经典解析
Fe3O4
解析:根据固体的描述确定样品中肯定没有Fe3O4,原因是四氧化三铁是黑色固体。
四氧化三铁是黑色固体
一、探究物质的组成及成分
【交流讨论】
(2)同学们认为:无色溶液M中一定含有__________(填化学式),无色溶液M加入酚酞试液后变红色,说明溶液M显碱性,需对溶液M继续探究。
【提出问题】
使溶液M显碱性的物质是什么?
【猜想与假设】
猜想一:是氢氧化钠;猜想二:是碳酸钠;猜想三:__________________。
(3)请将猜想三补充完整:__________________。
【探究与结论】
经典解析
NaCl
是氢氧化钠和碳酸钠
解析:(2)同学们认为:无色溶液M中一定含有氯化钠,是因为白色沉淀中加入足量稀盐酸,产生气泡,沉淀全部溶解,说明白色沉淀是氯化钡和碳酸钠反应生成的碳酸钡,同时生成氯化钠。(3)碳酸钠和氢氧化钠都显碱性,结合其他猜想,猜想三补充完整:是氢氧化钠和碳酸钠。
(4)乙同学取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置,观察到______________,证明无色溶液M中含有碳酸钠,此过程发生反应的化学方程式为______________________________________。
(5)丙同学为进一步证明无色溶液M中的成分,取乙同学实验所得上层清液少许于试管中,加入___________,观察到__________________,证明猜想三成立。综合分析,乙同学加入过量氯化钡溶液的作用:①证明无色溶液M中含有碳酸钠;②_______________________
_______________________________________________。
经典解析
产生白色沉淀
BaCl2+Na2CO3=== BaCO3↓+2NaCl
酚酞溶液
溶液变红色
除尽碳酸钠,防止对检验氢氧化钠产生影响
解析:(4)乙同学取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置,观察到产生白色沉淀,证明无色溶液M中含有碳酸钠,此过程中碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,发生反应的化学方程式为BaCl2+Na2CO3=== BaCO3↓+2NaCl。(5)丙同学为进一步证明无色溶液M中的成分,取乙同学实验所得上层清液少许于试管中,加入酚酞溶液,观察到溶液变红色,说明溶液中含有氢氧化钠,证明猜想三成立;综合分析,乙同学加入过量氯化钡溶液的作用:①证明无色溶液M中含有碳酸钠;②除尽碳酸钠,防止对检验氢氧化钠产生影响。
【实验结论】
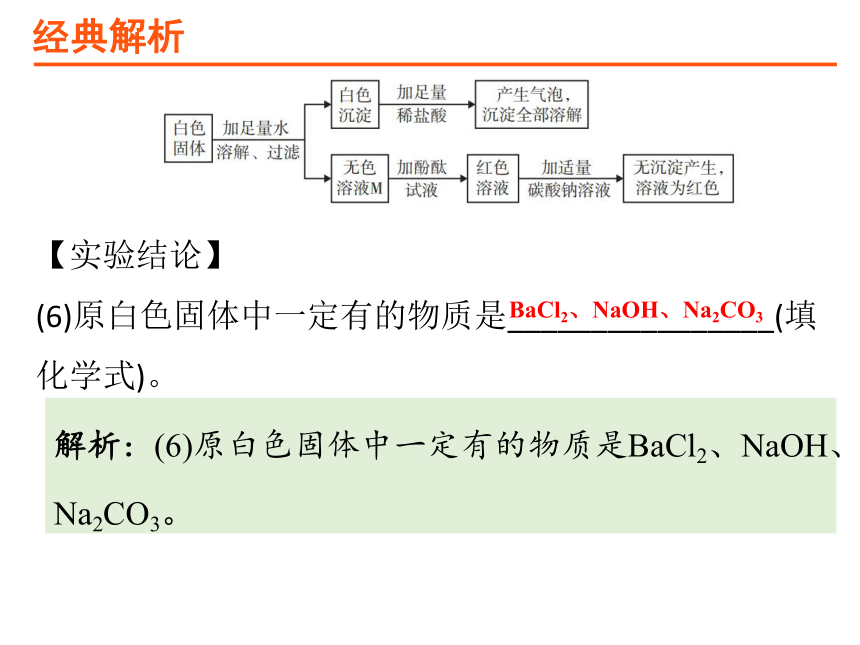
(6)原白色固体中一定有的物质是________________(填化学式)。
经典解析
BaCl2、NaOH、Na2CO3
解析:(6)原白色固体中一定有的物质是BaCl2、NaOH、Na2CO3。
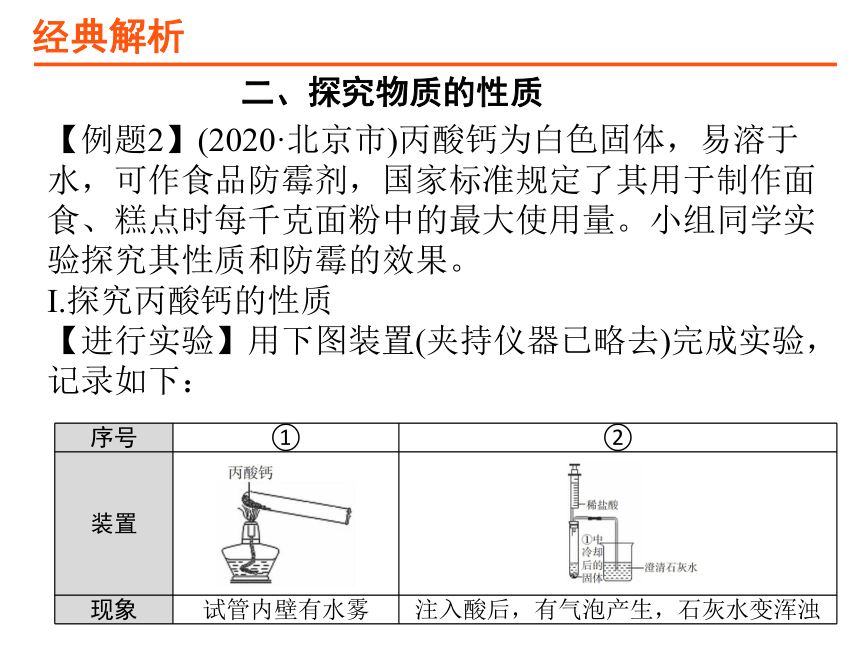
【例题2】(2020·北京市)丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
经典解析
二、探究物质的性质
序号 ① ②
装置
现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为____________________________________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是____________________________
_____________________________________。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
经典解析
CO2+Ca(OH)2=== CaCO3↓+H2O
丙酸钙受热后产生的物质能与
稀盐酸反应且生成二氧化碳。
解析:(1)二氧化碳与氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为 CO2+Ca(OH)2=== CaCO3↓+H2O。(2)查阅资料得知丙酸钙与盐酸反应无气体生成,丙酸钙加热后生成的固体却能与稀盐酸反应生成二氧化碳气体,故可得出:丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
经典解析
组别 第1组 第2组 序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
配方 面粉/g 50 50 50 50 50 50 50 50
酵母/g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75
蔗糖/g 0 0 0 0 5 5 x 5
丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15
开始发霉的时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天
【解释与结论】
(3)设计第1组实验的目的是_______________________
______________________________________________。
(4)第2组,⑦中x为__________。
(5)对比第1组、第2组实验可得到的结论是__________
______________________________________________
______________________________________________。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:___________
____________________________________________________________________________________________
___________________________________________。
经典解析
探究丙酸钙的质量大小
是否对丙酸钙防霉效果有影响。
5
在加入面粉质量相同、酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响。
不同意。国家标准规定了丙酸钙用于制作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。
解析:(3)由表中数据可知,第1组实验,其他因素相同,只有丙酸钙的质量不同,故该实验是探究丙酸钙的质量大小是否对丙酸钙防霉效果有影响。(4)由表中数据可知,第2组与第1组其他数据相同,只是第1组无蔗糖,而第2组有蔗糖,且第2组加入蔗糖的质量应相同,故x=5。(5)由表中数据可知,在加入面粉质量相同、酵母质量相同时以及其他条件相同时,有无蔗糖,开始发霉的时间都相同。故说明在加入面粉质量相同、酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响。
【例题3】(2020·菏泽市)“84消毒液”是一种无色或者淡黄色,具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO),广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】Ⅰ.“84消毒液”不稳定,其杀菌作用主要依靠有效氯,有效氯含量越高杀菌效果越好。
Ⅱ.消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
经典解析
三、探究有关反应条件及影响因素
探究一:“84消毒液”中有效氯含量的稳定性。
0.5%的“84消毒液”在不同温度、不同存放时间下的有效氯含量:
经典解析
存放时间/小时 不同温度下,有效氯存留率 60 ℃ 70 ℃ 80 ℃ 90 ℃
0(对照) 100% 100% 100% 100%
3.0 …… …… 94.66% 88.05%
6.0 …… 96.66% 89.67% 74.69%
12.0 …… 93.32% 82.62% ……
20.0 94.75% …… …… ……
30.0 92.99% …… …… ……
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为__________。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的“84消毒液”有效氯存留率受温度和时间的影响,其影响的变化趋势是____________________________
______________________________________________。因此保存“84消毒液”应注意的问题是______________
___________________________。
探究二:不同浓度“84消毒液”的杀菌效果。
在四支试管中各加入鸡蛋液2 mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
经典解析
+1
在实验研究范围内,在其他条件不
变时,随着温度升高、存放时间延长,有效氯存留率减小
阴暗、低温处存放,不能长久存放
解析:(1)次氯酸钠中钠元素通常显+1价,氧元素通常显-2价,设氯元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得(+1)+x+(-2)=0,解得x=+1。(2)由表中数据可知,在实验研究范围内,在其他条件下不变时,随着温度升高、存放时间延长,有效氯存留率减小;因此保存“84消毒液”时,应注意:阴暗、低温处存放,不能长久存放。
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为_________(选填序号)。
(4)洁厕灵主要成分是盐酸,与“84消毒液”混合会产生有毒气体Cl2,完成反应的化学方程式:
2HCl+NaClO=== Cl2↑+H2O+__________。
经典解析
序号 2-1 2-2 2-3 2-4
实验 操作 加入0.5 mL消毒原液 加入0.5 mL消毒原液,12.5 mL水 加入0.5 mL消毒原液,50 mL水 加入0.5 mL消毒原液,100 mL水
现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体
2-2
NaCl
【例题4】(2020·湖州市)小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2,不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2。你认为小明的实验操作是____________________________________。
经典解析
四、实验异常的探究
解析:(1)氯化镁在水中具有一定的溶解性,可以溶于水,如果产生的沉淀是氯化镁,向该沉淀中加入足量水,沉淀会溶解消失。
取少量沉淀于试管中,加入足量水。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是,他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释:___
________________________________________________。
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀、小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并伴随生成氯化镁、硝酸镁和水的碱式氯化镁Mg(OH)Cl。请你设计实验验证沉淀中含有氯元素:_____
__________________________________________________________________________________________。
经典解析
镁和
水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行。
取沉淀洗涤干净后,加足量稀硝酸溶解,再加入硝酸银溶液,
若有白色沉淀生成,则证明沉淀中含有氯元素。
解析:(2)镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气,难溶物氢氧化镁覆盖在镁条表面阻止了反应的进行,产生沉淀的量较少,且在镁条表面不易与镁条区分,从而看不到沉淀的产生。(3)碱式氯化镁Mg(OH)Cl是一种不溶于水,可溶于稀硝酸的物质,所以可以将碱式氯化镁Mg(OH)Cl沉淀洗净后加入到足量稀硝酸中溶解,溶解后会含有氯离子,氯离子与银离子会结合生成难溶于稀硝酸的氯化银白色沉淀,从而证明有氯离子存在。
1.(2020·黔西南布依族苗族自治州)某化学研究性学习小组的同学自学了金属的化学性质后,对金属钠和硫酸铜溶液发生的反应产生了兴趣。他们把一颗绿豆大的金属钠投入到硫酸铜稀溶液中,并未观察到红色固体,而是看到了蓝色絮状沉淀产生。为此,他们开展了实验探究。
【提出问题】金属钠投入到硫酸铜溶液中发生了怎样的化学反应?
【查阅资料】钠是一种性质非常活泼的金属,能跟氧气反应,还能与水发生剧烈反应。
【作出猜想】
猜想1:钠与水反应生成氢气和碱,生成的碱再与硫酸铜溶液反应。
猜想2:钠与水反应生成氧气和碱,生成的碱再与硫酸铜溶液反应。
考题精选
序号 实验操作 实验现象 实验结论或解释
实验一 用小刀切一颗绿豆大的金属钠投入到装有少量蒸馏水的烧杯中 金属钠漂浮于水面上并迅速移动,伴有嘶嘶的响声及白雾。不规则钠慢慢熔化成一个光亮的小球,随后逐渐变小,最后消失。将盛满水的试管倒扣在金属钠上,收集到一种气体,点燃时产生轻微的爆鸣声 ①金属钠的密度比水的______(选填“大”或“小”)
②反应放热,金属钠的熔点 ______(选填“高”或“低”)
③生成了氢气
【进行实验】
小
考题精选
低
序号 实验操作 实验现象 实验结论或解释
实验二 取少量反应后的溶液于试管中,滴加几滴无色酚酞溶液 溶液变红 ④反应后的溶液呈________(选填“酸性”“中性”或“碱性”)
⑤钠与水反应的化学方程式为__________
___________________
实验三 取少量反应后的溶液于试管中,滴加几滴蓝色的硫酸铜溶液 试管中出现蓝色絮状沉淀 ⑥反应的化学方程式为_________________
___________________
_______________
【进行实验】
碱性
考题精选
2Na+2H2O
=== 2NaOH+H2↑
2NaOH+CuSO4
=== Cu(OH)2↓
+Na2SO4
【实验结论】猜想1成立。
【拓展思考】金属钠通常保存在煤油中,其目的是隔绝______________。
氧气和水
考题精选
2.(2020·广东省)某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO。于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是____________________。
【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。
【实验方案】取研细和干燥后的木炭(0.3 g)和CuO(2.0 g),混合均匀并装入试管,连接装置,高温反应,检验气体。
CO2+C === 2CO
考题精选
高温
【实验过程】
(1)由如图装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为________(选填字母)→尾气处理。
A.①→②→③→④ B.④→①→②→③→①
C.①→④→①→③→② D.③→④→①→②
B
考题精选
(2)上述进一步确定CO存在的现象是_____________
_____________________________________________
(装置③中粉末的颜色变化除外)。
(3)装置③中发生反应的化学方程式是____________
_________________。
(4)写出CO尾气处理的方法:________________(写一种)。
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,应注意______________________。
装置③前的澄清
石灰水不变浑浊,装置③后的澄清石灰水变浑浊
考题精选
CO+CuO ===
Cu+CO2
△
点燃(或收集)
保持通风
3.(2020·广州市)某固体粉末可能含有KOH、K2CO3、K2SO4中的一种或几种,为了确定其成分,进行如下实验:
根据上述实验,回答下列问题:
(1)上述实验中,“产生气泡”的化学方程式为_____
_____________________________________________。
BaCO3+2HCl=== BaCl2+H2O+CO2↑
考题精选
(2)分析实验现象,推断原固体粉末的成分是______
(填化学式)。
(3)能区别K2CO3溶液和NaCl溶液试剂是__________
(选填字母)。
A.NaOH溶液 B.盐酸
C.酚酞溶液 D.NaNO3溶液
K2CO3
考题精选
BC
实验 实验操作 实验现象 实验结论
① 取样品于烧杯中,加水溶解,用手触摸烧杯壁 烧杯壁发热 __________
4.(2020·衡阳市)有位化学教师在实验室取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂(如图)。某化学兴趣小组的同学在该老师的指导下,对该生石灰样品开展了以下探究活动。
【提出问题】生石灰样品的成分是什么?
【作出猜想】生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
【实验探究】小华同学设计如下实验进行探究。
有CaO
考题精选
实验 实验操作 实验现象 实验结论
② 将①中液体过滤,取少量滤液于试管中,向其中滴入_______________ 溶液变红 有Ca(OH)2
③ 取②中的少许滤渣于试管中,向其中滴加少量稀盐酸 __________ 无CaCO3
无色酚酞溶液
考题精选
【交流讨论】
(1)同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2,理由是________________
___________________________________________。
无气泡产生
氧化钙能与水反应
生成氢氧化钙,也能使无色酚酞溶液变红
(2)小红同学提出实验③结论也不正确。他改进实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进实验③的操作内容是___________________
___________________________________________。
(3)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。请写出生成CaCO3的化学方程式:_____________________________。
【反思应用】
(4)生石灰要__________保存。
(5)设计和分析实验时,要充分考虑反应物的量和生成物等因素对实验结论的干扰。
(6)要确定样品中是否含有氢氧化钙,还需要学习更多化学知识才能解决。
取②中的少许滤渣
于试管中,向其中滴加足量稀盐酸
考题精选
CO2+Ca(OH)2=== CaCO3↓+H2O
密封
5.(2020·湘潭市)实验是学习化学的一条重要途径。请回答问题:
(1)如图一,观察到蜡烛燃烧时火焰分为a、b、c三层,其中温度最高的是__________(填字母)。
(2)如图二,取一个冷而干燥的小烧杯罩在火焰上方,观察到烧杯内壁出现__________,快速倒转烧杯,倒入少量澄清石灰水,振荡,观察到澄清石灰水变浑浊。由此可知,蜡烛燃烧后的产物一定有H2O和_______(填化学式)。
(3)如果用一个大烧杯扣住蜡烛(如图三),一段时间后,观察到蜡烛熄灭,说明燃烧需要________。
a
考题精选
水雾
CO2
氧气
(4)为测定某有机物的组成(如图四),往装置中先通入一段时间干燥的氮气,再将6.4 g样品在氧气中燃烧后的产物(样品无剩余)依次通过装置A、B、C、D(装置中涉及的每步反应均反应完全),结果发现装置A增重7.2 g,装置C增重8.8 g。试分析:
①装置A中利用了浓硫酸的__________。
②装置B中红色粉末变成黑色的原因是_________________
____________________________(用化学方程式表示)。
③装置C中反应的化学方程式为_______________________。
④由此可知,该有机物化学式中碳、氧原子的个数比为__________(填最简整数比)。
吸水性
考题精选
3CO+Fe2O3
=== 2Fe+3CO2
高温
2NaOH+CO2=== Na2CO3+H2O
1∶1
6.(2020·青海省)陈东同学在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是他对反应后溶液的酸碱性进行了探究。
【探究目的】确定反应后溶液的酸碱性。
【猜想与假设】反应后溶液可能呈碱性,也可能呈__________,也可能呈__________。
【实验验证】
酸性
考题精选
实验操作 实验现象 实验结论
取反应后溶液少许,滴加几滴酚酞溶液 _____________ 溶液呈酸性或中性
中性
不变色
实验操作 实验现象 实验结论
方案1:取反应后溶液少许,加入少量氧化铜粉末 若粉末部分或全部溶解,溶液变为蓝色 溶液呈_________
若粉末不溶解,溶液不变色 溶液呈_________
方案2:取反应后溶液少许,加入少量____________ 若有气体放出,溶液变为浅绿色 溶液呈酸性,反应的化学方程式是_____________
_______________
若________________ 溶液呈中性
酸性
考题精选
【继续验证】可以设计多种方案进行验证。
中性
铁粉
Fe+2HCl
=== FeCl2+H2↑
无明显现象
7.(2020·江西省)某同学收集某种铝制易拉罐,剪成条状并打磨后进行如图所示实验,发现纯铝片表面有划痕。
【发现问题】根据所学知识,
合金的硬度比组成它的纯金
属硬度更__________。
结合上述现象,可得出该易拉罐不是纯铝
制作。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】
①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑;镁和铁不能与氢氧化钠溶液反应。
大
考题精选
实验步骤 实验现象 解释与结论
(1)取一定量的样品于烧杯中,加入足量的__________溶液,充分反应后过滤、洗涤、干燥 固体表面有大量气泡产生;过滤后得到黑色粉末 样品中含铝
(2)取少量上述黑色粉末于试管中,加入足量的稀盐酸 有气泡产生,溶液变成浅绿色 样品中含铁,发生反应的化学方程式为______________________________________
氢氧化钠
考题精选
【作出猜想】该易拉罐的金属组成除铝外,可能还含有镁、铁中的一种或两种。
【实验设计】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
Fe+2HCl ===
FeCl2+H2↑
【实验结论】小明得出该易拉罐是由铝和铁组成。
【反思评价】其他同学分析后认为小明的实验方案不严谨,理由是_____________________。大家认为应该补充下列实验:取步骤(1)中少量黑色粉末于试管中,加入某种金属的盐溶液后,如果无现象产生,则小明的结论正确。你认为加入的盐溶液中阳离子对应的金属理论上可以是________(写一种)。
【拓展应用】
下图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有_________(选填字母)图标的垃圾桶内。
无法确定是否含有镁
考题精选
锌
B
8.(2020·重庆市A)学习复分解反应发生条件时,小红同学做了下表中的四个实验。
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为______________
_______________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是________________。
Na2CO3+H2SO4
=== Na2SO4+H2O+CO2↑
考题精选
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入硫酸后的现象 无明显现象 无明显现象 产生气泡 有白色沉淀生成
无色酚酞溶液
考题精选
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
【提出猜想】猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
【设计方案】
沉淀A的化学式是__________。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂______________改成______________。小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是_____________。
【实验反思】小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是__________________________________________
________________________。
BaSO4
考题精选
BaCl2溶液
Ba(NO3)2溶液
产生白色沉淀
经过步骤Ⅰ后溶液中有硝酸,会先和氢氧化钠发
生反应
9.(2020·陕西省)某学习小组的同学在整理归纳反应规律时发现,有些化学反应发生时没有伴随明显的现象,他们就此进行了以下探究。
【提出问题】
怎样证明NaOH溶液分别与CO2及稀盐酸发生了反应?
【分析讨论】
同学们讨论后认为,可以用两种思路探究上述反应是否发生。
思路Ⅰ:验证有______________;思路Ⅱ:验证反应物减少或消失。
新物质生成
考题精选
考题精选
【实验探究】同学们分两组分别设计方案进行探究。
组别 第一组 第二组
实验示意图
【实验结论】
(1)第一组同学将充满CO2气体的试管倒扣在NaOH溶液中,观察到试管内液面升高,认为NaOH溶液与CO2发生了反应。但有同学指出,还应进行CO2与__________反应的对比实验才能得出这一结论。
(2)第二组的小文同学向丙中滴入无色酚酞溶液后,观察到溶液颜色__________。得出NaOH溶液与稀盐酸发生了反应的结论。小亮同学向丁中滴入AgNO3溶液后,观察到有白色沉淀生成,由此他认为NaOH溶液与稀盐酸反应生成了NaCl,你认为小亮的结论是__________(选填“合理”或“不合理”)的。
水(或H2O)
考题精选
仍为无色
不合理
(3)第二组同学进一步讨论后认为,如果将乙中的溶液蒸发结晶,再将得到的晶体溶于水,若在室温下测得该溶液的pH________(选填“>”“<”或“=”)7时,则能证明有NaCl生成。
【拓展应用】第一组同学向反应后的溶液中加入某无色溶液,观察到有白色沉淀生成,也得出了NaOH溶液与CO2发生了反应的结论,生成白色沉淀的化学方程式为________________________________________。
=
考题精选
CaCl2+Na2CO3=== CaCO3↓+2NaCl
实验 实验一 实验二 实验三
实验操作
实验现象 蜡烛火焰__________ ___________________ 软塑料瓶变瘪程度较大的是______(选填“甲”或“乙”) 干石蕊纸花不变色,湿石蕊纸花变红色
实验结论 ①二氧化碳的密度比空气大;②二氧化碳既不能燃烧,也不能支持燃烧 二氧化碳能与氢氧化钠发生反应 ______________________________
由下到上
依次熄灭
考题精选
10.(2020·青岛市)实验是进行科学探究的重要方式。同学们设计实验探究二氧化碳的性质,请你参与探究并填空。
【实验记录与分析】
乙
二氧化碳能与水反应
【反思与拓展】
(1)依据实验一的结论,写出二氧化碳的一条重要用途:____________________。
(2)由实验二的结论分析得出:实验室中保存氢氧化钠要注意____________________。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中__________的方法。
用于灭火
考题精选
密封保存
控制变量
2022年化学中考备考复习专题突破——
实验探究(一)
夯实基础
科学探究的基本要素包括:提出问题、猜想与假设、制定计划、进行实验、收集证据、解释与结论、反思与评价、表达与交流。考题设计以高中和初中的衔接知识为主。
1.命题思路:“高中起点,初中落点”,题型新颖,素材较为陌生。
2.试题设计:问题的设置一般较为基础,多以定性分析为主。
(1)基础内容:简单的判断(如物质、物质的分类),化学式,化学方程式书写,完善或补充猜想或对猜想的评价,填写实验现象(要结合题目的信息)。
(2)较易设计:叙述实验步骤,根据信息分析评价、反思等。
(3)较难设计:定性、定量相结合的分析判断。
夯实基础
3.答题思路
(1)必须读懂、会运用题干所给的信息,才能成功突围,得出正确答案。
(2)书写的化学方程式较为常见,若是没有学过的反应,则需紧扣题目所给信息。
(3)定性检验与定量分析相结合的题,需寻找所给质量所对应的物质,注意分析反应前后质量变化的原因,从而找到解题的突破口。题目的数据通常比较容易计算。
4.难点突破
(1)通常解题的步骤如下:
①浏览题目,弄清该题要问的是什么,最好清楚是属于哪类的探究题,使得我们解题更有针对性。
夯实基础
②细心审题,清楚实验的目的和原理,并自始至终把握实验目的。
③认真分析是重点。分析材料和原理;分析现象和结论的关系;分析所要回答的问题与它们之间的关系等。
④掌握正确的表达。要注意回答时有没有抓住了知识点,是否和实验的目的和原理相联系,按格式答题,以提高得分率。
夯实基础
②细心审题,清楚实验的目的和原理,并自始至终把握实验目的。
③认真分析是重点。分析材料和原理;分析现象和结论的关系;分析所要回答的问题与它们之间的关系等。
④掌握正确的表达。要注意回答时有没有抓住了知识点,是否和实验的目的和原理相联系,按格式答题,以提高得分率。
(2)规范答题,形成一定的答题模式:
Ⅰ.按照顺序,一步步往下做。
Ⅱ.对探究中的①提出问题;②猜想与假设;③制定计划;④进行实验;⑤收集证据;⑥解释与结论;⑦反思与评价;⑧表达与交流等这几个步骤也有一定的技巧。
夯实基础
例:
a.提出问题、猜想与假设、结论基本一致,只要稍作修改即可填入;
b.制定计划和实验过程题目都会有样式,照着填没问题;
c.解释一般是对实验现象的判定,不在材料中就是普通知识点;
d.反思与评价一般考实验的优劣判断和改进。
实验探究是广东中考化学的必考内容,分值10分左右。由于科学探究对学生的综合能力要求较高,往往成为学生夺取高分的关键所在,要培养学生科学探究的思维方法,让实验探究成为学生主动获取化学知识、认识和解决化学问题的重要途径和方式。
【例题1】(2020·大庆市)某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4、Fe3O4中的一种或几种物质组成。同学们为了确定该白色固体的成分,进行了如下实验探究:
资料卡片:BaCl2溶液显中性。
【初步结论】
(1)甲同学根据固体的描述确定样品中肯定没有____(填化学式),原因是______________________________。
【初步探究】
同学们设计的实验过程及现象如图所示。
经典解析
Fe3O4
解析:根据固体的描述确定样品中肯定没有Fe3O4,原因是四氧化三铁是黑色固体。
四氧化三铁是黑色固体
一、探究物质的组成及成分
【交流讨论】
(2)同学们认为:无色溶液M中一定含有__________(填化学式),无色溶液M加入酚酞试液后变红色,说明溶液M显碱性,需对溶液M继续探究。
【提出问题】
使溶液M显碱性的物质是什么?
【猜想与假设】
猜想一:是氢氧化钠;猜想二:是碳酸钠;猜想三:__________________。
(3)请将猜想三补充完整:__________________。
【探究与结论】
经典解析
NaCl
是氢氧化钠和碳酸钠
解析:(2)同学们认为:无色溶液M中一定含有氯化钠,是因为白色沉淀中加入足量稀盐酸,产生气泡,沉淀全部溶解,说明白色沉淀是氯化钡和碳酸钠反应生成的碳酸钡,同时生成氯化钠。(3)碳酸钠和氢氧化钠都显碱性,结合其他猜想,猜想三补充完整:是氢氧化钠和碳酸钠。
(4)乙同学取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置,观察到______________,证明无色溶液M中含有碳酸钠,此过程发生反应的化学方程式为______________________________________。
(5)丙同学为进一步证明无色溶液M中的成分,取乙同学实验所得上层清液少许于试管中,加入___________,观察到__________________,证明猜想三成立。综合分析,乙同学加入过量氯化钡溶液的作用:①证明无色溶液M中含有碳酸钠;②_______________________
_______________________________________________。
经典解析
产生白色沉淀
BaCl2+Na2CO3=== BaCO3↓+2NaCl
酚酞溶液
溶液变红色
除尽碳酸钠,防止对检验氢氧化钠产生影响
解析:(4)乙同学取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置,观察到产生白色沉淀,证明无色溶液M中含有碳酸钠,此过程中碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,发生反应的化学方程式为BaCl2+Na2CO3=== BaCO3↓+2NaCl。(5)丙同学为进一步证明无色溶液M中的成分,取乙同学实验所得上层清液少许于试管中,加入酚酞溶液,观察到溶液变红色,说明溶液中含有氢氧化钠,证明猜想三成立;综合分析,乙同学加入过量氯化钡溶液的作用:①证明无色溶液M中含有碳酸钠;②除尽碳酸钠,防止对检验氢氧化钠产生影响。
【实验结论】
(6)原白色固体中一定有的物质是________________(填化学式)。
经典解析
BaCl2、NaOH、Na2CO3
解析:(6)原白色固体中一定有的物质是BaCl2、NaOH、Na2CO3。
【例题2】(2020·北京市)丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
【进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
经典解析
二、探究物质的性质
序号 ① ②
装置
现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为____________________________________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是____________________________
_____________________________________。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
经典解析
CO2+Ca(OH)2=== CaCO3↓+H2O
丙酸钙受热后产生的物质能与
稀盐酸反应且生成二氧化碳。
解析:(1)二氧化碳与氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为 CO2+Ca(OH)2=== CaCO3↓+H2O。(2)查阅资料得知丙酸钙与盐酸反应无气体生成,丙酸钙加热后生成的固体却能与稀盐酸反应生成二氧化碳气体,故可得出:丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
经典解析
组别 第1组 第2组 序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
配方 面粉/g 50 50 50 50 50 50 50 50
酵母/g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75
蔗糖/g 0 0 0 0 5 5 x 5
丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15
开始发霉的时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天
【解释与结论】
(3)设计第1组实验的目的是_______________________
______________________________________________。
(4)第2组,⑦中x为__________。
(5)对比第1组、第2组实验可得到的结论是__________
______________________________________________
______________________________________________。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:___________
____________________________________________________________________________________________
___________________________________________。
经典解析
探究丙酸钙的质量大小
是否对丙酸钙防霉效果有影响。
5
在加入面粉质量相同、酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响。
不同意。国家标准规定了丙酸钙用于制作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。
解析:(3)由表中数据可知,第1组实验,其他因素相同,只有丙酸钙的质量不同,故该实验是探究丙酸钙的质量大小是否对丙酸钙防霉效果有影响。(4)由表中数据可知,第2组与第1组其他数据相同,只是第1组无蔗糖,而第2组有蔗糖,且第2组加入蔗糖的质量应相同,故x=5。(5)由表中数据可知,在加入面粉质量相同、酵母质量相同时以及其他条件相同时,有无蔗糖,开始发霉的时间都相同。故说明在加入面粉质量相同、酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响。
【例题3】(2020·菏泽市)“84消毒液”是一种无色或者淡黄色,具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO),广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某兴趣小组对该消毒液进行了如下系列探究。
【查阅资料】Ⅰ.“84消毒液”不稳定,其杀菌作用主要依靠有效氯,有效氯含量越高杀菌效果越好。
Ⅱ.消毒杀菌就是使病毒蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。
经典解析
三、探究有关反应条件及影响因素
探究一:“84消毒液”中有效氯含量的稳定性。
0.5%的“84消毒液”在不同温度、不同存放时间下的有效氯含量:
经典解析
存放时间/小时 不同温度下,有效氯存留率 60 ℃ 70 ℃ 80 ℃ 90 ℃
0(对照) 100% 100% 100% 100%
3.0 …… …… 94.66% 88.05%
6.0 …… 96.66% 89.67% 74.69%
12.0 …… 93.32% 82.62% ……
20.0 94.75% …… …… ……
30.0 92.99% …… …… ……
【解释与结论】
(1)次氯酸钠(NaClO)中Cl元素的化合价为__________。
(2)综合分析探究一中数据,在其他条件不变时,0.5%的“84消毒液”有效氯存留率受温度和时间的影响,其影响的变化趋势是____________________________
______________________________________________。因此保存“84消毒液”应注意的问题是______________
___________________________。
探究二:不同浓度“84消毒液”的杀菌效果。
在四支试管中各加入鸡蛋液2 mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下:
经典解析
+1
在实验研究范围内,在其他条件不
变时,随着温度升高、存放时间延长,有效氯存留率减小
阴暗、低温处存放,不能长久存放
解析:(1)次氯酸钠中钠元素通常显+1价,氧元素通常显-2价,设氯元素的化合价为x,根据化合物中,正、负化合价的代数和为零,可得(+1)+x+(-2)=0,解得x=+1。(2)由表中数据可知,在实验研究范围内,在其他条件下不变时,随着温度升高、存放时间延长,有效氯存留率减小;因此保存“84消毒液”时,应注意:阴暗、低温处存放,不能长久存放。
【解释与结论】
(3)探究二中杀菌效果最好的一组实验为_________(选填序号)。
(4)洁厕灵主要成分是盐酸,与“84消毒液”混合会产生有毒气体Cl2,完成反应的化学方程式:
2HCl+NaClO=== Cl2↑+H2O+__________。
经典解析
序号 2-1 2-2 2-3 2-4
实验 操作 加入0.5 mL消毒原液 加入0.5 mL消毒原液,12.5 mL水 加入0.5 mL消毒原液,50 mL水 加入0.5 mL消毒原液,100 mL水
现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体
2-2
NaCl
【例题4】(2020·湖州市)小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,试管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2,不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2。你认为小明的实验操作是____________________________________。
经典解析
四、实验异常的探究
解析:(1)氯化镁在水中具有一定的溶解性,可以溶于水,如果产生的沉淀是氯化镁,向该沉淀中加入足量水,沉淀会溶解消失。
取少量沉淀于试管中,加入足量水。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是,他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释:___
________________________________________________。
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀、小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并伴随生成氯化镁、硝酸镁和水的碱式氯化镁Mg(OH)Cl。请你设计实验验证沉淀中含有氯元素:_____
__________________________________________________________________________________________。
经典解析
镁和
水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行。
取沉淀洗涤干净后,加足量稀硝酸溶解,再加入硝酸银溶液,
若有白色沉淀生成,则证明沉淀中含有氯元素。
解析:(2)镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气,难溶物氢氧化镁覆盖在镁条表面阻止了反应的进行,产生沉淀的量较少,且在镁条表面不易与镁条区分,从而看不到沉淀的产生。(3)碱式氯化镁Mg(OH)Cl是一种不溶于水,可溶于稀硝酸的物质,所以可以将碱式氯化镁Mg(OH)Cl沉淀洗净后加入到足量稀硝酸中溶解,溶解后会含有氯离子,氯离子与银离子会结合生成难溶于稀硝酸的氯化银白色沉淀,从而证明有氯离子存在。
1.(2020·黔西南布依族苗族自治州)某化学研究性学习小组的同学自学了金属的化学性质后,对金属钠和硫酸铜溶液发生的反应产生了兴趣。他们把一颗绿豆大的金属钠投入到硫酸铜稀溶液中,并未观察到红色固体,而是看到了蓝色絮状沉淀产生。为此,他们开展了实验探究。
【提出问题】金属钠投入到硫酸铜溶液中发生了怎样的化学反应?
【查阅资料】钠是一种性质非常活泼的金属,能跟氧气反应,还能与水发生剧烈反应。
【作出猜想】
猜想1:钠与水反应生成氢气和碱,生成的碱再与硫酸铜溶液反应。
猜想2:钠与水反应生成氧气和碱,生成的碱再与硫酸铜溶液反应。
考题精选
序号 实验操作 实验现象 实验结论或解释
实验一 用小刀切一颗绿豆大的金属钠投入到装有少量蒸馏水的烧杯中 金属钠漂浮于水面上并迅速移动,伴有嘶嘶的响声及白雾。不规则钠慢慢熔化成一个光亮的小球,随后逐渐变小,最后消失。将盛满水的试管倒扣在金属钠上,收集到一种气体,点燃时产生轻微的爆鸣声 ①金属钠的密度比水的______(选填“大”或“小”)
②反应放热,金属钠的熔点 ______(选填“高”或“低”)
③生成了氢气
【进行实验】
小
考题精选
低
序号 实验操作 实验现象 实验结论或解释
实验二 取少量反应后的溶液于试管中,滴加几滴无色酚酞溶液 溶液变红 ④反应后的溶液呈________(选填“酸性”“中性”或“碱性”)
⑤钠与水反应的化学方程式为__________
___________________
实验三 取少量反应后的溶液于试管中,滴加几滴蓝色的硫酸铜溶液 试管中出现蓝色絮状沉淀 ⑥反应的化学方程式为_________________
___________________
_______________
【进行实验】
碱性
考题精选
2Na+2H2O
=== 2NaOH+H2↑
2NaOH+CuSO4
=== Cu(OH)2↓
+Na2SO4
【实验结论】猜想1成立。
【拓展思考】金属钠通常保存在煤油中,其目的是隔绝______________。
氧气和水
考题精选
2.(2020·广东省)某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO。于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。
【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是____________________。
【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。
【实验方案】取研细和干燥后的木炭(0.3 g)和CuO(2.0 g),混合均匀并装入试管,连接装置,高温反应,检验气体。
CO2+C === 2CO
考题精选
高温
【实验过程】
(1)由如图装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为________(选填字母)→尾气处理。
A.①→②→③→④ B.④→①→②→③→①
C.①→④→①→③→② D.③→④→①→②
B
考题精选
(2)上述进一步确定CO存在的现象是_____________
_____________________________________________
(装置③中粉末的颜色变化除外)。
(3)装置③中发生反应的化学方程式是____________
_________________。
(4)写出CO尾气处理的方法:________________(写一种)。
【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。
【延伸应用】冬天,室内用炭火取暖时,应注意______________________。
装置③前的澄清
石灰水不变浑浊,装置③后的澄清石灰水变浑浊
考题精选
CO+CuO ===
Cu+CO2
△
点燃(或收集)
保持通风
3.(2020·广州市)某固体粉末可能含有KOH、K2CO3、K2SO4中的一种或几种,为了确定其成分,进行如下实验:
根据上述实验,回答下列问题:
(1)上述实验中,“产生气泡”的化学方程式为_____
_____________________________________________。
BaCO3+2HCl=== BaCl2+H2O+CO2↑
考题精选
(2)分析实验现象,推断原固体粉末的成分是______
(填化学式)。
(3)能区别K2CO3溶液和NaCl溶液试剂是__________
(选填字母)。
A.NaOH溶液 B.盐酸
C.酚酞溶液 D.NaNO3溶液
K2CO3
考题精选
BC
实验 实验操作 实验现象 实验结论
① 取样品于烧杯中,加水溶解,用手触摸烧杯壁 烧杯壁发热 __________
4.(2020·衡阳市)有位化学教师在实验室取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂(如图)。某化学兴趣小组的同学在该老师的指导下,对该生石灰样品开展了以下探究活动。
【提出问题】生石灰样品的成分是什么?
【作出猜想】生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
【实验探究】小华同学设计如下实验进行探究。
有CaO
考题精选
实验 实验操作 实验现象 实验结论
② 将①中液体过滤,取少量滤液于试管中,向其中滴入_______________ 溶液变红 有Ca(OH)2
③ 取②中的少许滤渣于试管中,向其中滴加少量稀盐酸 __________ 无CaCO3
无色酚酞溶液
考题精选
【交流讨论】
(1)同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2,理由是________________
___________________________________________。
无气泡产生
氧化钙能与水反应
生成氢氧化钙,也能使无色酚酞溶液变红
(2)小红同学提出实验③结论也不正确。他改进实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进实验③的操作内容是___________________
___________________________________________。
(3)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。请写出生成CaCO3的化学方程式:_____________________________。
【反思应用】
(4)生石灰要__________保存。
(5)设计和分析实验时,要充分考虑反应物的量和生成物等因素对实验结论的干扰。
(6)要确定样品中是否含有氢氧化钙,还需要学习更多化学知识才能解决。
取②中的少许滤渣
于试管中,向其中滴加足量稀盐酸
考题精选
CO2+Ca(OH)2=== CaCO3↓+H2O
密封
5.(2020·湘潭市)实验是学习化学的一条重要途径。请回答问题:
(1)如图一,观察到蜡烛燃烧时火焰分为a、b、c三层,其中温度最高的是__________(填字母)。
(2)如图二,取一个冷而干燥的小烧杯罩在火焰上方,观察到烧杯内壁出现__________,快速倒转烧杯,倒入少量澄清石灰水,振荡,观察到澄清石灰水变浑浊。由此可知,蜡烛燃烧后的产物一定有H2O和_______(填化学式)。
(3)如果用一个大烧杯扣住蜡烛(如图三),一段时间后,观察到蜡烛熄灭,说明燃烧需要________。
a
考题精选
水雾
CO2
氧气
(4)为测定某有机物的组成(如图四),往装置中先通入一段时间干燥的氮气,再将6.4 g样品在氧气中燃烧后的产物(样品无剩余)依次通过装置A、B、C、D(装置中涉及的每步反应均反应完全),结果发现装置A增重7.2 g,装置C增重8.8 g。试分析:
①装置A中利用了浓硫酸的__________。
②装置B中红色粉末变成黑色的原因是_________________
____________________________(用化学方程式表示)。
③装置C中反应的化学方程式为_______________________。
④由此可知,该有机物化学式中碳、氧原子的个数比为__________(填最简整数比)。
吸水性
考题精选
3CO+Fe2O3
=== 2Fe+3CO2
高温
2NaOH+CO2=== Na2CO3+H2O
1∶1
6.(2020·青海省)陈东同学在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是他对反应后溶液的酸碱性进行了探究。
【探究目的】确定反应后溶液的酸碱性。
【猜想与假设】反应后溶液可能呈碱性,也可能呈__________,也可能呈__________。
【实验验证】
酸性
考题精选
实验操作 实验现象 实验结论
取反应后溶液少许,滴加几滴酚酞溶液 _____________ 溶液呈酸性或中性
中性
不变色
实验操作 实验现象 实验结论
方案1:取反应后溶液少许,加入少量氧化铜粉末 若粉末部分或全部溶解,溶液变为蓝色 溶液呈_________
若粉末不溶解,溶液不变色 溶液呈_________
方案2:取反应后溶液少许,加入少量____________ 若有气体放出,溶液变为浅绿色 溶液呈酸性,反应的化学方程式是_____________
_______________
若________________ 溶液呈中性
酸性
考题精选
【继续验证】可以设计多种方案进行验证。
中性
铁粉
Fe+2HCl
=== FeCl2+H2↑
无明显现象
7.(2020·江西省)某同学收集某种铝制易拉罐,剪成条状并打磨后进行如图所示实验,发现纯铝片表面有划痕。
【发现问题】根据所学知识,
合金的硬度比组成它的纯金
属硬度更__________。
结合上述现象,可得出该易拉罐不是纯铝
制作。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】
①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑;镁和铁不能与氢氧化钠溶液反应。
大
考题精选
实验步骤 实验现象 解释与结论
(1)取一定量的样品于烧杯中,加入足量的__________溶液,充分反应后过滤、洗涤、干燥 固体表面有大量气泡产生;过滤后得到黑色粉末 样品中含铝
(2)取少量上述黑色粉末于试管中,加入足量的稀盐酸 有气泡产生,溶液变成浅绿色 样品中含铁,发生反应的化学方程式为______________________________________
氢氧化钠
考题精选
【作出猜想】该易拉罐的金属组成除铝外,可能还含有镁、铁中的一种或两种。
【实验设计】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
Fe+2HCl ===
FeCl2+H2↑
【实验结论】小明得出该易拉罐是由铝和铁组成。
【反思评价】其他同学分析后认为小明的实验方案不严谨,理由是_____________________。大家认为应该补充下列实验:取步骤(1)中少量黑色粉末于试管中,加入某种金属的盐溶液后,如果无现象产生,则小明的结论正确。你认为加入的盐溶液中阳离子对应的金属理论上可以是________(写一种)。
【拓展应用】
下图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有_________(选填字母)图标的垃圾桶内。
无法确定是否含有镁
考题精选
锌
B
8.(2020·重庆市A)学习复分解反应发生条件时,小红同学做了下表中的四个实验。
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为______________
_______________________________。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是________________。
Na2CO3+H2SO4
=== Na2SO4+H2O+CO2↑
考题精选
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入硫酸后的现象 无明显现象 无明显现象 产生气泡 有白色沉淀生成
无色酚酞溶液
考题精选
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
【提出猜想】猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
【设计方案】
沉淀A的化学式是__________。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂______________改成______________。小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是_____________。
【实验反思】小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是__________________________________________
________________________。
BaSO4
考题精选
BaCl2溶液
Ba(NO3)2溶液
产生白色沉淀
经过步骤Ⅰ后溶液中有硝酸,会先和氢氧化钠发
生反应
9.(2020·陕西省)某学习小组的同学在整理归纳反应规律时发现,有些化学反应发生时没有伴随明显的现象,他们就此进行了以下探究。
【提出问题】
怎样证明NaOH溶液分别与CO2及稀盐酸发生了反应?
【分析讨论】
同学们讨论后认为,可以用两种思路探究上述反应是否发生。
思路Ⅰ:验证有______________;思路Ⅱ:验证反应物减少或消失。
新物质生成
考题精选
考题精选
【实验探究】同学们分两组分别设计方案进行探究。
组别 第一组 第二组
实验示意图
【实验结论】
(1)第一组同学将充满CO2气体的试管倒扣在NaOH溶液中,观察到试管内液面升高,认为NaOH溶液与CO2发生了反应。但有同学指出,还应进行CO2与__________反应的对比实验才能得出这一结论。
(2)第二组的小文同学向丙中滴入无色酚酞溶液后,观察到溶液颜色__________。得出NaOH溶液与稀盐酸发生了反应的结论。小亮同学向丁中滴入AgNO3溶液后,观察到有白色沉淀生成,由此他认为NaOH溶液与稀盐酸反应生成了NaCl,你认为小亮的结论是__________(选填“合理”或“不合理”)的。
水(或H2O)
考题精选
仍为无色
不合理
(3)第二组同学进一步讨论后认为,如果将乙中的溶液蒸发结晶,再将得到的晶体溶于水,若在室温下测得该溶液的pH________(选填“>”“<”或“=”)7时,则能证明有NaCl生成。
【拓展应用】第一组同学向反应后的溶液中加入某无色溶液,观察到有白色沉淀生成,也得出了NaOH溶液与CO2发生了反应的结论,生成白色沉淀的化学方程式为________________________________________。
=
考题精选
CaCl2+Na2CO3=== CaCO3↓+2NaCl
实验 实验一 实验二 实验三
实验操作
实验现象 蜡烛火焰__________ ___________________ 软塑料瓶变瘪程度较大的是______(选填“甲”或“乙”) 干石蕊纸花不变色,湿石蕊纸花变红色
实验结论 ①二氧化碳的密度比空气大;②二氧化碳既不能燃烧,也不能支持燃烧 二氧化碳能与氢氧化钠发生反应 ______________________________
由下到上
依次熄灭
考题精选
10.(2020·青岛市)实验是进行科学探究的重要方式。同学们设计实验探究二氧化碳的性质,请你参与探究并填空。
【实验记录与分析】
乙
二氧化碳能与水反应
【反思与拓展】
(1)依据实验一的结论,写出二氧化碳的一条重要用途:____________________。
(2)由实验二的结论分析得出:实验室中保存氢氧化钠要注意____________________。
(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中__________的方法。
用于灭火
考题精选
密封保存
控制变量
同课章节目录
