第三节 纯碱的性质(第二课时)
文档属性
| 名称 | 第三节 纯碱的性质(第二课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 566.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-05 19:24:32 | ||
图片预览






文档简介
课件16张PPT。第二课时 纯碱的性质 教师寄语:
同样四十分钟的付出,我希望你们得到的更多!
学习目标:
1、掌握纯碱的性质,学会碳酸根离子的
检验方法。
2、了解复分解反应的实质。
学习重难点:
复分解反应的实质(高频考点),纯碱
的化学性质 碳钠的物理性质碳酸钠化学式为 ,它是 色粉末状固
体, 溶于水,其水溶液显 性,能使
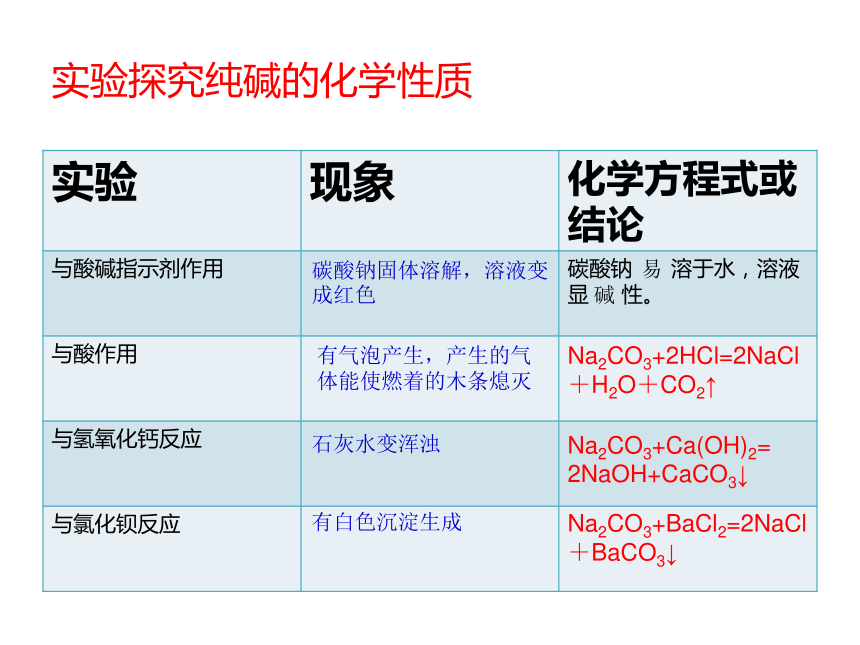
紫色石蕊变 色,无色酚酞变 色。碳酸钠的水溶液呈碱性,另一个俗名叫“纯碱” 它属于碱吗?Na2CO3白易碱蓝红1、回顾所学:碳酸钠的物理性质 教材 P442、实验探究纯碱的化学性质实验探究纯碱的化学性质碳酸钠固体溶解,溶液变成红色易碱有气泡产生,产生的气体能使燃着的木条熄灭
Na2CO3+2HCl=2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2=
2NaOH+CaCO3↓石灰水变浑浊有白色沉淀生成Na2CO3+BaCl2=2NaCl+BaCO3↓探究更问题: 长期露置在空气中的烧碱溶液会与空气中的CO2反应生成少量的碳酸钠而变质。 如何检验这些烧碱溶液是否变质?稀盐酸石灰水氯化钡溶液 问题的实质是检验溶液中是否含有Na2CO3,因此要从Na2CO3的化学性质入手来解决这个问题。 3、 Na2CO3性质应用: 检验碳酸根离子
取少量氢氧化钠溶液样品,滴加少量的稀盐酸。产生大量气体稀
盐
酸操作步骤:实验现象:实验结论:氢氧化钠溶液中含有碳酸钠,说明已经变质。方案一:设计思路:氢氧化钠与盐酸反应没有现象,而碳酸钠与盐酸反应会产生二氧化碳气体。评价反思:碳酸钠能不能与稀硫酸反应呢?碳酸盐+酸→新盐+H2O+CO2↑方案一 :酸碱盐之间相互反应实例盐和酸反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
盐和碱反应
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
盐和盐反应
Na2CO3+BaCl2=2NaCl+BaCO3↓
酸和碱反应
HCl+NaOH=NaCl+H2O
反应类型复分解反应两种化合物互相交换成分,生成另外
两种化合物的反应。
AB + CD AD + CB4、复分解反应的实质:酸碱盐电离出的离子相互结合成水、气体或沉淀。说明:有水生成的是指,金属氧化物与酸反应,酸与碱的反应;有气体生成的通常指碳酸盐与酸反应生成二氧化碳,铵盐与可溶性碱反应生成氨气。 H2SO4 + KNO3 ——K2SO4 + HNO3×H+、SO42-K+、NO3-H+、NO3-K+、SO42-反应前反应后溶液中离子种类数量没有改变 无新物质产生不反应H+、SO42-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类数目发生改变 H2SO4 + Na2CO3——Na2SO4+ + H2O——√反应发生,向粒子数目减少一方进行 复分解反应发生的条件或有气体(↑)或有水(H2O)有沉淀(↓)复分解反应才能发生生成物中八种沉淀物白色沉淀: AgCl BaSO4
BaCO3 CaCO3
Mg(OH) 2 Al(OH)3
蓝色沉淀 Cu(OH) 2
红褐色沉淀 Fe(OH)3课堂练习:
1.用一种试剂能将澄清的石灰水、稀盐酸、氢氧化钠溶液区别开来,这种试剂是( )
A.Na2CO3溶液 B.石蕊试液
C.氯化钠溶液 D.酚酞试液
2.能一次性鉴别氯化钠、氯化钡、盐酸的是( )
A.酚酞试液 B.紫色石蕊试液
C.碳酸钠溶液 D.蒸馏水AC 3.判断下列物质在水溶液里能否发生复分解反应 (1)、KNO3+NaCl ( ) (2)、KNO3+Na2CO3 ( ) (3)、BaCl2+Na2SO4 ( ) (4)、FeCl3+NaOH ( ) (5)、CaCO3+HCl ( )
× × √ √ √ 4、判断下列物质间能否发生化学反应,并写出有关反应的化学方程式:
(1)ZnCO3 + HCl
(2)BaCl2 + HNO3
(3)Na2SO4 + Ba(OH)2
(4)K2SO4 + NaOH
(5)CuSO4 + BaCl2
同样四十分钟的付出,我希望你们得到的更多!
学习目标:
1、掌握纯碱的性质,学会碳酸根离子的
检验方法。
2、了解复分解反应的实质。
学习重难点:
复分解反应的实质(高频考点),纯碱
的化学性质 碳钠的物理性质碳酸钠化学式为 ,它是 色粉末状固
体, 溶于水,其水溶液显 性,能使
紫色石蕊变 色,无色酚酞变 色。碳酸钠的水溶液呈碱性,另一个俗名叫“纯碱” 它属于碱吗?Na2CO3白易碱蓝红1、回顾所学:碳酸钠的物理性质 教材 P442、实验探究纯碱的化学性质实验探究纯碱的化学性质碳酸钠固体溶解,溶液变成红色易碱有气泡产生,产生的气体能使燃着的木条熄灭
Na2CO3+2HCl=2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2=
2NaOH+CaCO3↓石灰水变浑浊有白色沉淀生成Na2CO3+BaCl2=2NaCl+BaCO3↓探究更问题: 长期露置在空气中的烧碱溶液会与空气中的CO2反应生成少量的碳酸钠而变质。 如何检验这些烧碱溶液是否变质?稀盐酸石灰水氯化钡溶液 问题的实质是检验溶液中是否含有Na2CO3,因此要从Na2CO3的化学性质入手来解决这个问题。 3、 Na2CO3性质应用: 检验碳酸根离子
取少量氢氧化钠溶液样品,滴加少量的稀盐酸。产生大量气体稀
盐
酸操作步骤:实验现象:实验结论:氢氧化钠溶液中含有碳酸钠,说明已经变质。方案一:设计思路:氢氧化钠与盐酸反应没有现象,而碳酸钠与盐酸反应会产生二氧化碳气体。评价反思:碳酸钠能不能与稀硫酸反应呢?碳酸盐+酸→新盐+H2O+CO2↑方案一 :酸碱盐之间相互反应实例盐和酸反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
盐和碱反应
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
盐和盐反应
Na2CO3+BaCl2=2NaCl+BaCO3↓
酸和碱反应
HCl+NaOH=NaCl+H2O
反应类型复分解反应两种化合物互相交换成分,生成另外
两种化合物的反应。
AB + CD AD + CB4、复分解反应的实质:酸碱盐电离出的离子相互结合成水、气体或沉淀。说明:有水生成的是指,金属氧化物与酸反应,酸与碱的反应;有气体生成的通常指碳酸盐与酸反应生成二氧化碳,铵盐与可溶性碱反应生成氨气。 H2SO4 + KNO3 ——K2SO4 + HNO3×H+、SO42-K+、NO3-H+、NO3-K+、SO42-反应前反应后溶液中离子种类数量没有改变 无新物质产生不反应H+、SO42-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类数目发生改变 H2SO4 + Na2CO3——Na2SO4+ + H2O——√反应发生,向粒子数目减少一方进行 复分解反应发生的条件或有气体(↑)或有水(H2O)有沉淀(↓)复分解反应才能发生生成物中八种沉淀物白色沉淀: AgCl BaSO4
BaCO3 CaCO3
Mg(OH) 2 Al(OH)3
蓝色沉淀 Cu(OH) 2
红褐色沉淀 Fe(OH)3课堂练习:
1.用一种试剂能将澄清的石灰水、稀盐酸、氢氧化钠溶液区别开来,这种试剂是( )
A.Na2CO3溶液 B.石蕊试液
C.氯化钠溶液 D.酚酞试液
2.能一次性鉴别氯化钠、氯化钡、盐酸的是( )
A.酚酞试液 B.紫色石蕊试液
C.碳酸钠溶液 D.蒸馏水AC 3.判断下列物质在水溶液里能否发生复分解反应 (1)、KNO3+NaCl ( ) (2)、KNO3+Na2CO3 ( ) (3)、BaCl2+Na2SO4 ( ) (4)、FeCl3+NaOH ( ) (5)、CaCO3+HCl ( )
× × √ √ √ 4、判断下列物质间能否发生化学反应,并写出有关反应的化学方程式:
(1)ZnCO3 + HCl
(2)BaCl2 + HNO3
(3)Na2SO4 + Ba(OH)2
(4)K2SO4 + NaOH
(5)CuSO4 + BaCl2
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
