高一化学228《卤族元素、核素》课件 (1)
文档属性
| 名称 | 高一化学228《卤族元素、核素》课件 (1) |  | |
| 格式 | zip | ||
| 文件大小 | 642.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-06 13:24:17 | ||
图片预览



文档简介
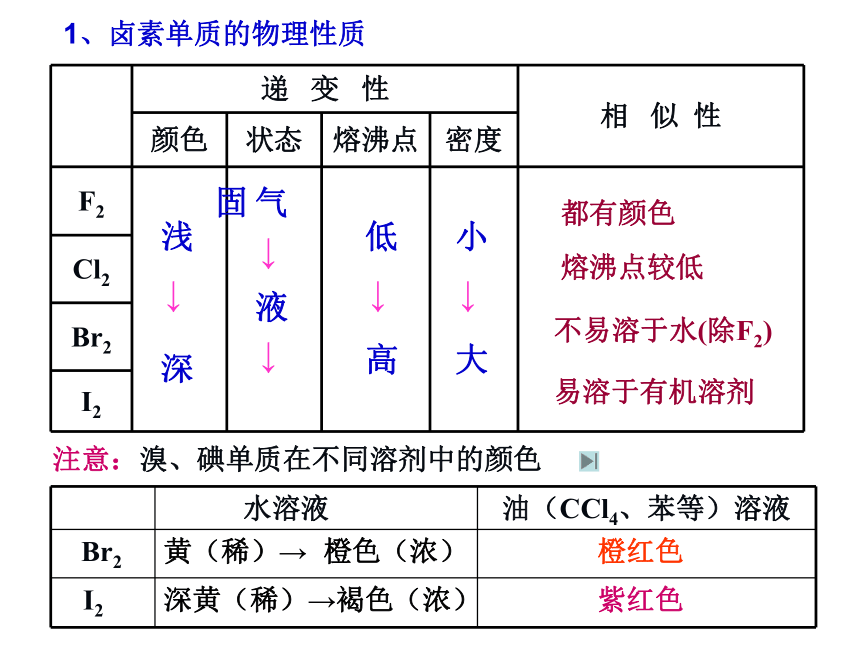
课件13张PPT。Br2I2(二)卤族元素浅 → 深气 → 液 → 固低 → 高小 → 大不易溶于水(除F2)熔沸点较低都有颜色1、卤素单质的物理性质易溶于有机溶剂可供选择实验药品:
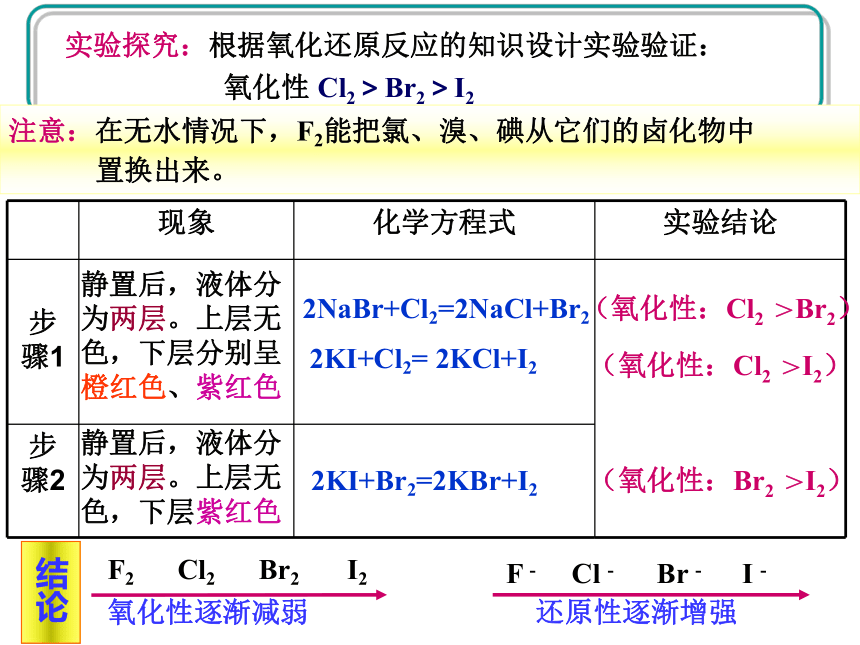
KBr溶液、KI溶液、新制氯水、溴水、四氯化碳、淀粉溶液静置后,液体分为两层。上层无色,下层分别呈橙红色、紫红色静置后,液体分为两层。上层无色,下层紫红色2NaBr+Cl2=2NaCl+Br22KI+Cl2= 2KCl+I22KI+Br2=2KBr+I2(氧化性:Cl2 >Br2)(氧化性:Cl2 >I2)(氧化性:Br2 >I2)氧化性逐渐减弱F2 Cl2 Br2 I2还原性逐渐增强F - Cl - Br - I - 结论注意:在无水情况下,F2能把氯、溴、碘从它们的卤化物中
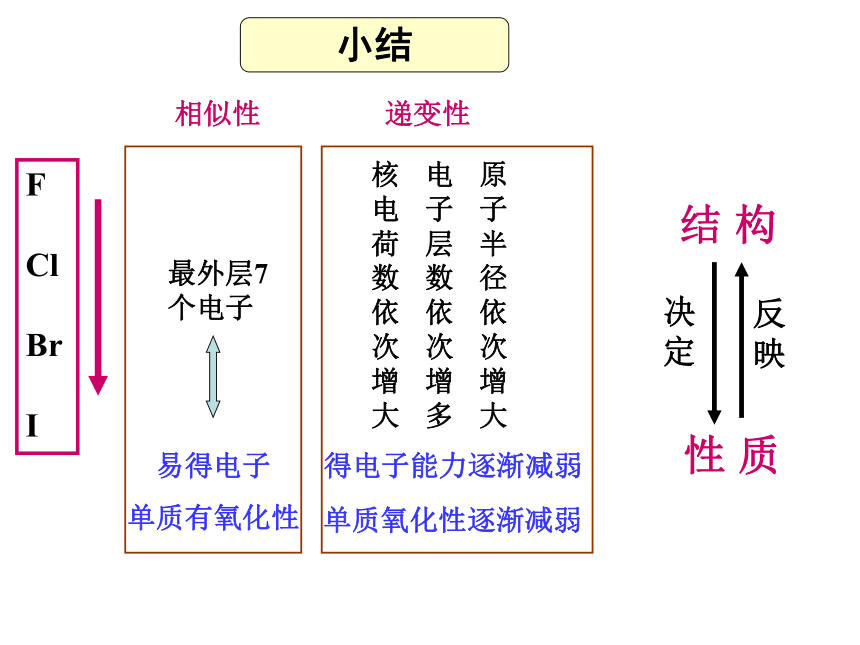
置换出来。 与金属反应注意:I2与变价金属反应多生成低价金属碘化物。补充了解:单质氧化性逐渐减弱相似性最外层7个电子 易得电子
单质有氧化性递变性核电荷数依次增大电子层数依次增多原子半径依次增大得电子能力逐渐减弱结 构 性 质小结1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( )
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
C、HAt非常不稳定 D、砹氧化性弱于碘 B2、B3、已知: 2Fe2++Br2=2Fe3++2Br-,现向离子浓度均为
0.1 mol·L-1的K+、Fe2+、Cl-、Br-、I-组成的混合溶液50 mL中,
加入0.025 mol·L-1的溴水200 mL,充分反应后溶液中离子数目
明显减少的是 ;离子浓度减小而离子数目不变的是 ;离子数目增多而离子浓度减小的是 。I-、Fe2+ K+、Cl- Br- 1. 在元素周期表中,同主族元素,从上→下,核外
电子层依次增多,原子半径逐渐增大,失电子能力
逐渐增强,得电子能力逐渐减弱,所以,元素金属
性逐渐增强,非金属性逐渐减弱。 2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性
和递变性。小结三、核素知识回顾(一)原子的组成 原子核居于原子的中心,体积很小,但原子质量主要集中在原子核,原子核带正电荷,它由质子和中子构成。 原 子: 核电荷数(Z)=核内质子数=核外电子数 核外电子数 = 质子数 + 阴离子所带电荷数核外电子数 = 质子数 - 阳离子所带电荷数 1、电量关系阴离子:阳离子: 原子核特点:练习:填写表中空白 CAl3+1618x-ny-m10101110910原子:Ne阳离子: Na+、 Mg2+ 、Al3+阴离子: F-、 O2-、 N3-二核10电子的分子________;四核10电子的分子_________;
四核10电子的离子________;五核10电子的电子_________。练习:(07江苏)通常情况下,微粒A和B为分子,C和E为阳离
子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可
电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。
请回答:
(1)用化学符号表示下列4种微粒:
A: ; B: ;C: ;D: 。
(2)写出A、B、E三种微粒反应的离子方程式:
。H2O NH3 NH4+ OH-Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ 或 Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+A ——代表质量数
Z ——代表核电荷数(质子数)
n ——代表离子所带电荷数
m ——代表化合价
x ——原子个数 质量数:忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数。
用符号A表示。质量数(A)= 质子数(Z)×一个质子的相对质量的近似整数值
+ 中子数(N)×一个中子的相对质量的近似整数值2、质量关系质量数(A)= 质子数(Z)+ 中子数(N)质量数就是质子数加中子数。?例: 1、美国科学家将两种元素铅和氪的原子核对撞,获得了一种
质子数为118,质量数为293的超重原子,该原子原子核内
的中子数和核外电子数之差是( )
A. 175 B. 47 C. 57 D. 118C3、核内中子数为N的R3+离子,其质量数为A,它的m g氧化物中
所含电子的物质的量是( )B2、某元素的某种离子X2-核外共有a个电子,
核内有b个中子,表示该X原子的下列符
号中正确的是( )C
KBr溶液、KI溶液、新制氯水、溴水、四氯化碳、淀粉溶液静置后,液体分为两层。上层无色,下层分别呈橙红色、紫红色静置后,液体分为两层。上层无色,下层紫红色2NaBr+Cl2=2NaCl+Br22KI+Cl2= 2KCl+I22KI+Br2=2KBr+I2(氧化性:Cl2 >Br2)(氧化性:Cl2 >I2)(氧化性:Br2 >I2)氧化性逐渐减弱F2 Cl2 Br2 I2还原性逐渐增强F - Cl - Br - I - 结论注意:在无水情况下,F2能把氯、溴、碘从它们的卤化物中
置换出来。 与金属反应注意:I2与变价金属反应多生成低价金属碘化物。补充了解:单质氧化性逐渐减弱相似性最外层7个电子 易得电子
单质有氧化性递变性核电荷数依次增大电子层数依次增多原子半径依次增大得电子能力逐渐减弱结 构 性 质小结1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( )
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
C、HAt非常不稳定 D、砹氧化性弱于碘 B2、B3、已知: 2Fe2++Br2=2Fe3++2Br-,现向离子浓度均为
0.1 mol·L-1的K+、Fe2+、Cl-、Br-、I-组成的混合溶液50 mL中,
加入0.025 mol·L-1的溴水200 mL,充分反应后溶液中离子数目
明显减少的是 ;离子浓度减小而离子数目不变的是 ;离子数目增多而离子浓度减小的是 。I-、Fe2+ K+、Cl- Br- 1. 在元素周期表中,同主族元素,从上→下,核外
电子层依次增多,原子半径逐渐增大,失电子能力
逐渐增强,得电子能力逐渐减弱,所以,元素金属
性逐渐增强,非金属性逐渐减弱。 2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性
和递变性。小结三、核素知识回顾(一)原子的组成 原子核居于原子的中心,体积很小,但原子质量主要集中在原子核,原子核带正电荷,它由质子和中子构成。 原 子: 核电荷数(Z)=核内质子数=核外电子数 核外电子数 = 质子数 + 阴离子所带电荷数核外电子数 = 质子数 - 阳离子所带电荷数 1、电量关系阴离子:阳离子: 原子核特点:练习:填写表中空白 CAl3+1618x-ny-m10101110910原子:Ne阳离子: Na+、 Mg2+ 、Al3+阴离子: F-、 O2-、 N3-二核10电子的分子________;四核10电子的分子_________;
四核10电子的离子________;五核10电子的电子_________。练习:(07江苏)通常情况下,微粒A和B为分子,C和E为阳离
子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可
电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。
请回答:
(1)用化学符号表示下列4种微粒:
A: ; B: ;C: ;D: 。
(2)写出A、B、E三种微粒反应的离子方程式:
。H2O NH3 NH4+ OH-Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ 或 Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+A ——代表质量数
Z ——代表核电荷数(质子数)
n ——代表离子所带电荷数
m ——代表化合价
x ——原子个数 质量数:忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数。
用符号A表示。质量数(A)= 质子数(Z)×一个质子的相对质量的近似整数值
+ 中子数(N)×一个中子的相对质量的近似整数值2、质量关系质量数(A)= 质子数(Z)+ 中子数(N)质量数就是质子数加中子数。?例: 1、美国科学家将两种元素铅和氪的原子核对撞,获得了一种
质子数为118,质量数为293的超重原子,该原子原子核内
的中子数和核外电子数之差是( )
A. 175 B. 47 C. 57 D. 118C3、核内中子数为N的R3+离子,其质量数为A,它的m g氧化物中
所含电子的物质的量是( )B2、某元素的某种离子X2-核外共有a个电子,
核内有b个中子,表示该X原子的下列符
号中正确的是( )C
