化学人教版(2019)必修第二册5.1.硫及其化合物(共47张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.硫及其化合物(共47张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 11:51:06 | ||
图片预览











文档简介
(共47张PPT)
第五章 非金属及其化合物
第一节 硫及其化合物
环境污染
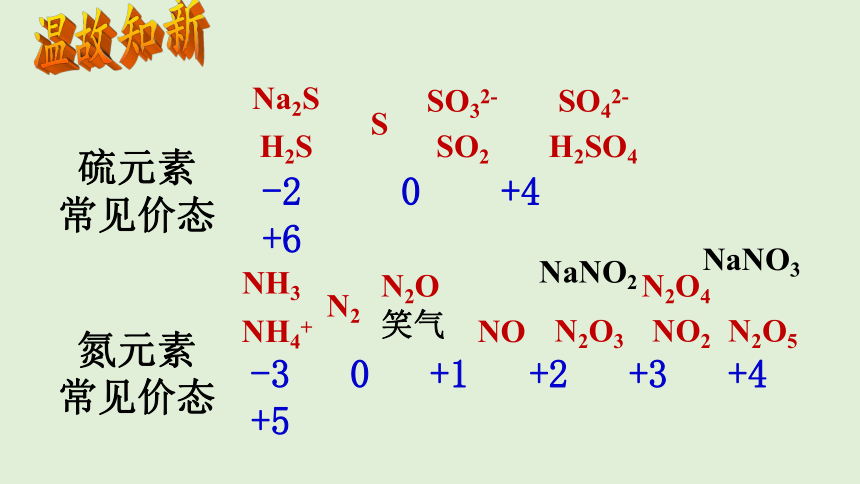
温故知新
硫元素
常见价态
氮元素
常见价态
-2 0 +4 +6
-3 0 +1 +2 +3 +4 +5
Na2S
H2S
S
SO2
SO32-
H2SO4
SO42-
NH3
NH4+
N2
N2O
笑气
NO
N2O3
NO2
N2O4
N2O5
NaNO3
NaNO2
一、硫
1.硫的存在
自然界硫的分布很广,是一种重要的非金属元素。硫以三种形式存在:单质硫、硫化物和硫酸盐
单质硫:
火山口附近或地壳的岩层里
一、硫
1.硫的存在
硫化物:
闪锌矿(ZnS)、方铅矿(PbS)、黄铁矿(FeS2)和黄铜矿(CuFeS2)等
闪锌矿 方铅矿 黄铁矿 黄铜矿
1.硫的存在
硫酸盐:
石膏矿(CaSO4·2H2O)、天青石(SrSO4)、芒硝(Na2SO4·10H2O)和重晶石(BaSO4)等
石膏矿 天青石 芒硝 重晶石
一、硫
1.硫的存在
自然界硫的分布很广,是一种重要的非金属元素。硫以三种形式存在:单质硫、硫化物和硫酸盐
各种蛋白质重含硫0.8%~2.4%化合态的硫,一般煤中含1%~2%的硫,石油中也含有硫
一、硫
2.硫的物理性质
俗称 颜色 状态 脆性 溶解性
硫磺
淡黄色
晶体
脆性
易研磨成粉末
难溶于水
微溶于酒精
易溶于CS2
拓展:硫由S8分子构成的有斜方硫和单斜硫两种同素异形体,硫单质习惯上用符号S表示
一、硫
3.硫的化学性质
S
0
-2
S
+4/6
S
既有氧化性又有还原性
(1)有弱氧化性
(可与还原性较强的H2、金属单质反应)
H2 + S == H2S
2Na + S == Na2S
Mg + S == MgS
2Al + 3S == Al2S3
3.硫的化学性质
(1)有弱氧化性
Fe + S == FeS
2Cu + S == Cu2S
Hg + S == HgS
2Ag + S == Ag2S
与变价金属反应时,将金属氧化为低价硫化物
实验室用硫粉处理洒落的水银,HgS俗称朱砂或辰砂,红色固体
银质器皿变黑
3.硫的化学性质
(2)还原性 (可被O2氧化)
S + O2 === SO2
点燃
现象:在空气中燃烧发出
淡蓝色火焰
3.硫的化学性质
(3)与碱溶液反应
3S+6NaOH==2Na2S+Na2SO3+3H2O
应用: 除去黏附在试管上的单质硫
方法二: 用____清洗试管上的单质硫
CS2
二、二氧化硫
1.二氧化硫的物理性质
颜色 状态 气味 密度 溶解性 毒性
无色
气体
刺激性
比空
气大
有毒
易溶于水
1 : 40
二氧化硫: 易液化
二、二氧化硫
2.二氧化硫的化学性质
思考: 研究SO2的化学性质
可从哪些方面入手?
①从物质分类看:
②从S元素价态看:
酸性氧化物
氧化性和还原性
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物
与碱性氧化物反生成盐
与H2O反应生成酸
酸性氧化物
与碱反应生成盐和水
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物—与水的反应
SO2+H2O H2SO3
正反应
逆反应
(1)酸性氧化物—与水的反应
SO2+H2O H2SO3
正反应
逆反应
可逆反应: 在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物—与碱的反应
SO2(少量)+2NaOH==Na2SO3+H2O
(与CO2类似)
SO2(过量)+NaOH==NaHSO3
(尾气吸收)
练:写出SO2与澄清石灰水反应方程式
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物—与碱性氧化物反应
SO2+Na2O==Na2SO3
SO2+CaO==CaSO3
2.二氧化硫的化学性质
(2)二氧化硫特性—漂白性
实验结论:二氧化硫能漂白品红溶液, 二氧化硫不能漂白指示剂。
2.二氧化硫的化学性质
(2)二氧化硫特性—漂白性
实验结论: SO2的漂白性具有可逆性
(2)二氧化硫特性—漂白性
思考:SO2漂白性为什么可逆?
SO2在生产中常用来漂白纸浆、毛、丝、草帽等,这也是为什么使用久了的草帽会变黄的原因。二氧化硫和某些含硫化合物所具有的漂白作用被一些不法商贩用来加工食品,以使食品增白。这类食品对人的肝、肾等器官有严重的损害,并有致癌作用。
(2)二氧化硫特性—漂白性
思考:将SO2和Cl2同时按1:1的体积比通入盛有品红溶液或紫色石蕊溶液的试管,是不是溶液的褪色现象就更快更迅速了呢?
SO2+Cl2+2H2O=2HCl+H2SO4
小结:漂白性的物质对比如下
Na2O2 (H2O2) HClO O3 SO2 活性炭
漂白原理
漂白品红 (有机色素)
漂白石蕊 (指示剂)
是否可逆
氧化性漂白
化合漂白
吸附漂白
能
能
能
能
不能
不能
不可逆
可逆
——
思考: 向溴水、碘水、酸性高锰酸钾溶液中通入SO2,溶液的颜色都会褪去,这些反应是SO2的漂白性作用吗?
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+I2+2H2O=4H++2I-+SO42-
5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-
2.二氧化硫的化学性质
(3)较强的还原性
2SO2+O2 2SO3
V2O5
SO2+X2+2H2O=2HX+H2SO4
SO2+H2O2=H2SO4
SO2+Na2O2=Na2SO4
SO2+HClO+H2O=H2SO4+HCl
2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
2.二氧化硫的化学性质
(4)较弱的氧化性
SO2+2H2S =3S↓+2H2O
注: 向氢硫酸(H2S的水溶液)或Na2S溶液中通入SO2气体,也可以看到溶液中析出淡黄色浑浊。
三、三氧化硫
1.三氧化硫的物理性质
三氧化硫常温下是液态,在标况下为无色固体(熔点16.80C,沸点44.80C)
三、三氧化硫
2.三氧化硫的化学性质
(1)酸性氧化物
与H2O:
与碱:
与碱性氧化物:
SO3+H2O =H2SO4
SO3+Ca(OH)2=CaSO4+H2O
SO3+CaO=CaSO4
三、三氧化硫
3.三氧化硫的工业制法
通过单质硫无法获得SO3
2SO2+O2 2SO3
V2O5
SO3+H2O =H2SO4
工业制法硫酸
四、亚硫酸 (H2SO3)
知识积累: 亚硫酸属于二元中强酸,习惯
上视其为弱酸;酸性比碳酸强.由于H2SO3易分解,因此没有纯净的H2SO3.实验中的亚硫酸一般就是SO2的水溶液, 或直接用SO2气体代替。
思考:如何证明H2SO3>H2CO3(酸性)
——“强酸制弱酸”
证明: 酸性 H2SO3>H2CO3
四、亚硫酸 (H2SO3)
实验设计:向饱和SO2
溶液中加入少量
NaHCO3粉末。
现象: 溶液中出现许
多细密的小气泡。
证明:酸性H2SO3>H2CO3
四、亚硫酸 (H2SO3)
相关反应:
SO2(少量)+2NaHCO3=
Na2SO3+2CO2↑+H2O
SO2(足量)+NaHCO3=NaHSO3+CO2↑
应用:
除CO2气体中混有的SO2气体
思考:若将CO2和SO2气体分别通入盛有BaCl2溶液的试管中,会出现什么现象呢?
CO2+H2O+BaCl2=BaCO3↓+2HCl
SO2+H2O+BaCl2=BaSO3↓+2HCl
事实上将SO2气体通入BaCl2溶液中时,会看到少量的白色沉淀.这白色沉淀成
分是什么呢?
是BaSO3吗?
加入盐酸,发现沉淀不溶解
BaSO4
2SO2+2H2O+2BaCl2+O2=2BaSO4↓+4HCl
如用纯净的SO2进行实验,则看不到白色沉淀
请同学们再思考:如右图所示,将纯净的CO2或SO2气体与另一物质X(可能是气体、固体或液体)一起通入BaCl2溶液中,试管中产生大量白色沉淀。则X可能是什么物质?白色沉淀是什么物质?
CO2+H2O+BaCl2=BaCO3↓+2HCl
SO2+H2O+BaCl2=BaSO3↓+2HCl
若物质X可以将生成物中的HCl除去,则上面两个反应就能顺利进行了。因此X可能是:_________________________________等碱性物质。
试管中产生
大量白色沉淀
CO2+H2O+BaCl2=BaCO3↓+2HCl
SO2+H2O+BaCl2=BaSO3↓+2HCl
NH3、NaOH、Na2O、Na2O2、CaO
试管中产生
大量白色沉淀
当然物质X也可能直接和BaCl2产生白色沉淀,则X可能是:_______________
_______等,白色沉淀则为对应的生成物______、
_______和_______。
AgNO3、Na2CO3、
H2SO4
AgCl
BaCO3 BaSO4
试管中产生
大量白色沉淀
SO2+H2O+BaCl2=
BaSO3↓+2HCl
若通入的气体为SO2
X除了是碱性物质外还可能是氧化性物质
如:O2、Cl2、H2O2、Na2O2等,
此时白色沉淀是BaSO4
五、二氧化硫的制备
“强酸制弱酸”的原理
Na2SO3+H2SO4(浓)==
Na2SO4+SO2↑+H2O
需用向上排空气法收集气体;用湿润的品红试纸放在集气瓶瓶口,当看到品红试纸褪色,证明气体已经收集满。
练.某化学兴趣小组为探究SO2的性质,按下图
装置进行实验。
已知:Na2SO3+H2SO4(较浓)=Na2SO4+SO2↑+H2O
(1)①中的实验现象为_____________,
此实验证明SO2具有______性。
(2)②中的实验现象为_____________,
证明SO2有______性。
石蕊溶液变红
酸
品红溶液褪色
漂白
(3)③中的实验现象是______________,
证明SO2有______性。
(4)④中的实验现象是_____________,
证明SO2有______性。
产生淡黄色沉淀
氧化
溶液紫色褪去
还原
(5)⑤的作用是________________,
反应的化学方程式为
_____________________________。
吸收尾气,防污染
SO2+2NaOH=Na2SO3+H2O
六、硫化氢的制备与性质
原理:FeS+2H+=Fe2++H2S↑
1.硫化氢的制备
2.硫化氢的物理性质
无色、有臭鸡蛋气味的气体.
密度比空气大,有剧毒的大气
污染物.能溶于水,其水溶液称为氢硫酸.
常温常压下1体积水能溶解2.6体积H2S
3.硫化氢的化学性质
(1)弱酸性 (二元弱酸)
H2S+2NaOH=Na2S+2H2O
(2)还原性
2H2S+3O2 == 2H2O+2SO2(空气充足)
点燃
2H2S+O2 == 2H2O+2S↓(空气不足)
点燃
①与氧气反应
(2)还原性
3.硫化氢的化学性质
②SO2通入氢硫酸H2S中
③H2S通入FeCl3溶液
SO2 + 2H2S = 3S↓+ 2H2O
2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+
(3)受热易分解
3.硫化氢的化学性质
H2S == H2 + S
实验现象:溶液蓝色褪去,出现黑色沉淀
思考: 弱酸一定不能制强酸吗?
CuSO4+H2S=CuS↓+H2SO4
原因: CuS是一种不溶于酸的难溶物
第五章 非金属及其化合物
第一节 硫及其化合物
环境污染
温故知新
硫元素
常见价态
氮元素
常见价态
-2 0 +4 +6
-3 0 +1 +2 +3 +4 +5
Na2S
H2S
S
SO2
SO32-
H2SO4
SO42-
NH3
NH4+
N2
N2O
笑气
NO
N2O3
NO2
N2O4
N2O5
NaNO3
NaNO2
一、硫
1.硫的存在
自然界硫的分布很广,是一种重要的非金属元素。硫以三种形式存在:单质硫、硫化物和硫酸盐
单质硫:
火山口附近或地壳的岩层里
一、硫
1.硫的存在
硫化物:
闪锌矿(ZnS)、方铅矿(PbS)、黄铁矿(FeS2)和黄铜矿(CuFeS2)等
闪锌矿 方铅矿 黄铁矿 黄铜矿
1.硫的存在
硫酸盐:
石膏矿(CaSO4·2H2O)、天青石(SrSO4)、芒硝(Na2SO4·10H2O)和重晶石(BaSO4)等
石膏矿 天青石 芒硝 重晶石
一、硫
1.硫的存在
自然界硫的分布很广,是一种重要的非金属元素。硫以三种形式存在:单质硫、硫化物和硫酸盐
各种蛋白质重含硫0.8%~2.4%化合态的硫,一般煤中含1%~2%的硫,石油中也含有硫
一、硫
2.硫的物理性质
俗称 颜色 状态 脆性 溶解性
硫磺
淡黄色
晶体
脆性
易研磨成粉末
难溶于水
微溶于酒精
易溶于CS2
拓展:硫由S8分子构成的有斜方硫和单斜硫两种同素异形体,硫单质习惯上用符号S表示
一、硫
3.硫的化学性质
S
0
-2
S
+4/6
S
既有氧化性又有还原性
(1)有弱氧化性
(可与还原性较强的H2、金属单质反应)
H2 + S == H2S
2Na + S == Na2S
Mg + S == MgS
2Al + 3S == Al2S3
3.硫的化学性质
(1)有弱氧化性
Fe + S == FeS
2Cu + S == Cu2S
Hg + S == HgS
2Ag + S == Ag2S
与变价金属反应时,将金属氧化为低价硫化物
实验室用硫粉处理洒落的水银,HgS俗称朱砂或辰砂,红色固体
银质器皿变黑
3.硫的化学性质
(2)还原性 (可被O2氧化)
S + O2 === SO2
点燃
现象:在空气中燃烧发出
淡蓝色火焰
3.硫的化学性质
(3)与碱溶液反应
3S+6NaOH==2Na2S+Na2SO3+3H2O
应用: 除去黏附在试管上的单质硫
方法二: 用____清洗试管上的单质硫
CS2
二、二氧化硫
1.二氧化硫的物理性质
颜色 状态 气味 密度 溶解性 毒性
无色
气体
刺激性
比空
气大
有毒
易溶于水
1 : 40
二氧化硫: 易液化
二、二氧化硫
2.二氧化硫的化学性质
思考: 研究SO2的化学性质
可从哪些方面入手?
①从物质分类看:
②从S元素价态看:
酸性氧化物
氧化性和还原性
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物
与碱性氧化物反生成盐
与H2O反应生成酸
酸性氧化物
与碱反应生成盐和水
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物—与水的反应
SO2+H2O H2SO3
正反应
逆反应
(1)酸性氧化物—与水的反应
SO2+H2O H2SO3
正反应
逆反应
可逆反应: 在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物—与碱的反应
SO2(少量)+2NaOH==Na2SO3+H2O
(与CO2类似)
SO2(过量)+NaOH==NaHSO3
(尾气吸收)
练:写出SO2与澄清石灰水反应方程式
二、二氧化硫
2.二氧化硫的化学性质
(1)酸性氧化物—与碱性氧化物反应
SO2+Na2O==Na2SO3
SO2+CaO==CaSO3
2.二氧化硫的化学性质
(2)二氧化硫特性—漂白性
实验结论:二氧化硫能漂白品红溶液, 二氧化硫不能漂白指示剂。
2.二氧化硫的化学性质
(2)二氧化硫特性—漂白性
实验结论: SO2的漂白性具有可逆性
(2)二氧化硫特性—漂白性
思考:SO2漂白性为什么可逆?
SO2在生产中常用来漂白纸浆、毛、丝、草帽等,这也是为什么使用久了的草帽会变黄的原因。二氧化硫和某些含硫化合物所具有的漂白作用被一些不法商贩用来加工食品,以使食品增白。这类食品对人的肝、肾等器官有严重的损害,并有致癌作用。
(2)二氧化硫特性—漂白性
思考:将SO2和Cl2同时按1:1的体积比通入盛有品红溶液或紫色石蕊溶液的试管,是不是溶液的褪色现象就更快更迅速了呢?
SO2+Cl2+2H2O=2HCl+H2SO4
小结:漂白性的物质对比如下
Na2O2 (H2O2) HClO O3 SO2 活性炭
漂白原理
漂白品红 (有机色素)
漂白石蕊 (指示剂)
是否可逆
氧化性漂白
化合漂白
吸附漂白
能
能
能
能
不能
不能
不可逆
可逆
——
思考: 向溴水、碘水、酸性高锰酸钾溶液中通入SO2,溶液的颜色都会褪去,这些反应是SO2的漂白性作用吗?
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+I2+2H2O=4H++2I-+SO42-
5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-
2.二氧化硫的化学性质
(3)较强的还原性
2SO2+O2 2SO3
V2O5
SO2+X2+2H2O=2HX+H2SO4
SO2+H2O2=H2SO4
SO2+Na2O2=Na2SO4
SO2+HClO+H2O=H2SO4+HCl
2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl
2.二氧化硫的化学性质
(4)较弱的氧化性
SO2+2H2S =3S↓+2H2O
注: 向氢硫酸(H2S的水溶液)或Na2S溶液中通入SO2气体,也可以看到溶液中析出淡黄色浑浊。
三、三氧化硫
1.三氧化硫的物理性质
三氧化硫常温下是液态,在标况下为无色固体(熔点16.80C,沸点44.80C)
三、三氧化硫
2.三氧化硫的化学性质
(1)酸性氧化物
与H2O:
与碱:
与碱性氧化物:
SO3+H2O =H2SO4
SO3+Ca(OH)2=CaSO4+H2O
SO3+CaO=CaSO4
三、三氧化硫
3.三氧化硫的工业制法
通过单质硫无法获得SO3
2SO2+O2 2SO3
V2O5
SO3+H2O =H2SO4
工业制法硫酸
四、亚硫酸 (H2SO3)
知识积累: 亚硫酸属于二元中强酸,习惯
上视其为弱酸;酸性比碳酸强.由于H2SO3易分解,因此没有纯净的H2SO3.实验中的亚硫酸一般就是SO2的水溶液, 或直接用SO2气体代替。
思考:如何证明H2SO3>H2CO3(酸性)
——“强酸制弱酸”
证明: 酸性 H2SO3>H2CO3
四、亚硫酸 (H2SO3)
实验设计:向饱和SO2
溶液中加入少量
NaHCO3粉末。
现象: 溶液中出现许
多细密的小气泡。
证明:酸性H2SO3>H2CO3
四、亚硫酸 (H2SO3)
相关反应:
SO2(少量)+2NaHCO3=
Na2SO3+2CO2↑+H2O
SO2(足量)+NaHCO3=NaHSO3+CO2↑
应用:
除CO2气体中混有的SO2气体
思考:若将CO2和SO2气体分别通入盛有BaCl2溶液的试管中,会出现什么现象呢?
CO2+H2O+BaCl2=BaCO3↓+2HCl
SO2+H2O+BaCl2=BaSO3↓+2HCl
事实上将SO2气体通入BaCl2溶液中时,会看到少量的白色沉淀.这白色沉淀成
分是什么呢?
是BaSO3吗?
加入盐酸,发现沉淀不溶解
BaSO4
2SO2+2H2O+2BaCl2+O2=2BaSO4↓+4HCl
如用纯净的SO2进行实验,则看不到白色沉淀
请同学们再思考:如右图所示,将纯净的CO2或SO2气体与另一物质X(可能是气体、固体或液体)一起通入BaCl2溶液中,试管中产生大量白色沉淀。则X可能是什么物质?白色沉淀是什么物质?
CO2+H2O+BaCl2=BaCO3↓+2HCl
SO2+H2O+BaCl2=BaSO3↓+2HCl
若物质X可以将生成物中的HCl除去,则上面两个反应就能顺利进行了。因此X可能是:_________________________________等碱性物质。
试管中产生
大量白色沉淀
CO2+H2O+BaCl2=BaCO3↓+2HCl
SO2+H2O+BaCl2=BaSO3↓+2HCl
NH3、NaOH、Na2O、Na2O2、CaO
试管中产生
大量白色沉淀
当然物质X也可能直接和BaCl2产生白色沉淀,则X可能是:_______________
_______等,白色沉淀则为对应的生成物______、
_______和_______。
AgNO3、Na2CO3、
H2SO4
AgCl
BaCO3 BaSO4
试管中产生
大量白色沉淀
SO2+H2O+BaCl2=
BaSO3↓+2HCl
若通入的气体为SO2
X除了是碱性物质外还可能是氧化性物质
如:O2、Cl2、H2O2、Na2O2等,
此时白色沉淀是BaSO4
五、二氧化硫的制备
“强酸制弱酸”的原理
Na2SO3+H2SO4(浓)==
Na2SO4+SO2↑+H2O
需用向上排空气法收集气体;用湿润的品红试纸放在集气瓶瓶口,当看到品红试纸褪色,证明气体已经收集满。
练.某化学兴趣小组为探究SO2的性质,按下图
装置进行实验。
已知:Na2SO3+H2SO4(较浓)=Na2SO4+SO2↑+H2O
(1)①中的实验现象为_____________,
此实验证明SO2具有______性。
(2)②中的实验现象为_____________,
证明SO2有______性。
石蕊溶液变红
酸
品红溶液褪色
漂白
(3)③中的实验现象是______________,
证明SO2有______性。
(4)④中的实验现象是_____________,
证明SO2有______性。
产生淡黄色沉淀
氧化
溶液紫色褪去
还原
(5)⑤的作用是________________,
反应的化学方程式为
_____________________________。
吸收尾气,防污染
SO2+2NaOH=Na2SO3+H2O
六、硫化氢的制备与性质
原理:FeS+2H+=Fe2++H2S↑
1.硫化氢的制备
2.硫化氢的物理性质
无色、有臭鸡蛋气味的气体.
密度比空气大,有剧毒的大气
污染物.能溶于水,其水溶液称为氢硫酸.
常温常压下1体积水能溶解2.6体积H2S
3.硫化氢的化学性质
(1)弱酸性 (二元弱酸)
H2S+2NaOH=Na2S+2H2O
(2)还原性
2H2S+3O2 == 2H2O+2SO2(空气充足)
点燃
2H2S+O2 == 2H2O+2S↓(空气不足)
点燃
①与氧气反应
(2)还原性
3.硫化氢的化学性质
②SO2通入氢硫酸H2S中
③H2S通入FeCl3溶液
SO2 + 2H2S = 3S↓+ 2H2O
2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+
(3)受热易分解
3.硫化氢的化学性质
H2S == H2 + S
实验现象:溶液蓝色褪去,出现黑色沉淀
思考: 弱酸一定不能制强酸吗?
CuSO4+H2S=CuS↓+H2SO4
原因: CuS是一种不溶于酸的难溶物
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
