化学人教版(2019)选择性必修2 3.2.1分子晶体(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1分子晶体(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 11:52:08 | ||
图片预览






文档简介
(共21张PPT)
网
科
学
第二节 分子晶体与共价晶体
3.2.1 分子晶体
第三章 晶体结构与性质
观察下图,找出干冰、I2 两种晶体结构的共同点
干冰的晶体结构 I2 的晶体结构
1.借助分子晶体模型认识晶体的结构特点。
2.能从范德华力、氢键的角度分析、理解分子晶体的物理性质。
3.学会比较晶体的熔、沸点。
【学习目标】
【问题导学】
快速阅读课本P78-P79,思考并回答下列问题:
构成微粒:
微粒内作用:
微粒间作用:
晶胞中分子位置:
【点拨精讲】
一、分子晶体
1、分子晶体的概念
只含分子的晶体称为分子晶体。
1.所有非金属氢化物:H2S, CH4 , NH3等;
2.部分非金属单质:O2, N2 ,白磷等;
3.部分非金属氧化物:CO2,NO2,P4O6 等;
4.几乎所有的酸;
5.绝大多数有机物。
2、典型的分子晶体:
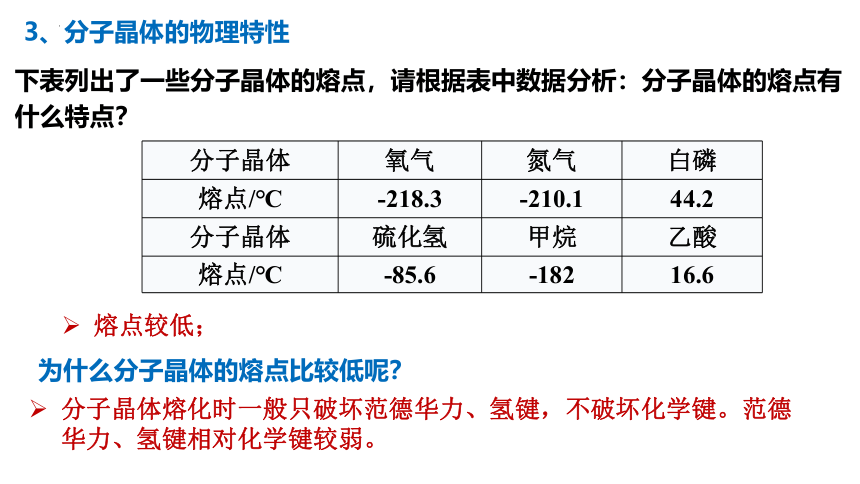
下表列出了一些分子晶体的熔点,请根据表中数据分析:分子晶体的熔点有什么特点?
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
熔点较低;
分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
3、分子晶体的物理特性
为什么分子晶体的熔点比较低呢?
溜冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
原因:分子间作用力较弱,容易被克服
思考交流
3、分子晶体的物理特性
分子晶体(如冰晶体)一般硬度比较小,如何从结构的角度进行解释呢?
说明冰晶体的硬度小
构成分子晶体的微粒都是分子,熔融时没有产生自由移动的离子,因此分子晶体一般不导电。
分子晶体(如乙醇)一般都是绝缘体,熔融状态下也不导电。从结构的角度又应该如何解释呢?
思考交流
3、分子晶体的物理特性
熔沸点低
硬度小
不导电
溶解性——“相似相溶”
3、分子晶体的物理特性
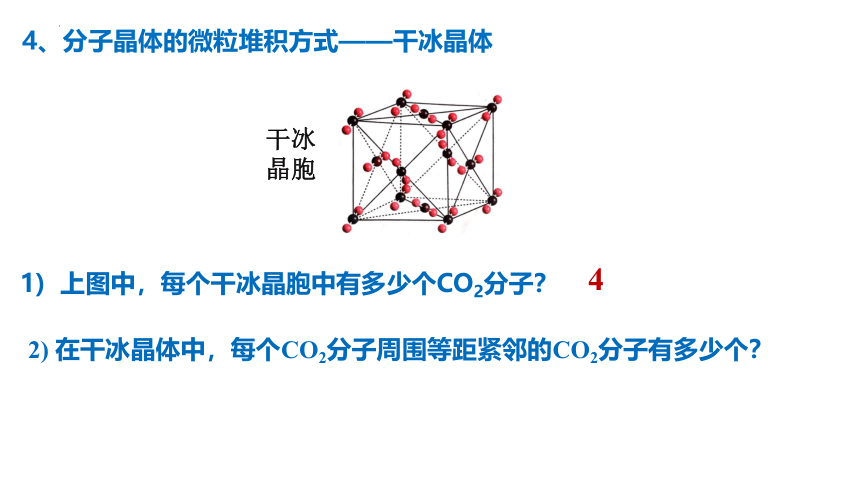
干冰晶胞
1) 上图中,每个干冰晶胞中有多少个CO2分子?
4
4、分子晶体的微粒堆积方式——干冰晶体
2) 在干冰晶体中,每个CO2分子周围等距紧邻的CO2分子有多少个?
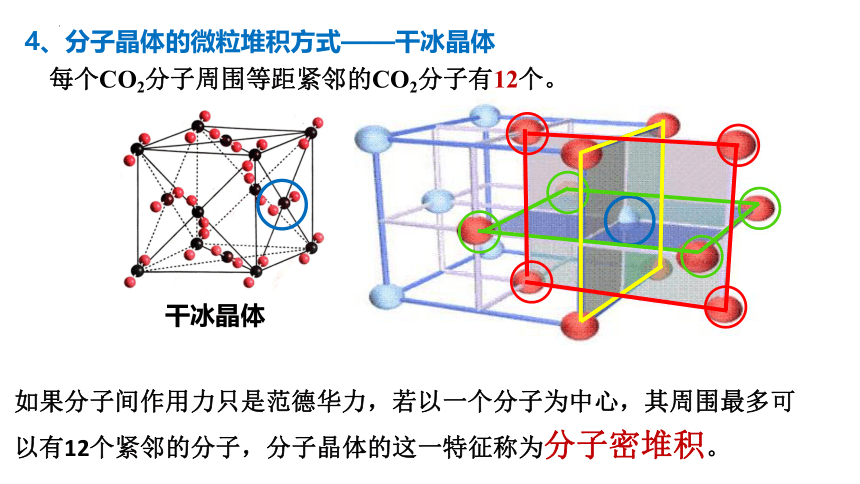
干冰晶体
每个CO2分子周围等距紧邻的CO2分子有12个。
4、分子晶体的微粒堆积方式——干冰晶体
如果分子间作用力只是范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。
冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
在冰晶体中,每个水分子周围只有4个紧邻的水分子。因为水分子间存在氢键,氢键具有方向性,每个水分子都与4个相邻的水分子相互吸引,构成四面体,属于非密堆积。
观察思考
冰的结构
冰的结构
4、分子晶体的微粒堆积方式——冰晶体
冰晶体中1 mol H2O最多有多少mol 氢键?
观察思考
冰晶体中,每个水分子与其它4个水分子形成氢键,每个氢键由2个水分子均摊,故4×1/2=2,每个水分子平均形成2个氢键。即冰晶体1 mol H2O中最多含有2 mol氢键。
1
2
3
4
4、分子晶体的微粒堆积方式——冰晶体
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
4、分子晶体的微粒堆积方式——冰晶体
由于氢键的方向性,使冰晶体中每个水分子与四面体顶角方向的4个相邻水分子相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,结的冰会浮在水面上。
4、分子晶体的微粒堆积方式——冰晶体
4、分子晶体的微粒堆积方式——冰晶体
(1)0-4℃时,温度升高,热运动使缔合水分子的部分氢键断裂,分子间空隙减小,密度增大;
水的密度随温度变化的曲线如下图所示。0-4℃,水的密度随温度的升高而增大。超过4℃,水的密度随温度的升高而减小。为什么会这样呢
资料卡片
(2)超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
4、分子晶体的微粒堆积方式
微粒间作用力 _________ _______________
微粒堆积方式 _________ _______________
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
范德华力和氢键
密堆积
非密堆积
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。
而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
思考讨论
4、分子晶体的微粒堆积方式
20世纪末,科学家发现海底存在大量天然气水合物晶体——可燃冰。
科学 技术 社会 P80
天然气水合物—一种潜在的能源
2017年5月18日,我国南海神狐海域天然气水合物试采实现连续超过7天稳定产气。
分子晶体
一、概念
组成微粒及微粒间相互作用
二、典型的分子晶体
三、物理特性
四、微粒堆积方式
1.只有范德华力,无分子间氢键——密堆积
2.有分子间氢键——非密堆积
【课堂小结】
1.下列关于分子晶体的说法正确的是 ( )
A. 分子内均存在共价键
B. 分子间一定存在范德华力
C. 分子间一定存在氢键
D. 晶体的熔、沸点一般较高
【当堂检测】
2.下列性质适合于分子晶体的是 ( )
①熔点1 070 ℃,易溶于水,水溶液导电
②熔点10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8℃,沸点444.6 ℃
④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3
A.①② B.①③ C.②③ D.②④
3.下列各组物质都属于分子晶体的是 ( )
A.碘、二氧化碳、白磷、C60
B.NaCl、二氧化碳、白磷、二氧化硫
C.SO2、金刚石、N2、铜
D.醋酸、甲烷、石墨、氧化钠
4.下列说法正确的是( )
A. 范德华力普遍存在于分子之间,如液态水中因范德华力的存在使
水分子发生缔合
B. H2SO4为强电解质,硫酸晶体是能导电的
C. 冰中1个H2O分子可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的数目之比为1∶4D. 氢键有饱和性和方向性,所以液态水结成冰时体积会变大
5.干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有
A.4个 B.8个
C.12个 D.6个
网
科
学
第二节 分子晶体与共价晶体
3.2.1 分子晶体
第三章 晶体结构与性质
观察下图,找出干冰、I2 两种晶体结构的共同点
干冰的晶体结构 I2 的晶体结构
1.借助分子晶体模型认识晶体的结构特点。
2.能从范德华力、氢键的角度分析、理解分子晶体的物理性质。
3.学会比较晶体的熔、沸点。
【学习目标】
【问题导学】
快速阅读课本P78-P79,思考并回答下列问题:
构成微粒:
微粒内作用:
微粒间作用:
晶胞中分子位置:
【点拨精讲】
一、分子晶体
1、分子晶体的概念
只含分子的晶体称为分子晶体。
1.所有非金属氢化物:H2S, CH4 , NH3等;
2.部分非金属单质:O2, N2 ,白磷等;
3.部分非金属氧化物:CO2,NO2,P4O6 等;
4.几乎所有的酸;
5.绝大多数有机物。
2、典型的分子晶体:
下表列出了一些分子晶体的熔点,请根据表中数据分析:分子晶体的熔点有什么特点?
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
熔点较低;
分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
3、分子晶体的物理特性
为什么分子晶体的熔点比较低呢?
溜冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
原因:分子间作用力较弱,容易被克服
思考交流
3、分子晶体的物理特性
分子晶体(如冰晶体)一般硬度比较小,如何从结构的角度进行解释呢?
说明冰晶体的硬度小
构成分子晶体的微粒都是分子,熔融时没有产生自由移动的离子,因此分子晶体一般不导电。
分子晶体(如乙醇)一般都是绝缘体,熔融状态下也不导电。从结构的角度又应该如何解释呢?
思考交流
3、分子晶体的物理特性
熔沸点低
硬度小
不导电
溶解性——“相似相溶”
3、分子晶体的物理特性
干冰晶胞
1) 上图中,每个干冰晶胞中有多少个CO2分子?
4
4、分子晶体的微粒堆积方式——干冰晶体
2) 在干冰晶体中,每个CO2分子周围等距紧邻的CO2分子有多少个?
干冰晶体
每个CO2分子周围等距紧邻的CO2分子有12个。
4、分子晶体的微粒堆积方式——干冰晶体
如果分子间作用力只是范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。
冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
在冰晶体中,每个水分子周围只有4个紧邻的水分子。因为水分子间存在氢键,氢键具有方向性,每个水分子都与4个相邻的水分子相互吸引,构成四面体,属于非密堆积。
观察思考
冰的结构
冰的结构
4、分子晶体的微粒堆积方式——冰晶体
冰晶体中1 mol H2O最多有多少mol 氢键?
观察思考
冰晶体中,每个水分子与其它4个水分子形成氢键,每个氢键由2个水分子均摊,故4×1/2=2,每个水分子平均形成2个氢键。即冰晶体1 mol H2O中最多含有2 mol氢键。
1
2
3
4
4、分子晶体的微粒堆积方式——冰晶体
冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
4、分子晶体的微粒堆积方式——冰晶体
由于氢键的方向性,使冰晶体中每个水分子与四面体顶角方向的4个相邻水分子相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,结的冰会浮在水面上。
4、分子晶体的微粒堆积方式——冰晶体
4、分子晶体的微粒堆积方式——冰晶体
(1)0-4℃时,温度升高,热运动使缔合水分子的部分氢键断裂,分子间空隙减小,密度增大;
水的密度随温度变化的曲线如下图所示。0-4℃,水的密度随温度的升高而增大。超过4℃,水的密度随温度的升高而减小。为什么会这样呢
资料卡片
(2)超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
4、分子晶体的微粒堆积方式
微粒间作用力 _________ _______________
微粒堆积方式 _________ _______________
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
范德华力和氢键
密堆积
非密堆积
硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积。因此,一个硫化氢分子周围有12分紧邻分子。
而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
思考讨论
4、分子晶体的微粒堆积方式
20世纪末,科学家发现海底存在大量天然气水合物晶体——可燃冰。
科学 技术 社会 P80
天然气水合物—一种潜在的能源
2017年5月18日,我国南海神狐海域天然气水合物试采实现连续超过7天稳定产气。
分子晶体
一、概念
组成微粒及微粒间相互作用
二、典型的分子晶体
三、物理特性
四、微粒堆积方式
1.只有范德华力,无分子间氢键——密堆积
2.有分子间氢键——非密堆积
【课堂小结】
1.下列关于分子晶体的说法正确的是 ( )
A. 分子内均存在共价键
B. 分子间一定存在范德华力
C. 分子间一定存在氢键
D. 晶体的熔、沸点一般较高
【当堂检测】
2.下列性质适合于分子晶体的是 ( )
①熔点1 070 ℃,易溶于水,水溶液导电
②熔点10.31 ℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8℃,沸点444.6 ℃
④熔点97.81 ℃,质软、导电,密度为0.97 g·cm-3
A.①② B.①③ C.②③ D.②④
3.下列各组物质都属于分子晶体的是 ( )
A.碘、二氧化碳、白磷、C60
B.NaCl、二氧化碳、白磷、二氧化硫
C.SO2、金刚石、N2、铜
D.醋酸、甲烷、石墨、氧化钠
4.下列说法正确的是( )
A. 范德华力普遍存在于分子之间,如液态水中因范德华力的存在使
水分子发生缔合
B. H2SO4为强电解质,硫酸晶体是能导电的
C. 冰中1个H2O分子可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的数目之比为1∶4D. 氢键有饱和性和方向性,所以液态水结成冰时体积会变大
5.干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有
A.4个 B.8个
C.12个 D.6个
