2021-2022学年高二化学同步课件(人教版选修3)2.1 共价键
文档属性
| 名称 | 2021-2022学年高二化学同步课件(人教版选修3)2.1 共价键 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 15:50:24 | ||
图片预览





文档简介
(共20张PPT)
第二章 分子结构与性质
2.1 共价键
2021-2022学年高二化学同步课件(人教版选修3)★★
一、化学键
1、定义
使离子相结合或使原子相结合的作用力统称为化学键。
2、类型
共价键
离子键
金属键
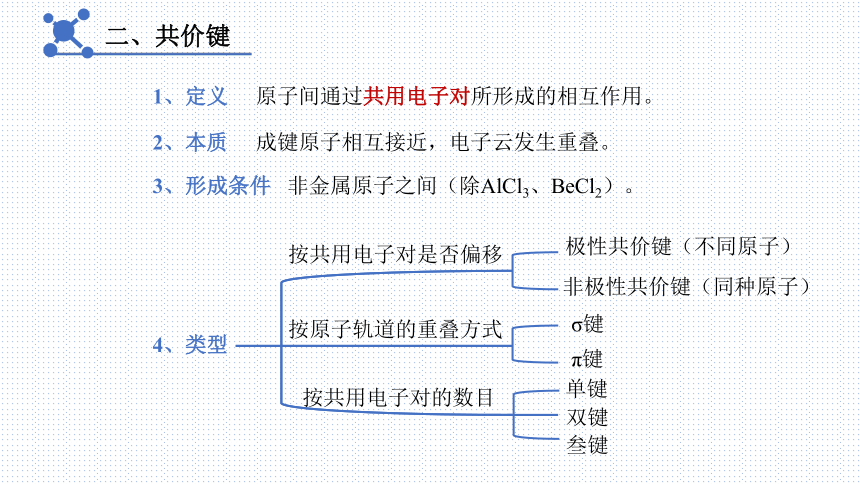
二、共价键
1、定义
原子间通过共用电子对所形成的相互作用。
2、本质
成键原子相互接近,电子云发生重叠。
4、类型
按共用电子对是否偏移
σ键
π键
非极性共价键(同种原子)
单键
双键
叁键
极性共价键(不同原子)
按原子轨道的重叠方式
按共用电子对的数目
3、形成条件
非金属原子之间(除AlCl3、BeCl2)。
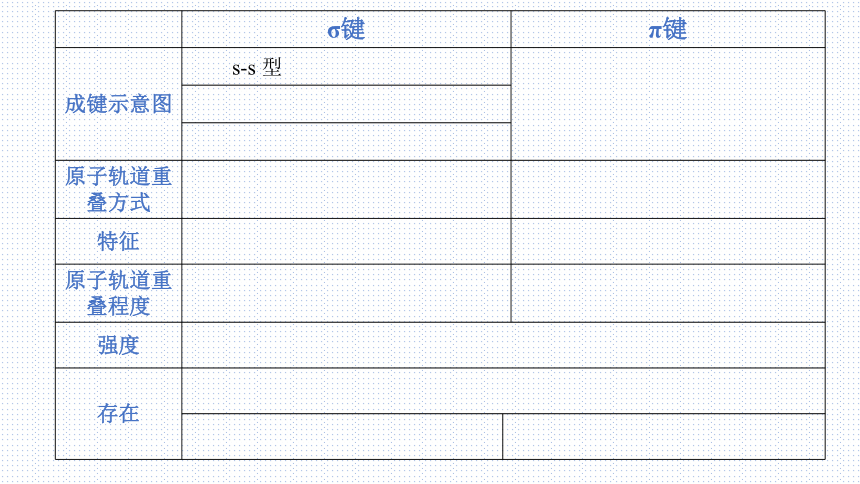
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
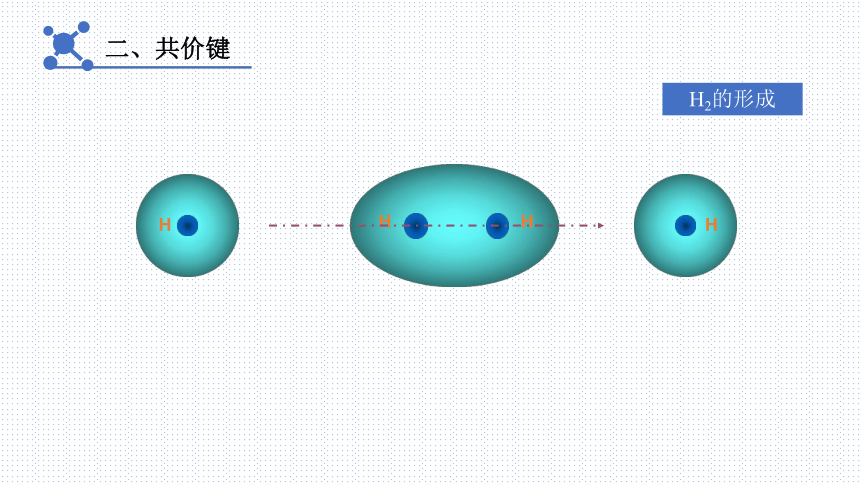
二、共价键
H
H
H
H
H2的形成
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
s-p 型
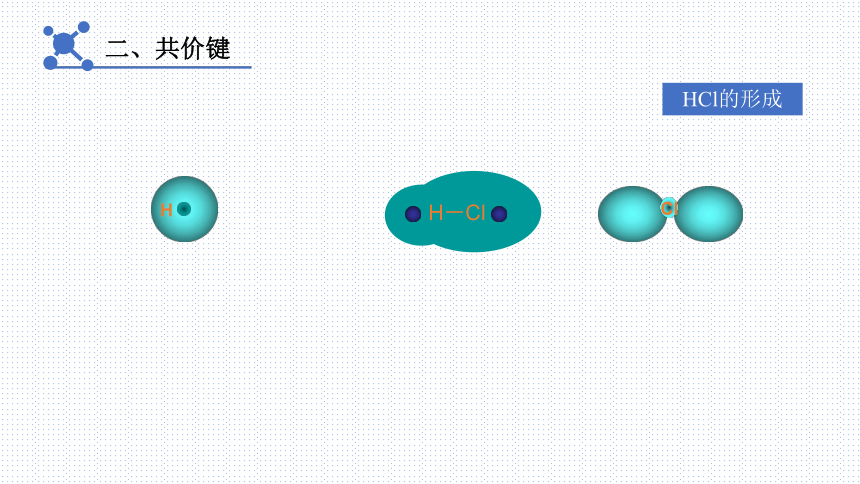
二、共价键
HCl的形成
H
Cl
H-Cl
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
s-p 型
p-p 型
二、共价键
Cl2的形成
Cl
Cl
Cl
Cl
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
s-p 型
p-p 型
头碰头
肩并肩
轴对称,以两原子核的连线为轴旋转
镜面对称,以包含原子核的平面为镜面,不能旋转
大
小
σ键>π键
共价单键是σ键,双键:1个σ键,1个π键,三键:1个σ键,2个π键
p-p 型
CH4
CO2,C2H4、N2、C2H2
方向性
饱和性
s-p 型
三、键参数
科学探究
1、N2中p-p σ键和p-p π键的形成过程
z
z
y
y
x
2、钠和氯通过得失电子同样也是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?
原子 Na Cl H Cl C O
电负性
电负性之差(绝对值)
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。 0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
1.7
三、键参数
科学探究
3、乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由
7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
三、键参数
科学探究
三、键参数
1、键能
(1)定义:气态基态原子形成1mol化学键释放的最低能量,取正值,kJ/mol。
(2)应用:键能越大,分子越稳定。
2、键长
eg: 三键>双键>单键
(1)定义:两个成键原子的原子核间距离。
(2)应用:键长越短,键能越大,分子越稳定。
(3)判断:原子半径越小,键长越短。
eg: H-I > H-Br > H-Cl > H-F
3、键角
(1)定义:在原子数超过2的分子中,两个共价键之间的夹角。
(2)常见分子的键角:CO2:180°直线形;H2O:105°V形;NH3:107°三角锥形。
三、键参数
三、键参数
四、等电子体
1、等电子原理
原子总数相同,价电子总数相同的分子或离子互称为等电子体。性质和空间构型相似。
2、常见的等电子体
等电子体类型 例子
2原子10价电子
CO、
N2、
CO2、
CS2、
N2O、
、
SCN-、
SO2、
O3、
SO3、
BF3、
NH3、
H3O+
CH4、
SiH4、
CCl4、
SiF4、
SF6、
3原子16价电子
3原子18价电子
4原子8价电子
4原子24价电子
5原子8价电子
5原子32价电子
7原子48价电子
CN-、
课堂练习
1、下列有关化学键类型的判断正确的是( )
A.全部由非金属元素组成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
D
课堂练习
A
2、能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
课堂练习
B
3、下列说法中正确的是 ( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族和ⅦA族元素的原子间可能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
第二章 分子结构与性质
2.1 共价键
2021-2022学年高二化学同步课件(人教版选修3)★★
一、化学键
1、定义
使离子相结合或使原子相结合的作用力统称为化学键。
2、类型
共价键
离子键
金属键
二、共价键
1、定义
原子间通过共用电子对所形成的相互作用。
2、本质
成键原子相互接近,电子云发生重叠。
4、类型
按共用电子对是否偏移
σ键
π键
非极性共价键(同种原子)
单键
双键
叁键
极性共价键(不同原子)
按原子轨道的重叠方式
按共用电子对的数目
3、形成条件
非金属原子之间(除AlCl3、BeCl2)。
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
二、共价键
H
H
H
H
H2的形成
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
s-p 型
二、共价键
HCl的形成
H
Cl
H-Cl
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
s-p 型
p-p 型
二、共价键
Cl2的形成
Cl
Cl
Cl
Cl
σ键 π键
成键示意图
原子轨道重叠方式
特征
原子轨道重叠程度
强度 存在 s-s 型
s-p 型
p-p 型
头碰头
肩并肩
轴对称,以两原子核的连线为轴旋转
镜面对称,以包含原子核的平面为镜面,不能旋转
大
小
σ键>π键
共价单键是σ键,双键:1个σ键,1个π键,三键:1个σ键,2个π键
p-p 型
CH4
CO2,C2H4、N2、C2H2
方向性
饱和性
s-p 型
三、键参数
科学探究
1、N2中p-p σ键和p-p π键的形成过程
z
z
y
y
x
2、钠和氯通过得失电子同样也是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?
原子 Na Cl H Cl C O
电负性
电负性之差(绝对值)
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。 0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
1.7
三、键参数
科学探究
3、乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由
7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
三、键参数
科学探究
三、键参数
1、键能
(1)定义:气态基态原子形成1mol化学键释放的最低能量,取正值,kJ/mol。
(2)应用:键能越大,分子越稳定。
2、键长
eg: 三键>双键>单键
(1)定义:两个成键原子的原子核间距离。
(2)应用:键长越短,键能越大,分子越稳定。
(3)判断:原子半径越小,键长越短。
eg: H-I > H-Br > H-Cl > H-F
3、键角
(1)定义:在原子数超过2的分子中,两个共价键之间的夹角。
(2)常见分子的键角:CO2:180°直线形;H2O:105°V形;NH3:107°三角锥形。
三、键参数
三、键参数
四、等电子体
1、等电子原理
原子总数相同,价电子总数相同的分子或离子互称为等电子体。性质和空间构型相似。
2、常见的等电子体
等电子体类型 例子
2原子10价电子
CO、
N2、
CO2、
CS2、
N2O、
、
SCN-、
SO2、
O3、
SO3、
BF3、
NH3、
H3O+
CH4、
SiH4、
CCl4、
SiF4、
SF6、
3原子16价电子
3原子18价电子
4原子8价电子
4原子24价电子
5原子8价电子
5原子32价电子
7原子48价电子
CN-、
课堂练习
1、下列有关化学键类型的判断正确的是( )
A.全部由非金属元素组成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
D
课堂练习
A
2、能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
课堂练习
B
3、下列说法中正确的是 ( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族和ⅦA族元素的原子间可能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
