2021-2022学年高二化学同步课件(人教版选修3)★★2.2 分子的立体构型
文档属性
| 名称 | 2021-2022学年高二化学同步课件(人教版选修3)★★2.2 分子的立体构型 |

|
|
| 格式 | pptx | ||
| 文件大小 | 402.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 15:51:30 | ||
图片预览



文档简介
(共19张PPT)
第二章 分子结构与性质
2.2 分子的立体构型
2021-2022学年高二化学同步课件(人教版选修3)★★
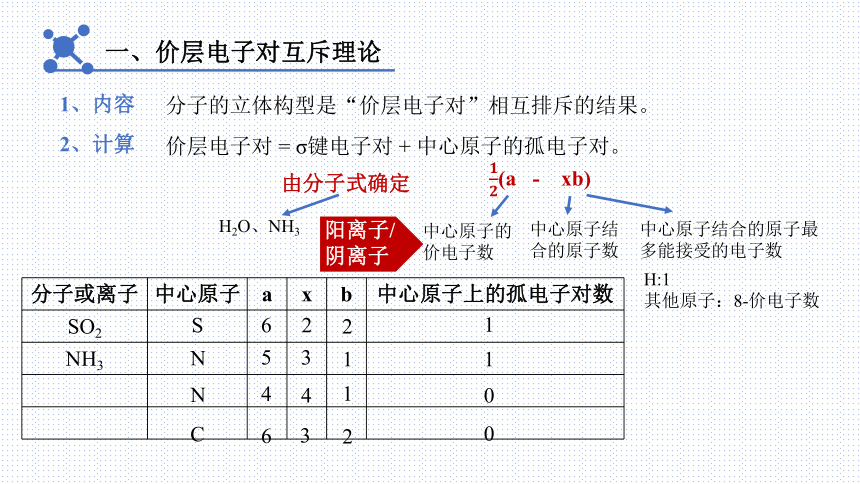
一、价层电子对互斥理论
1、内容
分子的立体构型是“价层电子对”相互排斥的结果。
价层电子对 = σ键电子对 + 中心原子的孤电子对。
由分子式确定
(a - xb)
H2O、NH3
中心原子的价电子数
中心原子结合的原子数
中心原子结合的原子最多能接受的电子数
H:1
其他原子:8-价电子数
2、计算
分子或离子 中心原子 a x b 中心原子上的孤电子对数
SO2
NH3
S
N
N
C
6
5
4
6
阳离子/阴离子
2
3
4
3
2
1
1
2
1
1
0
0
一、价层电子对互斥理论
中心原子的价层电子对数
3、判断分子立体构型
价层电子对互斥理论
VSEPR模型
略去孤电子对
分子的立体构型
分子 σ键电子对数 孤电子对数 价层电子对数 价层电子对排列方式 VSEPR 模型名称 立体构型名称
BeCl2、CO2、SiO2
BF33、
PbCl2、SO2、O3
2
0
2
直线形
直线形
3
0
3
平面三角形
平面三角形
2
1
V形
一、价层电子对互斥理论
中心原子的价层电子对数
3、判断分子立体构型
价层电子对互斥理论
VSEPR模型
略去孤电子对
分子的立体构型
分子 σ键电子对数 孤电子对数 价层电子对数 价层电子对排列方式 VSEPR 模型名称 立体构型名称
CCl4、CH4
NH3、NF3
H2O、
4
0
4
四面体形
正四面体形
3
1
三角锥形
2
2
V形
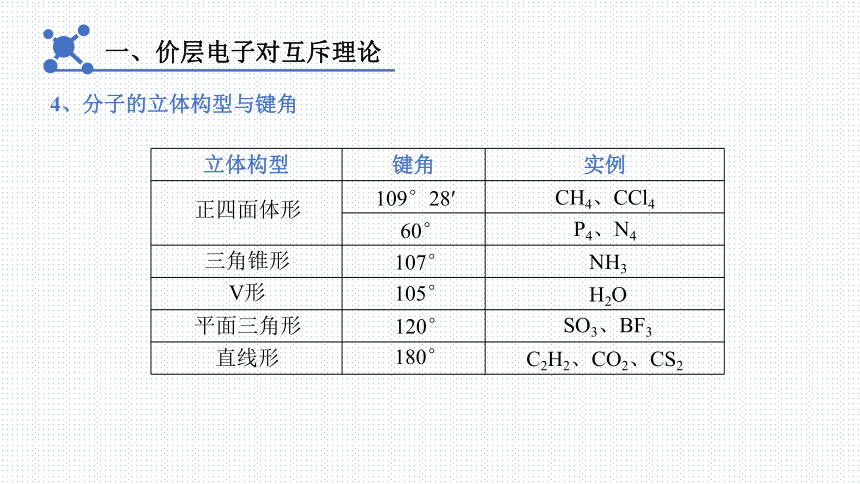
4、分子的立体构型与键角
一、价层电子对互斥理论
立体构型 键角 实例
正四面体形
109°28′
60°
CH4、CCl4
P4、N4
平面三角形
120°
SO3、BF3
三角锥形
107°
NH3
V形
105°
H2O
直线形
180°
C2H2、CO2、CS2
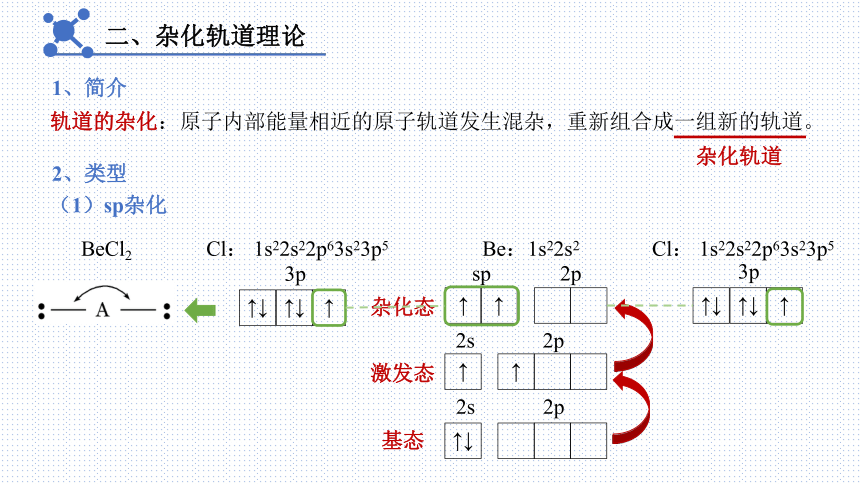
二、杂化轨道理论
1、简介
轨道的杂化:原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道。
杂化轨道
2、类型
(1)sp杂化
BeCl2
Be:1s22s2
Cl: 1s22s22p63s23p5
↑↓
2s
2p
↑↓
3p
↑↓
↑
Cl: 1s22s22p63s23p5
↑↓
3p
↑↓
↑
基态
激发态
↑
↑
杂化态
↑
↑
2s
2p
sp
2p
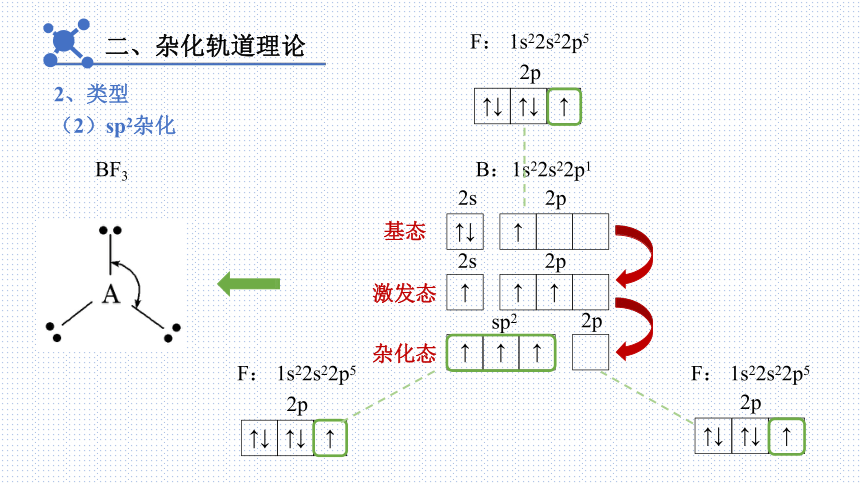
二、杂化轨道理论
2、类型
(2)sp2杂化
BF3
B:1s22s22p1
F: 1s22s22p5
↑↓
2s
↑
2p
↑↓
2p
↑↓
↑
F: 1s22s22p5
↑↓
2p
↑↓
↑
基态
激发态
↑
↑
↑
杂化态
↑
↑
↑
2s
2p
sp2
2p
F: 1s22s22p5
↑↓
2p
↑↓
↑
二、杂化轨道理论
2、类型
(3)sp3杂化
CH4
C:1s22s22p2
↑↓
2s
↑
2p
↑
基态
激发态
↑
↑
↑
↑
杂化态
↑
↑
↑
↑
2s
2p
sp3
H: 1s1
↑
1s
H: 1s1
↑
1s
H: 1s1
↑
1s
H: 1s1
↑
1s
注:
二、杂化轨道理论
a. 双原子分子,孤立的原子不存在杂化;
b. 只有能量相近的轨道才能杂化;
c. 杂化过程中,原子轨道数目不变;
d. 杂化过程中,原子轨道的形状会发生改变,杂化后,杂化轨道的能量和形状均相同;
e. 杂化轨道只用于形成σ键/容纳未参与成键的孤电子对;
杂化轨道数 = 与中心原子结合的原子数 + 中心原子的孤电子对数
f. 未参与杂化的p轨道用于形成 π 键。
3、分子的立体构型与键角、杂化轨道的关系
二、杂化轨道理论
立体构型 键角 实例 杂化轨道类型
正四面体形
109°28′
CH4、CCl4
平面三角形
120°
SO3、BF3
三角锥形
107°
NH3
V形
105°
H2O
直线形
180°
C2H2、CO2、CS2
sp3杂化
sp2杂化
sp杂化
斥力大小顺序:孤电子对-孤电子对>孤电子对-σ键电子对>σ键电子对-σ键电子对
4、以C原子为中心原子的分子中碳原子的杂化类型
二、杂化轨道理论
a. 四个键都是单键,为sp3杂化。CH4、CCl4;
σ键的数目 = 杂化轨道的数目
b. 有一个双键,即一个π键,为sp2杂化。CH2==CH2、HCHO、苯(大π键);
c. 有两个双键或一个三键,即两个π键,为sp杂化。 CHCH 、 O == C == O 、S == C == S 。
课堂练习
A
1.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是 ( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
课堂练习
AD
2、三氯化磷分子中的中心原子以sp3杂化,下列有关叙述正确的是
( ) 双选
A.3个P—Cl键长、键角均相等
B.空间构型为平面三角形
C.空间构型为正四面体
D.空间构型为三角锥形
1、配位键
三、配合物理论
A → B
提供孤电子对
接受孤电子对
给予体
接受体
电子对给予接受键
说明:
a. 配位键是一种特殊的共价键;
b.
CO
C O
—
—
←
2、配合物
三、配合物理论
(1)概念:
金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。
(2)组成:
[Co(NH3)6]Cl3
中心离子
配位原子
配体
配位数
内界
外界
中心原子(或离子):提供空轨道接受孤电子对;
配体:提供孤电子对的分子或离子,
阴离子:X-、OH-、SCN-,中性分子:H2O、NH3、CO;
配位数:同中心原子(或离子)配位的原子数目。
在水中电离成外界和内界两个部分
2、配合物
三、配合物理论
(3)配合物的形成举例:
实验操作 实验现象 有关离子方程式
氨水
CuSO4溶液
乙醇
滴加氨水后,试管中先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液,向溶液中滴加乙醇后析出深蓝色晶体
Cu2+ + 2NH3·H2O === Cu(OH)2↓ + 2
Cu(OH)2 + 4NH3 === [Cu(NH3)4]2+ + 2
蓝色沉淀
深蓝色溶液
2、配合物
三、配合物理论
(3)配合物的形成举例:
实验操作 实验现象 有关离子方程式
KSCN溶液
FeCl3溶液
溶液变为红色
Fe3+ + 3SCN- === Fe(SCN)3
2、配合物
三、配合物理论
(3)配合物的形成举例:
实验操作 实验现象 有关离子方程式
氨水
AgNO3溶液
滴加氨水后,试管中先出现白色沉淀,氨水过量后,白色沉淀消失,溶液变为无色
Ag+ + NH3·H2O === AgOH↓ +
AgOH + 2NH3 === [Ag(NH3)2]+ +
三、配合物理论
气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间的成键关系如下图所示。请将图中你认为是配位键的斜线加上箭头。
第二章 分子结构与性质
2.2 分子的立体构型
2021-2022学年高二化学同步课件(人教版选修3)★★
一、价层电子对互斥理论
1、内容
分子的立体构型是“价层电子对”相互排斥的结果。
价层电子对 = σ键电子对 + 中心原子的孤电子对。
由分子式确定
(a - xb)
H2O、NH3
中心原子的价电子数
中心原子结合的原子数
中心原子结合的原子最多能接受的电子数
H:1
其他原子:8-价电子数
2、计算
分子或离子 中心原子 a x b 中心原子上的孤电子对数
SO2
NH3
S
N
N
C
6
5
4
6
阳离子/阴离子
2
3
4
3
2
1
1
2
1
1
0
0
一、价层电子对互斥理论
中心原子的价层电子对数
3、判断分子立体构型
价层电子对互斥理论
VSEPR模型
略去孤电子对
分子的立体构型
分子 σ键电子对数 孤电子对数 价层电子对数 价层电子对排列方式 VSEPR 模型名称 立体构型名称
BeCl2、CO2、SiO2
BF33、
PbCl2、SO2、O3
2
0
2
直线形
直线形
3
0
3
平面三角形
平面三角形
2
1
V形
一、价层电子对互斥理论
中心原子的价层电子对数
3、判断分子立体构型
价层电子对互斥理论
VSEPR模型
略去孤电子对
分子的立体构型
分子 σ键电子对数 孤电子对数 价层电子对数 价层电子对排列方式 VSEPR 模型名称 立体构型名称
CCl4、CH4
NH3、NF3
H2O、
4
0
4
四面体形
正四面体形
3
1
三角锥形
2
2
V形
4、分子的立体构型与键角
一、价层电子对互斥理论
立体构型 键角 实例
正四面体形
109°28′
60°
CH4、CCl4
P4、N4
平面三角形
120°
SO3、BF3
三角锥形
107°
NH3
V形
105°
H2O
直线形
180°
C2H2、CO2、CS2
二、杂化轨道理论
1、简介
轨道的杂化:原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道。
杂化轨道
2、类型
(1)sp杂化
BeCl2
Be:1s22s2
Cl: 1s22s22p63s23p5
↑↓
2s
2p
↑↓
3p
↑↓
↑
Cl: 1s22s22p63s23p5
↑↓
3p
↑↓
↑
基态
激发态
↑
↑
杂化态
↑
↑
2s
2p
sp
2p
二、杂化轨道理论
2、类型
(2)sp2杂化
BF3
B:1s22s22p1
F: 1s22s22p5
↑↓
2s
↑
2p
↑↓
2p
↑↓
↑
F: 1s22s22p5
↑↓
2p
↑↓
↑
基态
激发态
↑
↑
↑
杂化态
↑
↑
↑
2s
2p
sp2
2p
F: 1s22s22p5
↑↓
2p
↑↓
↑
二、杂化轨道理论
2、类型
(3)sp3杂化
CH4
C:1s22s22p2
↑↓
2s
↑
2p
↑
基态
激发态
↑
↑
↑
↑
杂化态
↑
↑
↑
↑
2s
2p
sp3
H: 1s1
↑
1s
H: 1s1
↑
1s
H: 1s1
↑
1s
H: 1s1
↑
1s
注:
二、杂化轨道理论
a. 双原子分子,孤立的原子不存在杂化;
b. 只有能量相近的轨道才能杂化;
c. 杂化过程中,原子轨道数目不变;
d. 杂化过程中,原子轨道的形状会发生改变,杂化后,杂化轨道的能量和形状均相同;
e. 杂化轨道只用于形成σ键/容纳未参与成键的孤电子对;
杂化轨道数 = 与中心原子结合的原子数 + 中心原子的孤电子对数
f. 未参与杂化的p轨道用于形成 π 键。
3、分子的立体构型与键角、杂化轨道的关系
二、杂化轨道理论
立体构型 键角 实例 杂化轨道类型
正四面体形
109°28′
CH4、CCl4
平面三角形
120°
SO3、BF3
三角锥形
107°
NH3
V形
105°
H2O
直线形
180°
C2H2、CO2、CS2
sp3杂化
sp2杂化
sp杂化
斥力大小顺序:孤电子对-孤电子对>孤电子对-σ键电子对>σ键电子对-σ键电子对
4、以C原子为中心原子的分子中碳原子的杂化类型
二、杂化轨道理论
a. 四个键都是单键,为sp3杂化。CH4、CCl4;
σ键的数目 = 杂化轨道的数目
b. 有一个双键,即一个π键,为sp2杂化。CH2==CH2、HCHO、苯(大π键);
c. 有两个双键或一个三键,即两个π键,为sp杂化。 CHCH 、 O == C == O 、S == C == S 。
课堂练习
A
1.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是 ( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
课堂练习
AD
2、三氯化磷分子中的中心原子以sp3杂化,下列有关叙述正确的是
( ) 双选
A.3个P—Cl键长、键角均相等
B.空间构型为平面三角形
C.空间构型为正四面体
D.空间构型为三角锥形
1、配位键
三、配合物理论
A → B
提供孤电子对
接受孤电子对
给予体
接受体
电子对给予接受键
说明:
a. 配位键是一种特殊的共价键;
b.
CO
C O
—
—
←
2、配合物
三、配合物理论
(1)概念:
金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。
(2)组成:
[Co(NH3)6]Cl3
中心离子
配位原子
配体
配位数
内界
外界
中心原子(或离子):提供空轨道接受孤电子对;
配体:提供孤电子对的分子或离子,
阴离子:X-、OH-、SCN-,中性分子:H2O、NH3、CO;
配位数:同中心原子(或离子)配位的原子数目。
在水中电离成外界和内界两个部分
2、配合物
三、配合物理论
(3)配合物的形成举例:
实验操作 实验现象 有关离子方程式
氨水
CuSO4溶液
乙醇
滴加氨水后,试管中先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液,向溶液中滴加乙醇后析出深蓝色晶体
Cu2+ + 2NH3·H2O === Cu(OH)2↓ + 2
Cu(OH)2 + 4NH3 === [Cu(NH3)4]2+ + 2
蓝色沉淀
深蓝色溶液
2、配合物
三、配合物理论
(3)配合物的形成举例:
实验操作 实验现象 有关离子方程式
KSCN溶液
FeCl3溶液
溶液变为红色
Fe3+ + 3SCN- === Fe(SCN)3
2、配合物
三、配合物理论
(3)配合物的形成举例:
实验操作 实验现象 有关离子方程式
氨水
AgNO3溶液
滴加氨水后,试管中先出现白色沉淀,氨水过量后,白色沉淀消失,溶液变为无色
Ag+ + NH3·H2O === AgOH↓ +
AgOH + 2NH3 === [Ag(NH3)2]+ +
三、配合物理论
气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间的成键关系如下图所示。请将图中你认为是配位键的斜线加上箭头。
