2021-2022学年高二化学同步课件(人教版选修3)1.2 原子结构与元素的性质
文档属性
| 名称 | 2021-2022学年高二化学同步课件(人教版选修3)1.2 原子结构与元素的性质 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 15:52:02 | ||
图片预览


文档简介
(共29张PPT)
第一章 原子结构与性质
1.2 原子的结构与元素的性质
2021-2022学年高二化学同步课件(人教版选修3)★★
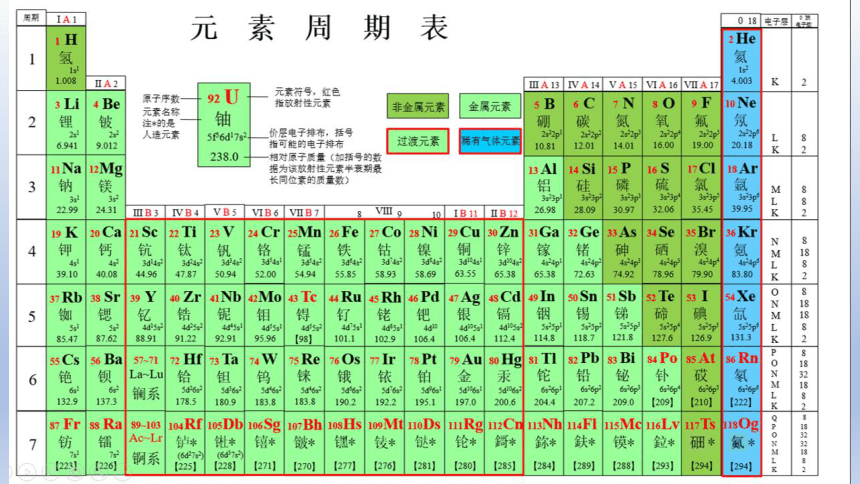
一、原子结构与元素周期表
一、原子结构与元素周期表
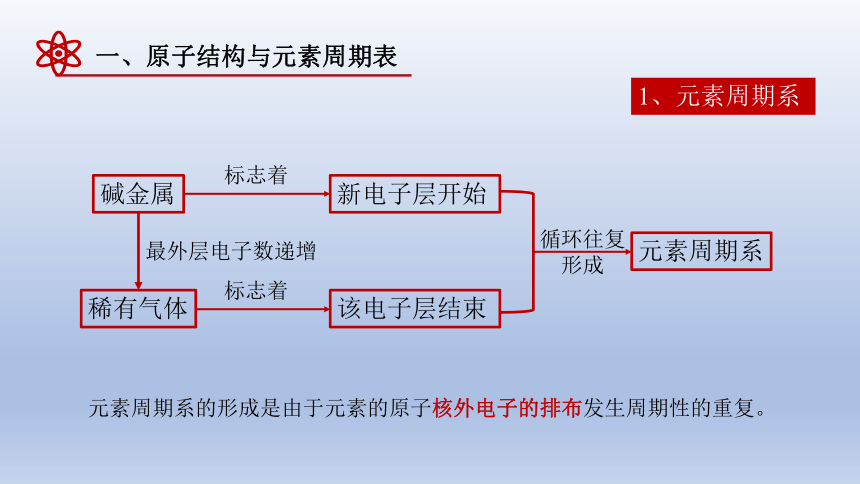
1、元素周期系
碱金属
稀有气体
最外层电子数递增
新电子层开始
该电子层结束
标志着
标志着
循环往复形成
元素周期系
元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复。
一、原子结构与元素周期表
1、元素周期系
一、原子结构与元素周期表
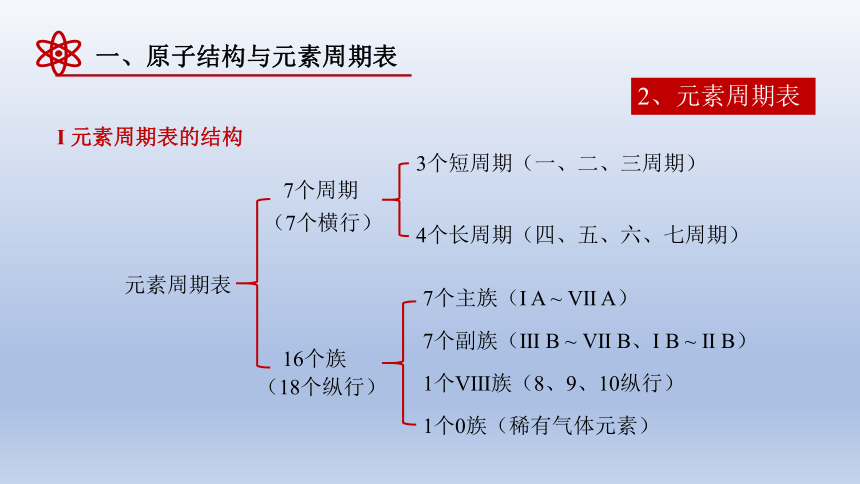
2、元素周期表
Ι 元素周期表的结构
元素周期表
7个周期
16个族
(7个横行)
(18个纵行)
3个短周期(一、二、三周期)
4个长周期(四、五、六、七周期)
7个主族(Ι A ~ Ⅶ A)
7个副族(Ⅲ B ~ Ⅶ B、Ι B ~ Ⅱ B)
1个Ⅷ族(8、9、10纵行)
1个0族(稀有气体元素)
一、原子结构与元素周期表
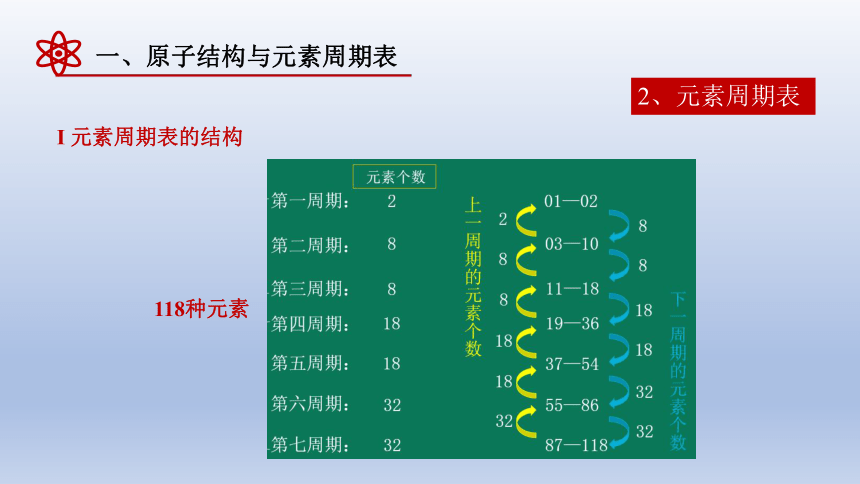
2、元素周期表
Ι 元素周期表的结构
118种元素
一、原子结构与元素周期表
2、元素周期表
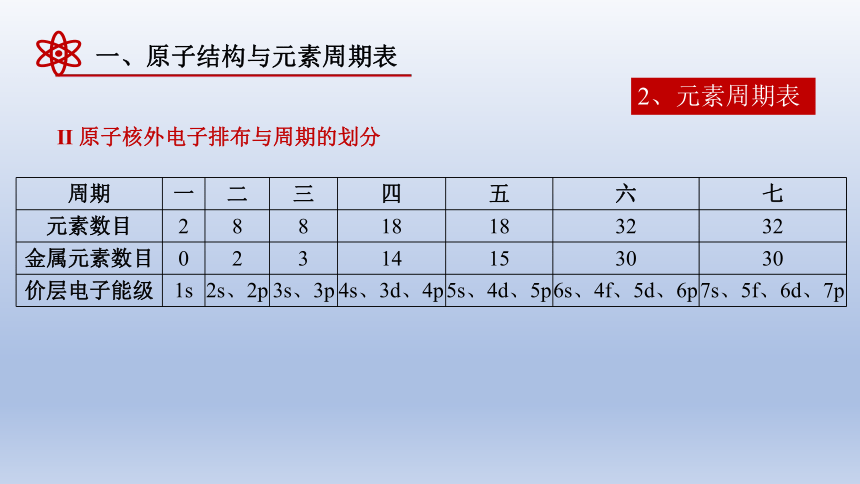
Ⅱ 原子核外电子排布与周期的划分
周期 一 二 三 四 五 六 七
元素数目 2 8 8 18 18 32 32
金属元素数目 0 2 3 14 15 30 30
价层电子能级
1s
2s、2p
3s、3p
4s、3d、4p
5s、4d、5p
6s、4f、5d、6p
7s、5f、6d、7p
一、原子结构与元素周期表
2、元素周期表
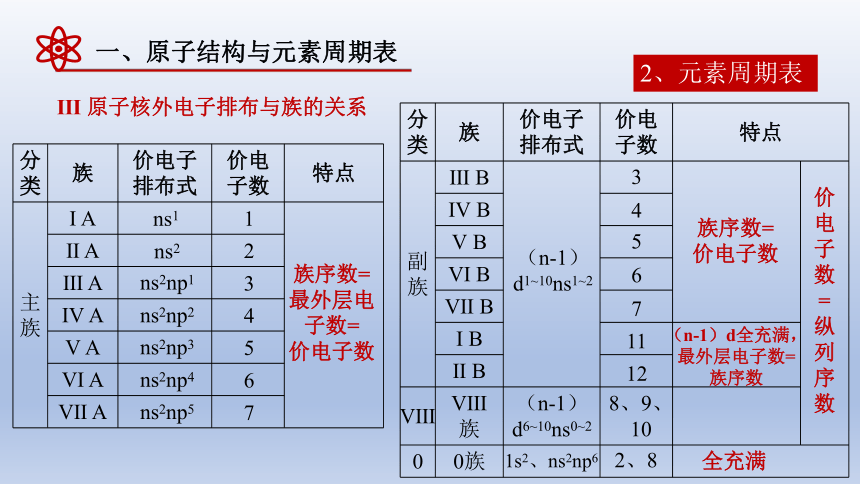
Ⅲ 原子核外电子排布与族的关系
分类 族 价电子排布式 价电子数 特点
主族 Ι A
Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
1
2
3
4
5
6
7
族序数=
最外层电子数=
价电子数
分类 族 价电子排布式 价电子数 特点 副族 Ⅲ B
Ⅳ B Ⅴ B Ⅵ B Ⅶ B Ι B Ⅱ B Ⅷ Ⅷ 族 0 0族 (n-1)d1~10ns1~2
3
4
5
6
7
11
12
8、9、10
2、8
(n-1)d6~10ns0~2
1s2、ns2np6
族序数=
价电子数
(n-1)d全充满,
全充满
最外层电子数=族序数
价电子数=纵列序数
一、原子结构与元素周期表
2、元素周期表
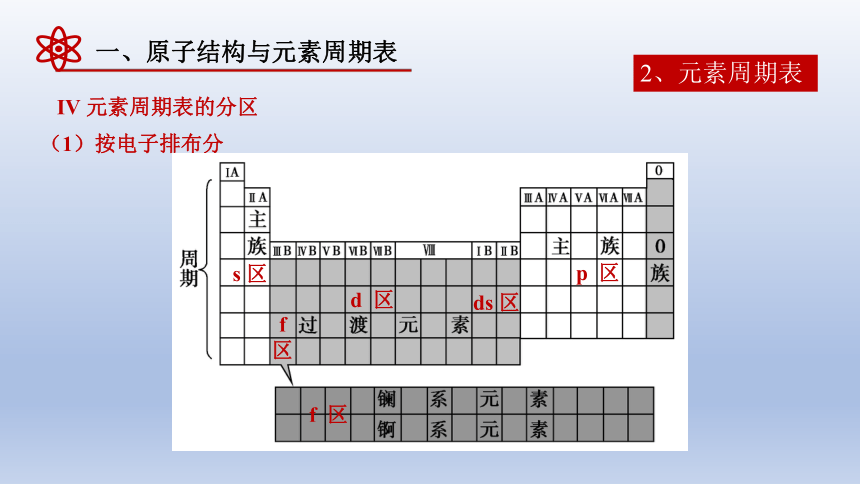
Ⅳ 元素周期表的分区
(1)按电子排布分
s 区
f 区
f 区
d 区
ds 区
p 区
一、原子结构与元素周期表
2、元素周期表
Ⅳ 元素周期表的分区
(1)按电子排布分
分区 元素位置 价电子排布式
s区
p区
d区
ds区
f区
Ι A族、Ⅱ A族
Ⅲ A ~ Ⅶ A族、0族
Ⅲ B ~ Ⅶ B族(除镧系和锕系)、Ⅷ族
Ι B族、Ⅱ B族
镧系和锕系
ns1~2
ns2np1~6
(He除外)
(n-1)d1~9ns1~2
(钯除外)
(n-1)d10ns1~2
(n-2)f0~14(n-1)d0~2ns2
一、原子结构与元素周期表
2、元素周期表
Ⅳ 元素周期表的分区
(2)按金属、非金属在周期表中的位置分
交界处:
半金属/准金属
半导体
课堂练习
B
课堂练习
B
C
课堂练习
4、指出下列元素是主族元素还是副族元素,在周期表中的位置是什么?
(1)1s22s22p63s2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(2)[Kr]4d105s25p2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(3)[Ar]3d14s2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(4)[Ar]3d104s1是________族元素,位于周期表中第________周期第________族,属于________区元素。
主
主
副
副
三
五
四
四
Ⅱ A
Ⅳ A
Ⅲ B
Ι B
s
p
d
ds
二、元素周期律
1、原子半径
原子半径
电子的能层数
核电荷数
能层越多,电子之间的负电排斥使原子半径增大
核电荷数越大,核对电子的引力越大,使原子半径缩小
二、元素周期律
1、原子半径
电子
能层数
增大
不变
增大
减小
二、元素周期律
1、原子半径
思考感悟
是否电子的能层数多的元素的原子半径一定大于电子的能层数小的元素的原子半径?
【提示】不一定,如碱金属元素的原子半径比它下一周期卤素原子的半径大。
二、元素周期律
2、电离能
Ι 第一电离能
(1)含义
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。
(2)变化规律
Ι1 kJ/mol
二、元素周期律
2、电离能
二、元素周期律
2、电离能
Ι 第一电离能
(1)含义
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。
(2)变化规律
a. 同一周期从左到右, Ι1逐渐增大。碱金属元素最小,稀有气体最大;
b. 同一主族从上到下, Ι1逐渐减小。
c. 同一周期,第Ⅱ A族和第Ⅴ A族的元素价电子排布为ns2和ns2np3,p轨道为全空和半满的状态,所以 Ι1 比相邻元素大。
Ι1 kJ/mol
二、元素周期律
2、电离能
Ⅱ 逐级电离能
(1)含义
原子的+1价气态基态正离子再失去1个电子所需要的最低能量叫做第二电离能。
(2)变化规律
M(g) === M+ + e- Ι1 (第一电离能 )
M+(g) === M2 +(g) + e- Ι2 (第二电离能 )
M2+(g) === M3 +(g) + e- Ι3 (第三电离能 )
二、元素周期律
2、电离能
Ⅱ 逐级电离能
元素 电离能 Na Mg Al
I1 496 738 578
I2 4562 1451 1817
I3 6912 7733 2745
I4 9543 10540 11575
二、元素周期律
2、电离能
Ⅱ 逐级电离能
(1)含义
原子的+1价气态基态正离子再失去1个电子所需要的最低能量叫做第二电离能。
(2)变化规律
M(g) === M+ + e- Ι1 (第一电离能 )
M+(g) === M2 +(g) + e- Ι2 (第二电离能 )
M2+(g) === M3 +(g) + e- Ι3 (第三电离能 )
同一元素:逐级电离能在逐渐增大 Ι1< Ι2 < Ι3,
在增大的过程中会发生突变。
二、元素周期律
3、电负性
(1)含义:用来描述不同元素的原子对键合电子吸引力的大小。
电负性越大,对键合电子的吸引力越大。
(2)衡量标准:F 4.0
F:电负性最大、
Cs:电负性最小
二、元素周期律
3、电负性
(3)应用:
a. 判断金属性、非金属性强弱
金属:小于1.8,
电负性越大,金属性越弱
非金属:大于1.8,
电负性越大,非金属性越强
类金属:1.8左右
b. 判断化合物的类型
大于1.7,离子键,离子化合物
小于1.7,共价键,共价化合物
成键元素
电负性差值
例外:HF,1.9
例外:NaH,1.2
二、元素周期律
3、电负性
(3)应用:
c. 判断化合物中元素化合价的正负
电负性较大的,负化合价
d. 对角线规则
电负性较小的,正化合价
Be和Al的单质、氧化物、氢氧化物:
两性,可以和强酸强碱反应
Be —— BeO —— Be(OH)2 —— Na2BeO2
Al —— Al2O3 —— Al(OH)3 —— NaAlO2
稀有气体元素
二、元素周期律
小结
原子半径变大
原子半径变小
金属性/失电子能力增强,I1减小,电负性减小
非金属性/得电子能力增强, I1增大,电负性增大
课堂练习
1、下列关于粒子半径大小关系的判断不正确的是( )
①r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)
②r(F-)<r(Cl-)<r(Br-)<r(I-)
③r(Na+)<r(Mg2+)<r(Al3+)<r(F-)<r(O2-)
④r(Fe3+)>r(Fe2+)>r(Fe)
A.②③④ B.①④
C.③④ D.①②③
C
课堂练习
B
2、下列各元素的电负性按由大到小的顺序排列正确的是( )
A.K>Na>Li B.F>O>S
C.As>P>N D.C>N>O
第一章 原子结构与性质
1.2 原子的结构与元素的性质
2021-2022学年高二化学同步课件(人教版选修3)★★
一、原子结构与元素周期表
一、原子结构与元素周期表
1、元素周期系
碱金属
稀有气体
最外层电子数递增
新电子层开始
该电子层结束
标志着
标志着
循环往复形成
元素周期系
元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复。
一、原子结构与元素周期表
1、元素周期系
一、原子结构与元素周期表
2、元素周期表
Ι 元素周期表的结构
元素周期表
7个周期
16个族
(7个横行)
(18个纵行)
3个短周期(一、二、三周期)
4个长周期(四、五、六、七周期)
7个主族(Ι A ~ Ⅶ A)
7个副族(Ⅲ B ~ Ⅶ B、Ι B ~ Ⅱ B)
1个Ⅷ族(8、9、10纵行)
1个0族(稀有气体元素)
一、原子结构与元素周期表
2、元素周期表
Ι 元素周期表的结构
118种元素
一、原子结构与元素周期表
2、元素周期表
Ⅱ 原子核外电子排布与周期的划分
周期 一 二 三 四 五 六 七
元素数目 2 8 8 18 18 32 32
金属元素数目 0 2 3 14 15 30 30
价层电子能级
1s
2s、2p
3s、3p
4s、3d、4p
5s、4d、5p
6s、4f、5d、6p
7s、5f、6d、7p
一、原子结构与元素周期表
2、元素周期表
Ⅲ 原子核外电子排布与族的关系
分类 族 价电子排布式 价电子数 特点
主族 Ι A
Ⅱ A Ⅲ A Ⅳ A Ⅴ A Ⅵ A Ⅶ A ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
1
2
3
4
5
6
7
族序数=
最外层电子数=
价电子数
分类 族 价电子排布式 价电子数 特点 副族 Ⅲ B
Ⅳ B Ⅴ B Ⅵ B Ⅶ B Ι B Ⅱ B Ⅷ Ⅷ 族 0 0族 (n-1)d1~10ns1~2
3
4
5
6
7
11
12
8、9、10
2、8
(n-1)d6~10ns0~2
1s2、ns2np6
族序数=
价电子数
(n-1)d全充满,
全充满
最外层电子数=族序数
价电子数=纵列序数
一、原子结构与元素周期表
2、元素周期表
Ⅳ 元素周期表的分区
(1)按电子排布分
s 区
f 区
f 区
d 区
ds 区
p 区
一、原子结构与元素周期表
2、元素周期表
Ⅳ 元素周期表的分区
(1)按电子排布分
分区 元素位置 价电子排布式
s区
p区
d区
ds区
f区
Ι A族、Ⅱ A族
Ⅲ A ~ Ⅶ A族、0族
Ⅲ B ~ Ⅶ B族(除镧系和锕系)、Ⅷ族
Ι B族、Ⅱ B族
镧系和锕系
ns1~2
ns2np1~6
(He除外)
(n-1)d1~9ns1~2
(钯除外)
(n-1)d10ns1~2
(n-2)f0~14(n-1)d0~2ns2
一、原子结构与元素周期表
2、元素周期表
Ⅳ 元素周期表的分区
(2)按金属、非金属在周期表中的位置分
交界处:
半金属/准金属
半导体
课堂练习
B
课堂练习
B
C
课堂练习
4、指出下列元素是主族元素还是副族元素,在周期表中的位置是什么?
(1)1s22s22p63s2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(2)[Kr]4d105s25p2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(3)[Ar]3d14s2是________族元素,位于周期表中第________周期第________族,属于________区元素;
(4)[Ar]3d104s1是________族元素,位于周期表中第________周期第________族,属于________区元素。
主
主
副
副
三
五
四
四
Ⅱ A
Ⅳ A
Ⅲ B
Ι B
s
p
d
ds
二、元素周期律
1、原子半径
原子半径
电子的能层数
核电荷数
能层越多,电子之间的负电排斥使原子半径增大
核电荷数越大,核对电子的引力越大,使原子半径缩小
二、元素周期律
1、原子半径
电子
能层数
增大
不变
增大
减小
二、元素周期律
1、原子半径
思考感悟
是否电子的能层数多的元素的原子半径一定大于电子的能层数小的元素的原子半径?
【提示】不一定,如碱金属元素的原子半径比它下一周期卤素原子的半径大。
二、元素周期律
2、电离能
Ι 第一电离能
(1)含义
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。
(2)变化规律
Ι1 kJ/mol
二、元素周期律
2、电离能
二、元素周期律
2、电离能
Ι 第一电离能
(1)含义
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。
(2)变化规律
a. 同一周期从左到右, Ι1逐渐增大。碱金属元素最小,稀有气体最大;
b. 同一主族从上到下, Ι1逐渐减小。
c. 同一周期,第Ⅱ A族和第Ⅴ A族的元素价电子排布为ns2和ns2np3,p轨道为全空和半满的状态,所以 Ι1 比相邻元素大。
Ι1 kJ/mol
二、元素周期律
2、电离能
Ⅱ 逐级电离能
(1)含义
原子的+1价气态基态正离子再失去1个电子所需要的最低能量叫做第二电离能。
(2)变化规律
M(g) === M+ + e- Ι1 (第一电离能 )
M+(g) === M2 +(g) + e- Ι2 (第二电离能 )
M2+(g) === M3 +(g) + e- Ι3 (第三电离能 )
二、元素周期律
2、电离能
Ⅱ 逐级电离能
元素 电离能 Na Mg Al
I1 496 738 578
I2 4562 1451 1817
I3 6912 7733 2745
I4 9543 10540 11575
二、元素周期律
2、电离能
Ⅱ 逐级电离能
(1)含义
原子的+1价气态基态正离子再失去1个电子所需要的最低能量叫做第二电离能。
(2)变化规律
M(g) === M+ + e- Ι1 (第一电离能 )
M+(g) === M2 +(g) + e- Ι2 (第二电离能 )
M2+(g) === M3 +(g) + e- Ι3 (第三电离能 )
同一元素:逐级电离能在逐渐增大 Ι1< Ι2 < Ι3,
在增大的过程中会发生突变。
二、元素周期律
3、电负性
(1)含义:用来描述不同元素的原子对键合电子吸引力的大小。
电负性越大,对键合电子的吸引力越大。
(2)衡量标准:F 4.0
F:电负性最大、
Cs:电负性最小
二、元素周期律
3、电负性
(3)应用:
a. 判断金属性、非金属性强弱
金属:小于1.8,
电负性越大,金属性越弱
非金属:大于1.8,
电负性越大,非金属性越强
类金属:1.8左右
b. 判断化合物的类型
大于1.7,离子键,离子化合物
小于1.7,共价键,共价化合物
成键元素
电负性差值
例外:HF,1.9
例外:NaH,1.2
二、元素周期律
3、电负性
(3)应用:
c. 判断化合物中元素化合价的正负
电负性较大的,负化合价
d. 对角线规则
电负性较小的,正化合价
Be和Al的单质、氧化物、氢氧化物:
两性,可以和强酸强碱反应
Be —— BeO —— Be(OH)2 —— Na2BeO2
Al —— Al2O3 —— Al(OH)3 —— NaAlO2
稀有气体元素
二、元素周期律
小结
原子半径变大
原子半径变小
金属性/失电子能力增强,I1减小,电负性减小
非金属性/得电子能力增强, I1增大,电负性增大
课堂练习
1、下列关于粒子半径大小关系的判断不正确的是( )
①r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)
②r(F-)<r(Cl-)<r(Br-)<r(I-)
③r(Na+)<r(Mg2+)<r(Al3+)<r(F-)<r(O2-)
④r(Fe3+)>r(Fe2+)>r(Fe)
A.②③④ B.①④
C.③④ D.①②③
C
课堂练习
B
2、下列各元素的电负性按由大到小的顺序排列正确的是( )
A.K>Na>Li B.F>O>S
C.As>P>N D.C>N>O
