江苏省泰州市第二中学2012-2013学年高二学业水平测试模拟考试化学(必修)试题(无答案)
文档属性
| 名称 | 江苏省泰州市第二中学2012-2013学年高二学业水平测试模拟考试化学(必修)试题(无答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 133.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-06 00:00:00 | ||
图片预览


文档简介
江苏省2013年高二年级学业水平测试摸底考试
化 学 试 题
说明:考试时间: 75分钟 满分100分
本卷可能用到的相对原子质量 H:1 O:16 N:14 Cl:35.5
K:39 Mn:55 S:32 Ba:137 C:12
第I卷(选择题,共69分)
一、本大题共23题,每题3分,共69分。在每题的四个选项中,只有1个选项符合要求。
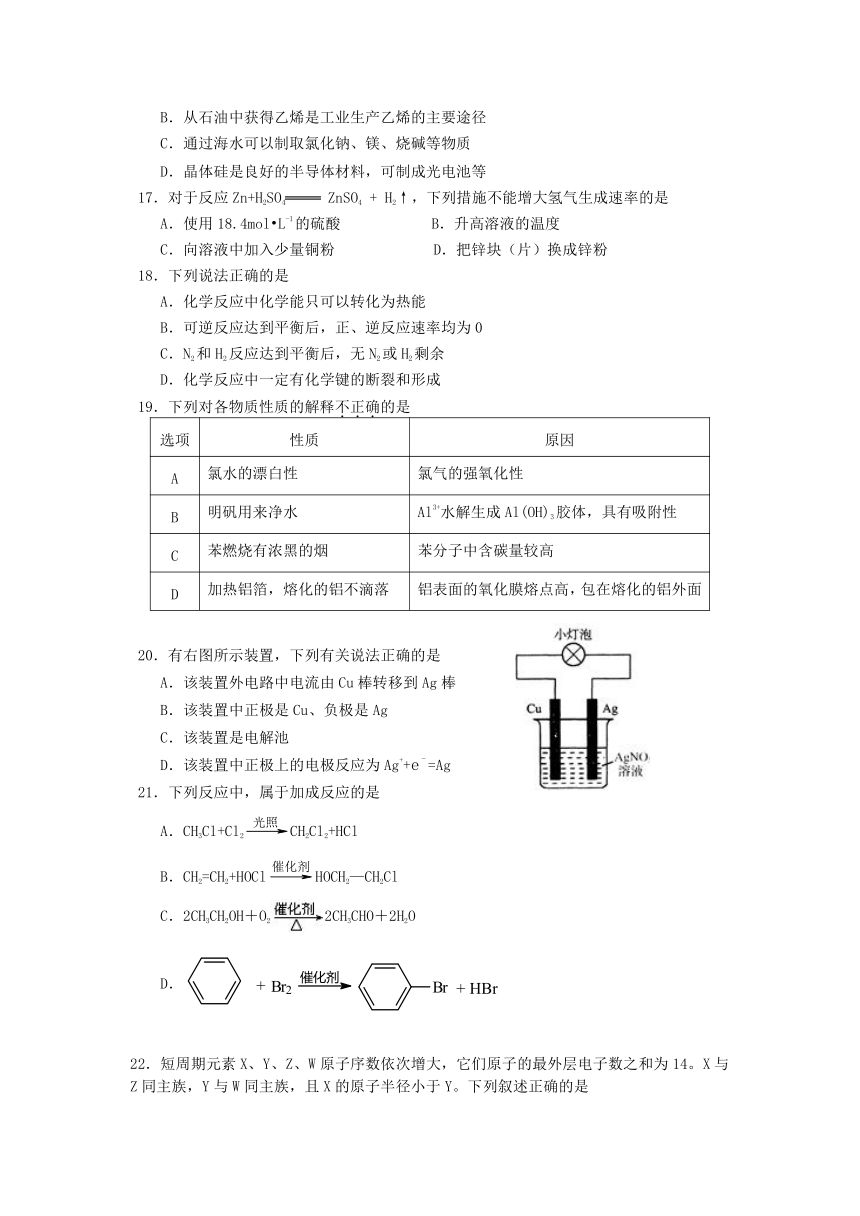
1.下列环境问题不是汽车尾气造成的是
A.酸雨 B.臭氧层空洞 C.光化学烟雾 D.白色污染
2.下列说法中不正确的是
A.二氧化硫气体能用浓硫酸来干燥
B.胶体区别于其他分散系的本质特征是分散质粒子的直径不同
C.砖瓦、玻璃、水泥和石灰石的主要成分都属于硅酸盐
D.氨水、铵盐受热都易发生化学变化
3.下列变化过程中,没有破坏化学键的是
A.氯化钠的熔化 B.碳的燃烧 C.氮气溶于水 D.水的通电分解
4.美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如右下图所示),每
辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有
机分子。下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.“纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C.C60是一种新型的化合物
D.C60与金刚石互为同分异构体
5.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),想一想
可能观察到的现象是
A.钠浮在试管中的液面上 B.钠沉入试管底部
C.钠燃烧起来 D.钠处于煤油和水的交界处
6.下列叙述正确的是
A.乙烯的结构简式为:CH2CH2 B.氮分子的结构式为:
C.氯化氢分子的电子式为: D.硫离子的结构示意图为:
7.下列五种有色溶液与SO2作用均能褪色,其实质相同的是:①品红溶液;②酸性KMnO4
溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液
A. ①④ B. ①②③ C.②③⑤ D .③④
8.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。
要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为 A.15mL B.20mL C.60mL D.80mL
9.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、Fe2+、Cl-、NO3- B.Na+、Cu2+、、
C.Mg2+、Na+、、Cl- D.Ba2+、、、K+
10.以下物质间的每步转化通过一步反应能实现的是
A.Al → Al2O3→ Al(OH)3 → NaAlO2 B.Si → SiO2 → H2SiO3? → Na2SiO3
C.N2 → NO→ NO2 → HNO3 D.S → SO3 → H2SO4 → MgSO4
11.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,48gO3和O2的混合气体中含有的氧原子数为3NA
B.1.8g的离子中含有的电子数为0.1NA
C.物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+
D.标准状况下,22.4L的CCl4含有4NA个氯原子
12.下列离子方程式书写正确的是
A.氢氧化钡溶液与稀硫酸反应:Ba2++OH―+H++SO42―=BaSO4↓+H2O
B.铁与硫酸铁溶液反应:Fe+Fe3+=2Fe2+
C.用食醋溶解热水瓶中的水垢:CaCO3+2CH3COOH=Ca2++2CH3COO―+2H2O
D.碳酸氢钠溶液中滴入氢氧化钠溶液:OH―+= H2O+CO2↑
13.对于反应MnO2 + 4HCl(浓)MnCl2 + 2H2O + Cl 2↑,下列说法不正确的是
A.该反应是氧化还原反应 B.MnO2是氧化剂
C.HCl是还原剂 D.若生成7.1 g Cl2,则转移0.1 mol电子
14.实验是化学研究的基础。对下列实验现象的描述错误的是
①
②
③
④
A.实验①烧杯中的澄清石灰水都变浑浊
B.实验②试管中出现砖红色沉淀
C.实验③品红溶液褪色
D.实验④气体由红棕色变为无色,试管中的液面上升
15.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是
A.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末加热,比较能否使澄清石灰水变浑浊
16.下列关于物质用途的叙述中不正确的是
A.工业上利用蛋白质的水解反应生产肥皂和甘油
B.从石油中获得乙烯是工业生产乙烯的主要途径
C.通过海水可以制取氯化钠、镁、烧碱等物质
D.晶体硅是良好的半导体材料,可制成光电池等
17.对于反应Zn+H2SO4 ZnSO4 + H2↑,下列措施不能增大氢气生成速率的是
A.使用18.4mol?L-1的硫酸 B.升高溶液的温度
C.向溶液中加入少量铜粉 D.把锌块(片)换成锌粉
18.下列说法正确的是
A.化学反应中化学能只可以转化为热能
B.可逆反应达到平衡后,正、逆反应速率均为0
C.N 2和H2反应达到平衡后,无N 2或H2剩余
D.化学反应中一定有化学键的断裂和形成
19.下列对各物质性质的解释不正确的是
选项
性质
原因
A
氯水的漂白性
氯气的强氧化性
B
明矾用来净水
Al3+水解生成Al(OH)3胶体,具有吸附性
C
苯燃烧有浓黑的烟
苯分子中含碳量较高
D
加热铝箔,熔化的铝不滴落
铝表面的氧化膜熔点高,包在熔化的铝外面
20.有右图所示装置,下列有关说法正确的是
A.该装置外电路中电流由Cu棒转移到Ag棒
B.该装置中正极是Cu、负极是Ag
C.该装置是电解池
D.该装置中正极上的电极反应为Ag++e-=Ag
21.下列反应中,属于加成反应的是
A.CH3Cl+Cl2CH2Cl2+HCl
B.CH2=CH2+HOClHOCH2—CH2Cl
C.2CH3CH2OH+O22CH3CHO+2H2O
D.
22.短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14。X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A.原子半径:YB.Z在化合物中呈+1价
C.Y与W可形成离子化合物
D.Z的单质不能与X的氧化物反应
23.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认
该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,
有白色沉淀、无剌激气味气体生成。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至
100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3
溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1
D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1
第Ⅱ卷(非选择题 共31分)
24.(15分)⑴随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成 (化学式),该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是 。
②维生素C也称抗坏血酸。血液中运载氧的血红蛋白中含有Fe2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是Fe3+,Fe3+不能被人体吸收。维生素C的主要摄入途径是 ,维生素C在抗坏血病方面的作用原理
是 。
⑵我国材料科学家师倡绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献、荣获2010年度国家最高科学技术奖。
①合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架。该合金中含量最高的金属为 (填元素符号)。
②铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式 ;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为 。
③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层 B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
⑶ ①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 。
②水中含有的悬浮颗粒物等杂质,可以加入 (填名称)等混凝剂进行净化处理,利用其溶解后形成的 具有吸附作用使水中的悬浮颗粒物沉降。
⑷我国采用食盐中加入碘酸钾(KIO3)的方法防止缺碘引起的疾病。在人体中,碘是属于 (选填“常量”或“微量”)元素;缺碘引起的疾病有 (写一种即可)。
25.(6分)在下图所示的物质转化关系中,A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
请回答下列问题:
(1)B的化学式为 。
(2)A的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
26.(10分)某氮肥硫酸铵中混有硫酸氢铵。为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用。已知:
氢氧化钠少量时 2NH4HSO4 + 2NaOH = (NH4)2SO4 + Na2SO4 + 2H2O
氢氧化钠过量时 NH4HSO4 + 2NaOH = Na2SO4 + NH3↑+ 2H2O
(1)同学们设计的实验装置图如下,请回答相关问题。
①装置中碱石灰的作用是 。
②广口瓶内四氯化碳的作用是 。
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,测得的样品含氮量仍将偏低,其原因可能是 。
(2)同学们改进实验装置后(改进装置图略),进行如下实验。
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液相混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量。部分实验数据如下:
氢氧化钠溶液体积/mL
40.00
样品质量/g
7.750
15.50
23.25
氨气质量/g
1.870
1.870
1.700
请计算(计算结果保留两位小数):
品中的氮元素的质量分数是 % 。
②所用氢氧化钠溶液的物质的量浓度为 mol/L。
③若样品质量为31.00g,则生成氨气的质量为 g。
化 学 试 题
说明:考试时间: 75分钟 满分100分
本卷可能用到的相对原子质量 H:1 O:16 N:14 Cl:35.5
K:39 Mn:55 S:32 Ba:137 C:12
第I卷(选择题,共69分)
一、本大题共23题,每题3分,共69分。在每题的四个选项中,只有1个选项符合要求。
1.下列环境问题不是汽车尾气造成的是
A.酸雨 B.臭氧层空洞 C.光化学烟雾 D.白色污染
2.下列说法中不正确的是
A.二氧化硫气体能用浓硫酸来干燥
B.胶体区别于其他分散系的本质特征是分散质粒子的直径不同
C.砖瓦、玻璃、水泥和石灰石的主要成分都属于硅酸盐
D.氨水、铵盐受热都易发生化学变化
3.下列变化过程中,没有破坏化学键的是
A.氯化钠的熔化 B.碳的燃烧 C.氮气溶于水 D.水的通电分解
4.美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如右下图所示),每
辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有
机分子。下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.“纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C.C60是一种新型的化合物
D.C60与金刚石互为同分异构体
5.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),想一想
可能观察到的现象是
A.钠浮在试管中的液面上 B.钠沉入试管底部
C.钠燃烧起来 D.钠处于煤油和水的交界处
6.下列叙述正确的是
A.乙烯的结构简式为:CH2CH2 B.氮分子的结构式为:
C.氯化氢分子的电子式为: D.硫离子的结构示意图为:
7.下列五种有色溶液与SO2作用均能褪色,其实质相同的是:①品红溶液;②酸性KMnO4
溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液
A. ①④ B. ①②③ C.②③⑤ D .③④
8.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。
要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为 A.15mL B.20mL C.60mL D.80mL
9.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、Fe2+、Cl-、NO3- B.Na+、Cu2+、、
C.Mg2+、Na+、、Cl- D.Ba2+、、、K+
10.以下物质间的每步转化通过一步反应能实现的是
A.Al → Al2O3→ Al(OH)3 → NaAlO2 B.Si → SiO2 → H2SiO3? → Na2SiO3
C.N2 → NO→ NO2 → HNO3 D.S → SO3 → H2SO4 → MgSO4
11.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,48gO3和O2的混合气体中含有的氧原子数为3NA
B.1.8g的离子中含有的电子数为0.1NA
C.物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+
D.标准状况下,22.4L的CCl4含有4NA个氯原子
12.下列离子方程式书写正确的是
A.氢氧化钡溶液与稀硫酸反应:Ba2++OH―+H++SO42―=BaSO4↓+H2O
B.铁与硫酸铁溶液反应:Fe+Fe3+=2Fe2+
C.用食醋溶解热水瓶中的水垢:CaCO3+2CH3COOH=Ca2++2CH3COO―+2H2O
D.碳酸氢钠溶液中滴入氢氧化钠溶液:OH―+= H2O+CO2↑
13.对于反应MnO2 + 4HCl(浓)MnCl2 + 2H2O + Cl 2↑,下列说法不正确的是
A.该反应是氧化还原反应 B.MnO2是氧化剂
C.HCl是还原剂 D.若生成7.1 g Cl2,则转移0.1 mol电子
14.实验是化学研究的基础。对下列实验现象的描述错误的是
①
②
③
④
A.实验①烧杯中的澄清石灰水都变浑浊
B.实验②试管中出现砖红色沉淀
C.实验③品红溶液褪色
D.实验④气体由红棕色变为无色,试管中的液面上升
15.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是
A.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末加热,比较能否使澄清石灰水变浑浊
16.下列关于物质用途的叙述中不正确的是
A.工业上利用蛋白质的水解反应生产肥皂和甘油
B.从石油中获得乙烯是工业生产乙烯的主要途径
C.通过海水可以制取氯化钠、镁、烧碱等物质
D.晶体硅是良好的半导体材料,可制成光电池等
17.对于反应Zn+H2SO4 ZnSO4 + H2↑,下列措施不能增大氢气生成速率的是
A.使用18.4mol?L-1的硫酸 B.升高溶液的温度
C.向溶液中加入少量铜粉 D.把锌块(片)换成锌粉
18.下列说法正确的是
A.化学反应中化学能只可以转化为热能
B.可逆反应达到平衡后,正、逆反应速率均为0
C.N 2和H2反应达到平衡后,无N 2或H2剩余
D.化学反应中一定有化学键的断裂和形成
19.下列对各物质性质的解释不正确的是
选项
性质
原因
A
氯水的漂白性
氯气的强氧化性
B
明矾用来净水
Al3+水解生成Al(OH)3胶体,具有吸附性
C
苯燃烧有浓黑的烟
苯分子中含碳量较高
D
加热铝箔,熔化的铝不滴落
铝表面的氧化膜熔点高,包在熔化的铝外面
20.有右图所示装置,下列有关说法正确的是
A.该装置外电路中电流由Cu棒转移到Ag棒
B.该装置中正极是Cu、负极是Ag
C.该装置是电解池
D.该装置中正极上的电极反应为Ag++e-=Ag
21.下列反应中,属于加成反应的是
A.CH3Cl+Cl2CH2Cl2+HCl
B.CH2=CH2+HOClHOCH2—CH2Cl
C.2CH3CH2OH+O22CH3CHO+2H2O
D.
22.短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14。X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A.原子半径:Y
C.Y与W可形成离子化合物
D.Z的单质不能与X的氧化物反应
23.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ。为确认
该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,
有白色沉淀、无剌激气味气体生成。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至
100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3
溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1
D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1
第Ⅱ卷(非选择题 共31分)
24.(15分)⑴随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成 (化学式),该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是 。
②维生素C也称抗坏血酸。血液中运载氧的血红蛋白中含有Fe2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是Fe3+,Fe3+不能被人体吸收。维生素C的主要摄入途径是 ,维生素C在抗坏血病方面的作用原理
是 。
⑵我国材料科学家师倡绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献、荣获2010年度国家最高科学技术奖。
①合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架。该合金中含量最高的金属为 (填元素符号)。
②铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式 ;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为 。
③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层 B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
⑶ ①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 。
②水中含有的悬浮颗粒物等杂质,可以加入 (填名称)等混凝剂进行净化处理,利用其溶解后形成的 具有吸附作用使水中的悬浮颗粒物沉降。
⑷我国采用食盐中加入碘酸钾(KIO3)的方法防止缺碘引起的疾病。在人体中,碘是属于 (选填“常量”或“微量”)元素;缺碘引起的疾病有 (写一种即可)。
25.(6分)在下图所示的物质转化关系中,A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
请回答下列问题:
(1)B的化学式为 。
(2)A的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
26.(10分)某氮肥硫酸铵中混有硫酸氢铵。为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用。已知:
氢氧化钠少量时 2NH4HSO4 + 2NaOH = (NH4)2SO4 + Na2SO4 + 2H2O
氢氧化钠过量时 NH4HSO4 + 2NaOH = Na2SO4 + NH3↑+ 2H2O
(1)同学们设计的实验装置图如下,请回答相关问题。
①装置中碱石灰的作用是 。
②广口瓶内四氯化碳的作用是 。
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,测得的样品含氮量仍将偏低,其原因可能是 。
(2)同学们改进实验装置后(改进装置图略),进行如下实验。
称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液相混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量。部分实验数据如下:
氢氧化钠溶液体积/mL
40.00
样品质量/g
7.750
15.50
23.25
氨气质量/g
1.870
1.870
1.700
请计算(计算结果保留两位小数):
品中的氮元素的质量分数是 % 。
②所用氢氧化钠溶液的物质的量浓度为 mol/L。
③若样品质量为31.00g,则生成氨气的质量为 g。
同课章节目录
