人教版化学九年级下册 11.1 生活中常见的盐-课件(共49张PPT)
文档属性
| 名称 | 人教版化学九年级下册 11.1 生活中常见的盐-课件(共49张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1000.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-22 00:00:00 | ||
图片预览











文档简介
(共49张PPT)
生活中常见的盐
一、盐的概念
由金属阳离子(NH4 )和酸根离子构成的化合物
+
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3
酸:由氢离子和酸根离子构成的化合物
碱:由金属阳离子和氢氧根离子的化合物
盐:由金属离子和酸根离子构成的化合物
盐:读作某酸某或氯化某
指出下列物质中哪些是酸 哪些是碱 哪些是盐
NaHCO3 KOH HNO3 K2CO3 NaNO3 H2CO3 Mg(OH)2
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 HCl H2O2 Na2CO3 Ca(OH)2 MnO2 H2SO4 NaOH
快速判别酸、碱、盐的方法:
酸:化学式第一个字母为H,读作:某酸。
碱:化学式最后两个字母是OH,读作:氢氧化某。
二 、盐的分类
根据含有相同的金属阳离子或相同的酸根离子进行分类
氯化钠晶体
氯化钠:白色固体,易溶于水,有咸味。
用途:
⑴生活:作调味品(调味剂)、腌渍蔬菜等 ⑵医疗:配制生理盐水(0.9%),维持人的正常生理活动 ⑶农业:选种。 ⑷工业:制取碳酸钠、氢氧化钠、氯气和盐酸等。
(5)作融雪剂:公路上的积雪也可以用氯化钠来消除
(形成的溶液凝固点低)
亚硝酸钠(NaNO2)
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。而且有咸味。
亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
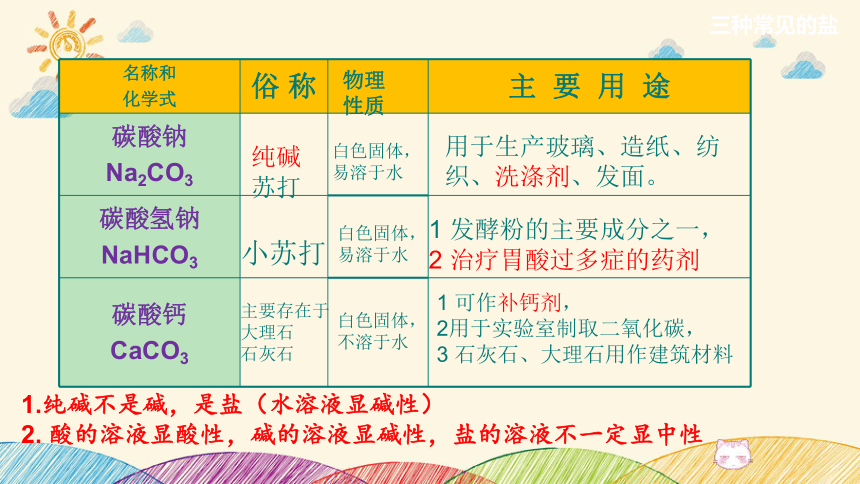
名称和
化学式 俗 称 主 要 用 途
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
碳酸钙
CaCO3
纯碱
苏打
小苏打
主要存在于
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂、发面。
1 发酵粉的主要成分之一,
2 治疗胃酸过多症的药剂
1 可作补钙剂,
2用于实验室制取二氧化碳,
3 石灰石、大理石用作建筑材料
1.纯碱不是碱,是盐(水溶液显碱性)
2. 酸的溶液显酸性,碱的溶液显碱性,盐的溶液不一定显中性
白色固体,
易溶于水
物理
性质
白色固体,
易溶于水
白色固体,
不溶于水
三种常见的盐
盐的化学性质(4点)
1. 盐溶液能和活泼金属反应(置换反应)
CuSO4 + Fe = Cu + FeSO4 (曾青得铁化为铜)
2AgNO3+ Cu = 2Ag + Cu(NO3)2
条件:前置后,盐可溶,铁二价,排除K Ca Na
Mg+ CuSO4 =
可通过金属与盐溶液是否反应来判断金属活动性的强弱
2 盐能与酸反应(复分解反应)
碳酸钙与盐酸反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
请书写出碳酸钠、碳酸氢钠与盐酸反应的化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,
利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)
方法:取样,加入稀盐酸,把产生的气体通入澄清石灰水。若澄清石灰水变浑浊,则为碳酸盐(含有CO32- /HCO3- )
3 可溶性盐能与可溶性碱反应(复分解反应)
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4
工业制烧碱
农业制波尔多液
4 可溶性盐能与可溶性盐反应
如:NaCl + AgNO3 = AgCl↓ + NaNO3
BaCl2 +Na2SO4 =BaSO4↓ +2NaCl
白色沉淀
白色沉淀
(复分解反应)
碳酸钠
白色粉末状固体,易溶于水
1 与酸能反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2与可溶性碱反应
Na2CO3+Ca(OH)2=2NaOH+CaCO3
碳酸氢钠 NaHCO3
白色可溶性固体
碳酸钙与盐酸反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
请书写出碳酸钠、碳酸氢钠与盐酸反应的化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,
利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)
碳酸盐(CO3、HCO3)的检验
取样品于试管中,加入适量的稀盐酸,若有气体生成,把生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明此为碳酸盐。
2-
--
CaCO3+2HCl=CaCl2+H2O+CO2↑
KOH+HCl=KCl+H2O
Na2CO3+Ca(OH)2=2NaOH+CaCO3
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应
AB + CD = AD + CB
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)
碳酸根离子(CO32-)及碳酸氢根离子(HCO3-)的检验:
取少量样品于试管中,滴加稀盐酸,如有气体生成,把生成气体通入澄清石灰水中,若石灰水变浑浊,证明样品中含有碳酸根或碳酸氢根
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
酸能跟酸碱指示剂起反应
酸能跟活泼金属起反应
酸能跟某些金属氧化物反应
酸能跟某些盐反应
酸能跟碱反应
知识回顾:酸 的 通 性
碱能跟酸碱指示剂起反应
碱能跟某些非金属氧化物反应
碱能跟某些盐反应
碱能跟酸反应
碱 的 通 性
盐的化学性质
盐溶液有酸性,有碱性的,还有中性的,所以某些盐也能与酸碱指示剂作用。
1、某些可溶的盐能与金属反应,发生置换反应。
如:CuSO4 + Fe = Cu + FeSO4
前置后,盐ke溶,铁二价,排除K Ca Na
2、某些盐能与某些酸反应,生成另一种盐和另一种酸。
如:HCl + AgNO3 = AgCl↓ + HNO3
3、某些盐能与某些碱反应,生成另一种盐和另一种碱。
如:Ca(OH)2 + Na2CO3 = CaCO3 ↓+ 2NaOH
4、盐和盐反应(两个盐都必须溶),生成另外两种盐。
如:NaCl + AgNO3 = AgCl↓ + NaNO3
讨论
1.酸和碱作用生成盐和水的反应是否也是复分解反应?为什么? 2.是不是所有的酸、碱、盐之间都能发生复分解反应? 3.分析、归纳上述几个酸、碱、盐之间的复分解反应,它们的生成物有什么特点?
复分解反应发生的条件
复分解反应的本质是溶液中的离子结合成难电离的物质(如水)、难溶的物质或挥发性气体,而使复分解反应趋于完成。
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
口诀
钾钠铵盐硝酸盐,均能溶于水中间
氯化盐中银不溶,硫酸盐中钡不溶
碳酸钾钠铵盐溶,氢氧钾钠钙钡溶
常见五酸都易溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
化学反应速率的比较
如图所示,在两试管中分别加入4 mL相同质量分数的稀盐酸,然后把等质量的碳酸钠粉末和碳酸氢钠粉末放在气球内,并用线把气球固定在试管上,同时把气球内的粉末倒入试管中,观察气球鼓起大小。
(1)鼓得更大的是 。
(2)有关的化学反应方程式:
Na2CO3 + HCl
1、交换位置:
Cl+ CO3
Na H
2、定化学式:
NaCl+H2CO3
例:
3、配 平:
2HCl+Na2CO3
2NaCl+H2O+CO2
HCl+Na2CO3
HCl+Na2CO3
基本反应类型比较:
化 合 反 应 分 解 反 应 置 换 反 应 复 分 解 反 应
定
义 由两种或两种以上物质生成另一种物质的反应 由一种物质生成两种或两种以上其它物质的反应 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应 由两种化合物互相交换成分生成另外两种化合物的反应
类
型 A+B→AB AB→A+B+ …… AB + C→A +BC AB + CD→ AD+ CB
特
征 反应物为多种而生成物只有一种,即“多变一” 反应物只有一种而生成物有多种,即“一变多” 反应物与生成物都是两种,且都是单质和化合物 反应物和生成物都为化合物
2、下列各组物质的溶液,不能发生复分解反应的是 ( )
A、HCl,Ca(OH)2 B、Na2CO3,H2SO4
C、AgNO3,BaCl2 D、KCl,CuSO4
1、下列反应不属于分解反应的是( )
下列物质能否发生反应 写出能发生反应的化学方程式,并注明反应类型
(1)银与稀盐酸
(2)铜与硫酸锌溶液
(3)铝与硝酸银溶液
(4)硫酸和硝酸钠溶液
(5)氢氧化钾溶液和硝酸
(6)氯化钠溶液和硝酸银溶液
(7)碳酸钾溶液和盐酸
(8)硫酸铜溶液和氯化钡溶液
食盐的实用价值
食盐不仅是化学工业的重要原料,而且是人类生活中的重要调味品。此外,食盐还有多种用途。 (1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可以治喉咙痛牙痛。 (2)误食有毒物,喝一些盐开水,有解毒作用。 (3)每天用淡盐开水漱口,可以预防各种口腔病。 (4)洗浴时,在水中加少量食盐,可使皮肤强健。 (5)豆腐易变质,如将食盐化在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月。 (6)花生油内含水分,久贮会发臭。可将盐炒热,凉后,按40斤油1斤盐的比例,加入食盐,可以使花生油2--3年仍保持色滑、味香。 (7)鲜花插入稀盐水里,可数日不谢。 (8)新买的玻璃器皿,用盐煮一煮,不易破裂。 (9)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再洗,则不易掉色。 (10)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑。 (11)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。 (12)铜器生锈或出现黑点,用盐可以擦掉。
海水里含有3%的食盐,把海水引进晒盐池,经过风吹日晒、水份蒸发,白花花的食盐就析出来了。其它还有用盐井水,盐湖水熬盐,使食盐溶液达到饱和,再继续蒸发,食盐就成晶体析出,得到精盐。
你看到过粗盐在夏天“出汗”吗?这是粗盐里含的杂质(CaCl2,MgCl2)吸收空气里的水分变潮的结果,纯净的食盐是不容易受潮的。
一些常见物质的化学式及俗称
俗称 食盐 纯碱\苏打 烧碱\火碱 双氧水 盐酸 明矾
化学式 Na2CO3
分类 盐 酸
俗称 灰锰氧 大理石 胆矾\蓝矾 小苏打 生石灰 熟石灰
化学式
分类
我国食盐产地
我国食盐的产地分布很广,出产着种类繁多的盐:海盐、井盐、岩盐、池盐等。其中辽宁、山东、两淮、长芦各盐场盛产海盐,自古闻名。井盐则以四川自贡市的自流井最为有名,岩盐产于四川、云南、等地。在青海、新疆、内蒙古等地有很多咸水湖,盛产池盐,其中最大的是柴达木盆地的察尔汗盐池,据统计,仅这一盐池开采出来的池盐,足够我国十二亿人口食用四千多年。
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
从前有一个国王,他很喜欢吃糖,于是他就问他的厨师说:“这个世界上什么东西最好吃 ”厨师说:“这个世界上最好吃的是盐.”国王很生气,于是把厨师关了起来,同时命令全国人民只能吃糖,不准吃盐.过了一段时间后,他发现他的国民个个都愁眉苦脸的,而且有很多人出现了不同的症状.于是他不得不取消了这项命令.
二、碳酸钠(Na2CO3 ) 碳酸氢钠(NaHCO3 ) 碳酸钙(CaCO3)
名 称 主 要 用 途
碳酸钠
(纯碱、苏打) 用于生产玻璃、造纸、纺织、洗涤剂
碳酸氢钠(小苏打) 发酵粉的主要成分、治疗胃酸过多的药剂
碳酸钙 可作补钙剂。石灰石、大理石作建筑材料、也用于实验室制取二氧化碳
常见的盐
明矾晶体
用钡餐观察
肠内情况
石盐标本
五水硫酸铜晶体
食盐
馒头里的小房子是谁造的?
馒头是大家常吃的食品,但是,馒头里的学问大家也许并不知道。当你切开一个馒头时,你会发现馒头里有许许多多的小洞洞,象一间间小房子一样。你知道这是怎么形成的吗?要想解开这个谜,必须先从馒头是怎么做出来的开始了解。
首先在面粉里放些水,再加上酵母和盐,和匀后盖起来,让它发酵。酵母遇到潮湿的面团,迅速繁殖。它们把面粉里的淀粉分解成葡萄糖和二氧化碳。这些二氧化碳都想从面团里跑出来,可是粘韧的面团把它们阻拦住了。慢慢地二氧化碳气体越来越多,把面团顶了起来,于是,面团就发胖胀大了。等面团发酵好了,做成一个个馒头,上蒸笼去蒸。馒头里的二氧化碳气体,受热后膨胀起来,最后从面团里跑出来,馒头里留下了无数的小洞洞,馒头蒸熟了,也就变得又大又松了。原来,馒头里的小洞洞,都是二氧化碳居住过的小房子。
与NaCl有关的反应
NaCl +AgNO3 =NaNO3 + AgCl
反应本质:
Cl-的检验:取样,加入AgNO3 溶液,再加入稀硝酸,如产生不溶于酸的白色沉淀,则证明氯离子的存在
Ag+ + Cl- = AgCl
课题1 生活中常见的盐
碳酸钠、碳酸氢钠和碳酸钙
生活中常见的盐
一、盐的概念
由金属阳离子(NH4 )和酸根离子构成的化合物
+
酸:HCl H2SO4
碱:NaOH Ca(OH)2
盐:CaCO3 Na2CO3
酸:由氢离子和酸根离子构成的化合物
碱:由金属阳离子和氢氧根离子的化合物
盐:由金属离子和酸根离子构成的化合物
盐:读作某酸某或氯化某
指出下列物质中哪些是酸 哪些是碱 哪些是盐
NaHCO3 KOH HNO3 K2CO3 NaNO3 H2CO3 Mg(OH)2
指出下列物质中哪些是酸 哪些是碱 哪些是盐
H2O CaCO3 HCl H2O2 Na2CO3 Ca(OH)2 MnO2 H2SO4 NaOH
快速判别酸、碱、盐的方法:
酸:化学式第一个字母为H,读作:某酸。
碱:化学式最后两个字母是OH,读作:氢氧化某。
二 、盐的分类
根据含有相同的金属阳离子或相同的酸根离子进行分类
氯化钠晶体
氯化钠:白色固体,易溶于水,有咸味。
用途:
⑴生活:作调味品(调味剂)、腌渍蔬菜等 ⑵医疗:配制生理盐水(0.9%),维持人的正常生理活动 ⑶农业:选种。 ⑷工业:制取碳酸钠、氢氧化钠、氯气和盐酸等。
(5)作融雪剂:公路上的积雪也可以用氯化钠来消除
(形成的溶液凝固点低)
亚硝酸钠(NaNO2)
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。而且有咸味。
亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
名称和
化学式 俗 称 主 要 用 途
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
碳酸钙
CaCO3
纯碱
苏打
小苏打
主要存在于
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂、发面。
1 发酵粉的主要成分之一,
2 治疗胃酸过多症的药剂
1 可作补钙剂,
2用于实验室制取二氧化碳,
3 石灰石、大理石用作建筑材料
1.纯碱不是碱,是盐(水溶液显碱性)
2. 酸的溶液显酸性,碱的溶液显碱性,盐的溶液不一定显中性
白色固体,
易溶于水
物理
性质
白色固体,
易溶于水
白色固体,
不溶于水
三种常见的盐
盐的化学性质(4点)
1. 盐溶液能和活泼金属反应(置换反应)
CuSO4 + Fe = Cu + FeSO4 (曾青得铁化为铜)
2AgNO3+ Cu = 2Ag + Cu(NO3)2
条件:前置后,盐可溶,铁二价,排除K Ca Na
Mg+ CuSO4 =
可通过金属与盐溶液是否反应来判断金属活动性的强弱
2 盐能与酸反应(复分解反应)
碳酸钙与盐酸反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
请书写出碳酸钠、碳酸氢钠与盐酸反应的化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,
利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)
方法:取样,加入稀盐酸,把产生的气体通入澄清石灰水。若澄清石灰水变浑浊,则为碳酸盐(含有CO32- /HCO3- )
3 可溶性盐能与可溶性碱反应(复分解反应)
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4
工业制烧碱
农业制波尔多液
4 可溶性盐能与可溶性盐反应
如:NaCl + AgNO3 = AgCl↓ + NaNO3
BaCl2 +Na2SO4 =BaSO4↓ +2NaCl
白色沉淀
白色沉淀
(复分解反应)
碳酸钠
白色粉末状固体,易溶于水
1 与酸能反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2与可溶性碱反应
Na2CO3+Ca(OH)2=2NaOH+CaCO3
碳酸氢钠 NaHCO3
白色可溶性固体
碳酸钙与盐酸反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
请书写出碳酸钠、碳酸氢钠与盐酸反应的化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,
利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)
碳酸盐(CO3、HCO3)的检验
取样品于试管中,加入适量的稀盐酸,若有气体生成,把生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明此为碳酸盐。
2-
--
CaCO3+2HCl=CaCl2+H2O+CO2↑
KOH+HCl=KCl+H2O
Na2CO3+Ca(OH)2=2NaOH+CaCO3
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应
AB + CD = AD + CB
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
组成里含有CO32-(或HCO3-)离子的盐,都能跟盐酸反应生成二氧化碳气体,利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)
碳酸根离子(CO32-)及碳酸氢根离子(HCO3-)的检验:
取少量样品于试管中,滴加稀盐酸,如有气体生成,把生成气体通入澄清石灰水中,若石灰水变浑浊,证明样品中含有碳酸根或碳酸氢根
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
酸能跟酸碱指示剂起反应
酸能跟活泼金属起反应
酸能跟某些金属氧化物反应
酸能跟某些盐反应
酸能跟碱反应
知识回顾:酸 的 通 性
碱能跟酸碱指示剂起反应
碱能跟某些非金属氧化物反应
碱能跟某些盐反应
碱能跟酸反应
碱 的 通 性
盐的化学性质
盐溶液有酸性,有碱性的,还有中性的,所以某些盐也能与酸碱指示剂作用。
1、某些可溶的盐能与金属反应,发生置换反应。
如:CuSO4 + Fe = Cu + FeSO4
前置后,盐ke溶,铁二价,排除K Ca Na
2、某些盐能与某些酸反应,生成另一种盐和另一种酸。
如:HCl + AgNO3 = AgCl↓ + HNO3
3、某些盐能与某些碱反应,生成另一种盐和另一种碱。
如:Ca(OH)2 + Na2CO3 = CaCO3 ↓+ 2NaOH
4、盐和盐反应(两个盐都必须溶),生成另外两种盐。
如:NaCl + AgNO3 = AgCl↓ + NaNO3
讨论
1.酸和碱作用生成盐和水的反应是否也是复分解反应?为什么? 2.是不是所有的酸、碱、盐之间都能发生复分解反应? 3.分析、归纳上述几个酸、碱、盐之间的复分解反应,它们的生成物有什么特点?
复分解反应发生的条件
复分解反应的本质是溶液中的离子结合成难电离的物质(如水)、难溶的物质或挥发性气体,而使复分解反应趋于完成。
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
口诀
钾钠铵盐硝酸盐,均能溶于水中间
氯化盐中银不溶,硫酸盐中钡不溶
碳酸钾钠铵盐溶,氢氧钾钠钙钡溶
常见五酸都易溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
化学反应速率的比较
如图所示,在两试管中分别加入4 mL相同质量分数的稀盐酸,然后把等质量的碳酸钠粉末和碳酸氢钠粉末放在气球内,并用线把气球固定在试管上,同时把气球内的粉末倒入试管中,观察气球鼓起大小。
(1)鼓得更大的是 。
(2)有关的化学反应方程式:
Na2CO3 + HCl
1、交换位置:
Cl+ CO3
Na H
2、定化学式:
NaCl+H2CO3
例:
3、配 平:
2HCl+Na2CO3
2NaCl+H2O+CO2
HCl+Na2CO3
HCl+Na2CO3
基本反应类型比较:
化 合 反 应 分 解 反 应 置 换 反 应 复 分 解 反 应
定
义 由两种或两种以上物质生成另一种物质的反应 由一种物质生成两种或两种以上其它物质的反应 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应 由两种化合物互相交换成分生成另外两种化合物的反应
类
型 A+B→AB AB→A+B+ …… AB + C→A +BC AB + CD→ AD+ CB
特
征 反应物为多种而生成物只有一种,即“多变一” 反应物只有一种而生成物有多种,即“一变多” 反应物与生成物都是两种,且都是单质和化合物 反应物和生成物都为化合物
2、下列各组物质的溶液,不能发生复分解反应的是 ( )
A、HCl,Ca(OH)2 B、Na2CO3,H2SO4
C、AgNO3,BaCl2 D、KCl,CuSO4
1、下列反应不属于分解反应的是( )
下列物质能否发生反应 写出能发生反应的化学方程式,并注明反应类型
(1)银与稀盐酸
(2)铜与硫酸锌溶液
(3)铝与硝酸银溶液
(4)硫酸和硝酸钠溶液
(5)氢氧化钾溶液和硝酸
(6)氯化钠溶液和硝酸银溶液
(7)碳酸钾溶液和盐酸
(8)硫酸铜溶液和氯化钡溶液
食盐的实用价值
食盐不仅是化学工业的重要原料,而且是人类生活中的重要调味品。此外,食盐还有多种用途。 (1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可以治喉咙痛牙痛。 (2)误食有毒物,喝一些盐开水,有解毒作用。 (3)每天用淡盐开水漱口,可以预防各种口腔病。 (4)洗浴时,在水中加少量食盐,可使皮肤强健。 (5)豆腐易变质,如将食盐化在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月。 (6)花生油内含水分,久贮会发臭。可将盐炒热,凉后,按40斤油1斤盐的比例,加入食盐,可以使花生油2--3年仍保持色滑、味香。 (7)鲜花插入稀盐水里,可数日不谢。 (8)新买的玻璃器皿,用盐煮一煮,不易破裂。 (9)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再洗,则不易掉色。 (10)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑。 (11)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。 (12)铜器生锈或出现黑点,用盐可以擦掉。
海水里含有3%的食盐,把海水引进晒盐池,经过风吹日晒、水份蒸发,白花花的食盐就析出来了。其它还有用盐井水,盐湖水熬盐,使食盐溶液达到饱和,再继续蒸发,食盐就成晶体析出,得到精盐。
你看到过粗盐在夏天“出汗”吗?这是粗盐里含的杂质(CaCl2,MgCl2)吸收空气里的水分变潮的结果,纯净的食盐是不容易受潮的。
一些常见物质的化学式及俗称
俗称 食盐 纯碱\苏打 烧碱\火碱 双氧水 盐酸 明矾
化学式 Na2CO3
分类 盐 酸
俗称 灰锰氧 大理石 胆矾\蓝矾 小苏打 生石灰 熟石灰
化学式
分类
我国食盐产地
我国食盐的产地分布很广,出产着种类繁多的盐:海盐、井盐、岩盐、池盐等。其中辽宁、山东、两淮、长芦各盐场盛产海盐,自古闻名。井盐则以四川自贡市的自流井最为有名,岩盐产于四川、云南、等地。在青海、新疆、内蒙古等地有很多咸水湖,盛产池盐,其中最大的是柴达木盆地的察尔汗盐池,据统计,仅这一盐池开采出来的池盐,足够我国十二亿人口食用四千多年。
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
从前有一个国王,他很喜欢吃糖,于是他就问他的厨师说:“这个世界上什么东西最好吃 ”厨师说:“这个世界上最好吃的是盐.”国王很生气,于是把厨师关了起来,同时命令全国人民只能吃糖,不准吃盐.过了一段时间后,他发现他的国民个个都愁眉苦脸的,而且有很多人出现了不同的症状.于是他不得不取消了这项命令.
二、碳酸钠(Na2CO3 ) 碳酸氢钠(NaHCO3 ) 碳酸钙(CaCO3)
名 称 主 要 用 途
碳酸钠
(纯碱、苏打) 用于生产玻璃、造纸、纺织、洗涤剂
碳酸氢钠(小苏打) 发酵粉的主要成分、治疗胃酸过多的药剂
碳酸钙 可作补钙剂。石灰石、大理石作建筑材料、也用于实验室制取二氧化碳
常见的盐
明矾晶体
用钡餐观察
肠内情况
石盐标本
五水硫酸铜晶体
食盐
馒头里的小房子是谁造的?
馒头是大家常吃的食品,但是,馒头里的学问大家也许并不知道。当你切开一个馒头时,你会发现馒头里有许许多多的小洞洞,象一间间小房子一样。你知道这是怎么形成的吗?要想解开这个谜,必须先从馒头是怎么做出来的开始了解。
首先在面粉里放些水,再加上酵母和盐,和匀后盖起来,让它发酵。酵母遇到潮湿的面团,迅速繁殖。它们把面粉里的淀粉分解成葡萄糖和二氧化碳。这些二氧化碳都想从面团里跑出来,可是粘韧的面团把它们阻拦住了。慢慢地二氧化碳气体越来越多,把面团顶了起来,于是,面团就发胖胀大了。等面团发酵好了,做成一个个馒头,上蒸笼去蒸。馒头里的二氧化碳气体,受热后膨胀起来,最后从面团里跑出来,馒头里留下了无数的小洞洞,馒头蒸熟了,也就变得又大又松了。原来,馒头里的小洞洞,都是二氧化碳居住过的小房子。
与NaCl有关的反应
NaCl +AgNO3 =NaNO3 + AgCl
反应本质:
Cl-的检验:取样,加入AgNO3 溶液,再加入稀硝酸,如产生不溶于酸的白色沉淀,则证明氯离子的存在
Ag+ + Cl- = AgCl
课题1 生活中常见的盐
碳酸钠、碳酸氢钠和碳酸钙
同课章节目录
