人教版化学九年级下册 第九单元 溶液 课 题3溶液的浓度第2课 时-课件(共19张PPT)
文档属性
| 名称 | 人教版化学九年级下册 第九单元 溶液 课 题3溶液的浓度第2课 时-课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-22 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第 九 单 元 溶液
课 题 3 溶液的浓度
第 2 课 时
第九单元 溶液
1.通过一定溶质质量分数的氯化钠溶液的配制,加深理解溶质质量分数的概念。
2.能结合化学方程式进行有关反应物或生成物溶质质量分数的计算。
学 习 目 标
自制汽水
在500mL的饮料瓶中加入
2勺白糖
适量果汁
1.5g小苏打
水
1.5g柠檬酸
自 主 探 究
一.配制一定溶质质量分数的溶液
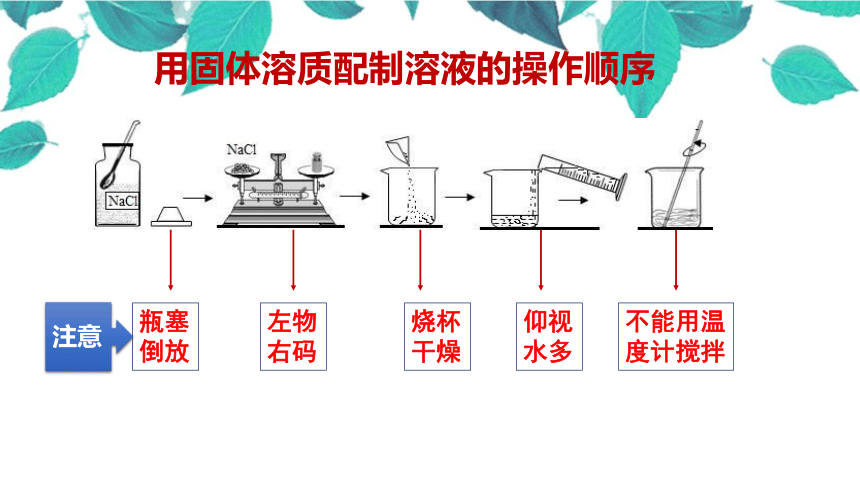
1.用固体溶质配制溶液
例题 配制50g6%的氯化钠溶液
思考:需要哪些仪器?如何进行配制?
托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等
一.配制一定溶质质量分数的溶液
1.用固体溶质配制溶液
阅读教材47页实验
步骤 具体过程
1.计算 所需的氯化钠 克,水的质量为 克
2.称量 用托盘天平称量所需的氯化钠,倒入烧杯
3.量取 用 mL量筒量取所需的水倒入烧杯中
4.溶解 用玻璃棒搅拌
5.装瓶贴标签 把配制好的溶液倒入试剂瓶中,并贴上标签
3
47
50
瓶塞倒放
左物右码
烧杯干燥
仰视水多
不能用温度计搅拌
用固体溶质配制溶液的操作顺序
注意
一.配制一定溶质质量分数的溶液
2.用浓溶液配制稀溶液
用已配好的6%的氯化钠溶液配成50g3%的氯化钠溶液。
温馨提示:用浓溶液配制稀溶液时,一般将浓溶液的质量换算成体积,用量筒来量取,液体不便于用托盘天平称量。
步骤 具体过程
1.计算 所需的氯化钠浓溶液 毫升,水的质量为 毫升
2.量取 用合适的量筒量取所需的浓溶液和水倒入烧杯中
3.混匀 用玻璃棒搅拌,使溶液混合均匀
4.装瓶贴标签 把配制好的溶液倒入试剂瓶中,并贴上标签
2.稀释溶液
阅读教材47页
50g×3%÷6%=25g
25g÷1.04g/cm3=24mL
24
25
配制一定溶质质量分数的溶液时,容易造成误差,一般都有哪些原因呢?
步骤 药品方面 计算 称量 量取 溶解
偏低 ①固体药品中含有水分;②固体药品中含有杂质;③固体药品转移时损失 固体药品计算偏少 ①称量前天平指针偏左;②称量前游码不在零点;③称量时药品和砝码放颠倒(使用游码) 量水时仰视读数 ①溶解时,所用烧杯中有水
②往烧杯倒食盐时,少量食盐洒出
偏高 固体药品计算偏多 称量前天平指针偏右 ①量水时俯视读数;②量好的水倒入烧杯时溅出
二.化学反应与溶液计算
例题1 为测定某失去标签的过氧化氢溶液的溶质质量分数,现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,完全反应后,共收集到1.6g气体。过氧化氢溶液中溶质的质量分数是多少?
【分析】解本题的关键是利用化学方程式计算出过氧化氢溶液中溶质的质量,然后除以溶液的质量求出溶液中溶质的质量分数。
解:设溶液中过氧化氢的质量为X
68 32
X 1.6克
① 68:32 = X:1.6克 X=3.4克
②
× = 3.4%
答:溶液中过氧化氢的质量分数是3.4%。
3.4克
100克
100%
例题2 100 g某硫酸溶液恰好与13 g锌完全起反应。试计算反应后所得溶液的溶质质量分数是多少?
【讨论】1.反应后得到溶液的溶质是什么?
2.溶液的质量是多少?
【分析】1.反应后得到溶液的溶质是硫酸锌
2.溶液质量是100克+13克-H2质量
解:设生成硫酸锌的质量为x,生成氢气质量为y。
Zn+H2SO4= ZnSO4+H2↑
65 161 2
13g x y
65:161=13g:x x=32.2g
65:2=13g:y y=0.4g
反应后所得溶液溶质质量分数为
生成溶液的质量=反应前物质的质量总和—难溶性杂质(反应前混有的且不参加反应的)—生成沉淀的质量—生成气体的质量。
反应所得溶液的质量的两种求法
(1)溶液组成法:
(2)质量守恒法:
溶液质量=溶质质量+溶剂质量。
其中溶质一定是已溶解的,溶剂水通常有两种情况:①原溶液中的水;②化学反应新生成的水(有时化学反应消耗水)。
本节课你学会了哪些知识?
收获了什么方法?
还有什么疑惑吗?
课 堂 达 标
1.制作“叶脉书签”需要配制100 g 12%的NaOH溶液(设水的密度为1 g/mL)。下列操作正确的是( )
A.称量前调节天平平衡时发现指针向右偏转,可调节游码
B.在左右托盘上垫滤纸称取12.0 g NaOH固体
C.将准确称取的NaOH固体直接倒入装有水的量筒中溶解
D.选用100 mL量筒量取88.0 mL的水
D
2.实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。配制步骤为:
(1)计算:需氢氧化钠固体 g,水 mL(水的密度是1 g/cm3)。
(2)称量:用质量为23.1 g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘(填“左”或“右”),在下表所列的砝码中,选出所需砝码(打“√”表示选用):
砝码/g 100 50 20 20 10 5
打“√”表示选用
并在下列标尺中选出能正确表示游码位置的选项 (填字母)。
(3)溶解:将氢氧化钠固体溶于水,用 搅拌,使氢氧化钠固体全部溶解,冷却至室温。
(4)把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
40
960
左
B
玻璃棒
√
√
3.某化学兴趣小组同学为回收一块质量为40 g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100 g,烧杯内剩余固体27 g。
请完成下列分析及计算:
(1)40 g铜锌合金中锌的质量是_________g。
(2)计算所用稀硫酸中溶质的质量分数。
【分析】铜锌合金中的铜不与稀硫酸反应,解本题的关键是根据化学方程式,利用锌的质量计算出稀硫酸溶液中溶质的质量,然后除以溶液的质量求出溶液中溶质的质量分数。
解:(1)40 g铜锌合金中锌的质量是40 g-27g=13g。
(2)设这种硫酸溶液中溶质的质量为x。
Zn + H2SO4=ZnSO4 + H2↑
65 98
13g x
65:98=13g:x
x=19.6g
溶质的质量分数为:19.6g/100g×100%=19.6%
答:这种硫酸溶液中溶质的质量分数为19.6%。
第 九 单 元 溶液
课 题 3 溶液的浓度
第 2 课 时
第九单元 溶液
1.通过一定溶质质量分数的氯化钠溶液的配制,加深理解溶质质量分数的概念。
2.能结合化学方程式进行有关反应物或生成物溶质质量分数的计算。
学 习 目 标
自制汽水
在500mL的饮料瓶中加入
2勺白糖
适量果汁
1.5g小苏打
水
1.5g柠檬酸
自 主 探 究
一.配制一定溶质质量分数的溶液
1.用固体溶质配制溶液
例题 配制50g6%的氯化钠溶液
思考:需要哪些仪器?如何进行配制?
托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等
一.配制一定溶质质量分数的溶液
1.用固体溶质配制溶液
阅读教材47页实验
步骤 具体过程
1.计算 所需的氯化钠 克,水的质量为 克
2.称量 用托盘天平称量所需的氯化钠,倒入烧杯
3.量取 用 mL量筒量取所需的水倒入烧杯中
4.溶解 用玻璃棒搅拌
5.装瓶贴标签 把配制好的溶液倒入试剂瓶中,并贴上标签
3
47
50
瓶塞倒放
左物右码
烧杯干燥
仰视水多
不能用温度计搅拌
用固体溶质配制溶液的操作顺序
注意
一.配制一定溶质质量分数的溶液
2.用浓溶液配制稀溶液
用已配好的6%的氯化钠溶液配成50g3%的氯化钠溶液。
温馨提示:用浓溶液配制稀溶液时,一般将浓溶液的质量换算成体积,用量筒来量取,液体不便于用托盘天平称量。
步骤 具体过程
1.计算 所需的氯化钠浓溶液 毫升,水的质量为 毫升
2.量取 用合适的量筒量取所需的浓溶液和水倒入烧杯中
3.混匀 用玻璃棒搅拌,使溶液混合均匀
4.装瓶贴标签 把配制好的溶液倒入试剂瓶中,并贴上标签
2.稀释溶液
阅读教材47页
50g×3%÷6%=25g
25g÷1.04g/cm3=24mL
24
25
配制一定溶质质量分数的溶液时,容易造成误差,一般都有哪些原因呢?
步骤 药品方面 计算 称量 量取 溶解
偏低 ①固体药品中含有水分;②固体药品中含有杂质;③固体药品转移时损失 固体药品计算偏少 ①称量前天平指针偏左;②称量前游码不在零点;③称量时药品和砝码放颠倒(使用游码) 量水时仰视读数 ①溶解时,所用烧杯中有水
②往烧杯倒食盐时,少量食盐洒出
偏高 固体药品计算偏多 称量前天平指针偏右 ①量水时俯视读数;②量好的水倒入烧杯时溅出
二.化学反应与溶液计算
例题1 为测定某失去标签的过氧化氢溶液的溶质质量分数,现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,完全反应后,共收集到1.6g气体。过氧化氢溶液中溶质的质量分数是多少?
【分析】解本题的关键是利用化学方程式计算出过氧化氢溶液中溶质的质量,然后除以溶液的质量求出溶液中溶质的质量分数。
解:设溶液中过氧化氢的质量为X
68 32
X 1.6克
① 68:32 = X:1.6克 X=3.4克
②
× = 3.4%
答:溶液中过氧化氢的质量分数是3.4%。
3.4克
100克
100%
例题2 100 g某硫酸溶液恰好与13 g锌完全起反应。试计算反应后所得溶液的溶质质量分数是多少?
【讨论】1.反应后得到溶液的溶质是什么?
2.溶液的质量是多少?
【分析】1.反应后得到溶液的溶质是硫酸锌
2.溶液质量是100克+13克-H2质量
解:设生成硫酸锌的质量为x,生成氢气质量为y。
Zn+H2SO4= ZnSO4+H2↑
65 161 2
13g x y
65:161=13g:x x=32.2g
65:2=13g:y y=0.4g
反应后所得溶液溶质质量分数为
生成溶液的质量=反应前物质的质量总和—难溶性杂质(反应前混有的且不参加反应的)—生成沉淀的质量—生成气体的质量。
反应所得溶液的质量的两种求法
(1)溶液组成法:
(2)质量守恒法:
溶液质量=溶质质量+溶剂质量。
其中溶质一定是已溶解的,溶剂水通常有两种情况:①原溶液中的水;②化学反应新生成的水(有时化学反应消耗水)。
本节课你学会了哪些知识?
收获了什么方法?
还有什么疑惑吗?
课 堂 达 标
1.制作“叶脉书签”需要配制100 g 12%的NaOH溶液(设水的密度为1 g/mL)。下列操作正确的是( )
A.称量前调节天平平衡时发现指针向右偏转,可调节游码
B.在左右托盘上垫滤纸称取12.0 g NaOH固体
C.将准确称取的NaOH固体直接倒入装有水的量筒中溶解
D.选用100 mL量筒量取88.0 mL的水
D
2.实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。配制步骤为:
(1)计算:需氢氧化钠固体 g,水 mL(水的密度是1 g/cm3)。
(2)称量:用质量为23.1 g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘(填“左”或“右”),在下表所列的砝码中,选出所需砝码(打“√”表示选用):
砝码/g 100 50 20 20 10 5
打“√”表示选用
并在下列标尺中选出能正确表示游码位置的选项 (填字母)。
(3)溶解:将氢氧化钠固体溶于水,用 搅拌,使氢氧化钠固体全部溶解,冷却至室温。
(4)把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
40
960
左
B
玻璃棒
√
√
3.某化学兴趣小组同学为回收一块质量为40 g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100 g,烧杯内剩余固体27 g。
请完成下列分析及计算:
(1)40 g铜锌合金中锌的质量是_________g。
(2)计算所用稀硫酸中溶质的质量分数。
【分析】铜锌合金中的铜不与稀硫酸反应,解本题的关键是根据化学方程式,利用锌的质量计算出稀硫酸溶液中溶质的质量,然后除以溶液的质量求出溶液中溶质的质量分数。
解:(1)40 g铜锌合金中锌的质量是40 g-27g=13g。
(2)设这种硫酸溶液中溶质的质量为x。
Zn + H2SO4=ZnSO4 + H2↑
65 98
13g x
65:98=13g:x
x=19.6g
溶质的质量分数为:19.6g/100g×100%=19.6%
答:这种硫酸溶液中溶质的质量分数为19.6%。
同课章节目录
