2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(一)(课件27页)
文档属性
| 名称 | 2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(一)(课件27页) |  | |
| 格式 | zip | ||
| 文件大小 | 470.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 08:38:54 | ||
图片预览


文档简介
(共27张PPT)
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(一)
专题精讲
1
专题分类训练
2
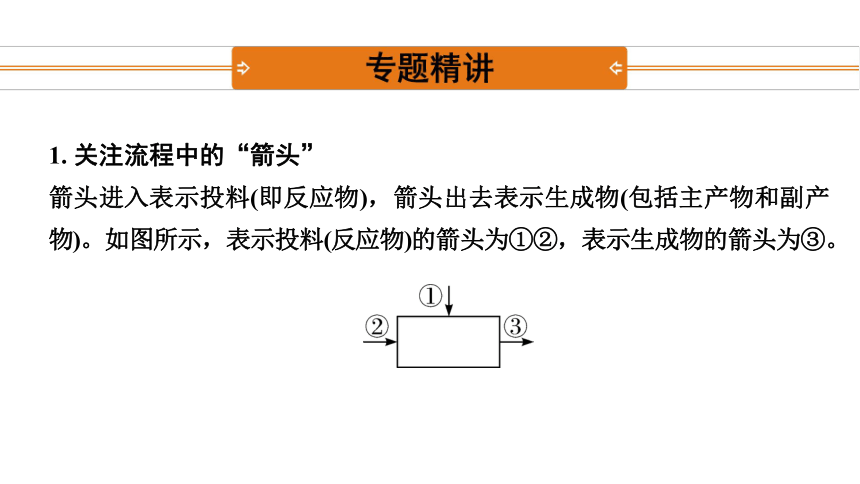
1. 关注流程中的“箭头”
箭头进入表示投料(即反应物),箭头出去表示生成物(包括主产物和副产物)。如图所示,表示投料(反应物)的箭头为①②,表示生成物的箭头为③。
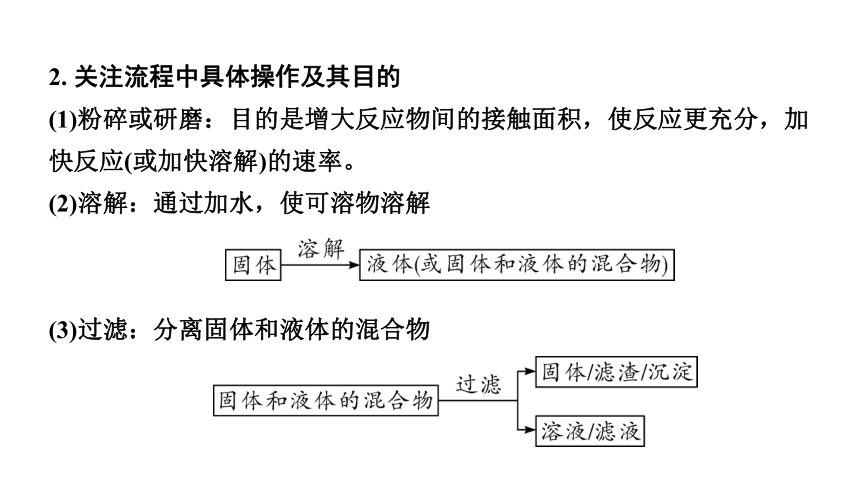
2. 关注流程中具体操作及其目的
(1)粉碎或研磨:目的是增大反应物间的接触面积,使反应更充分,加快反应(或加快溶解)的速率。
(2)溶解:通过加水,使可溶物溶解
(3)过滤:分离固体和液体的混合物
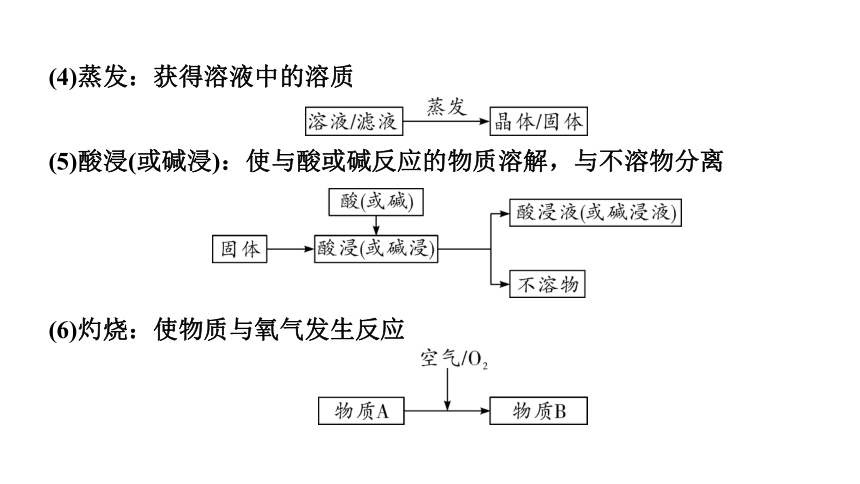
(4)蒸发:获得溶液中的溶质
(5)酸浸(或碱浸):使与酸或碱反应的物质溶解,与不溶物分离
(6)灼烧:使物质与氧气发生反应
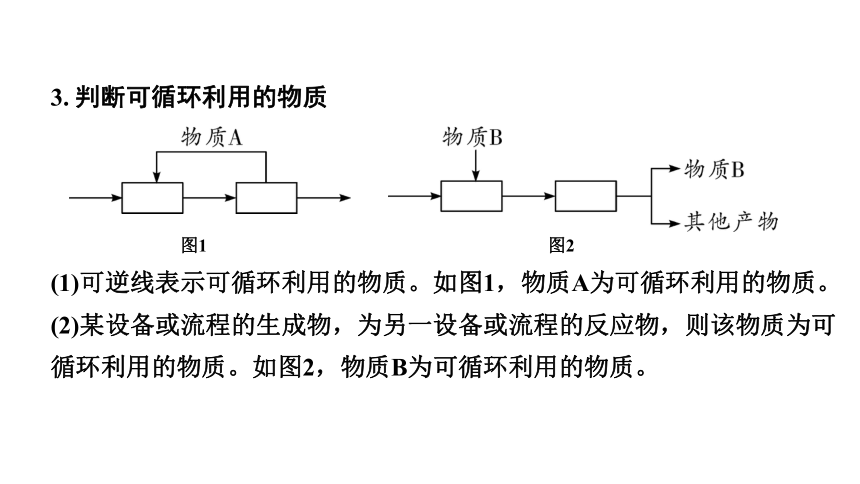
3. 判断可循环利用的物质
图1 图2
(1)可逆线表示可循环利用的物质。如图1,物质A为可循环利用的物质。
(2)某设备或流程的生成物,为另一设备或流程的反应物,则该物质为可循环利用的物质。如图2,物质B为可循环利用的物质。
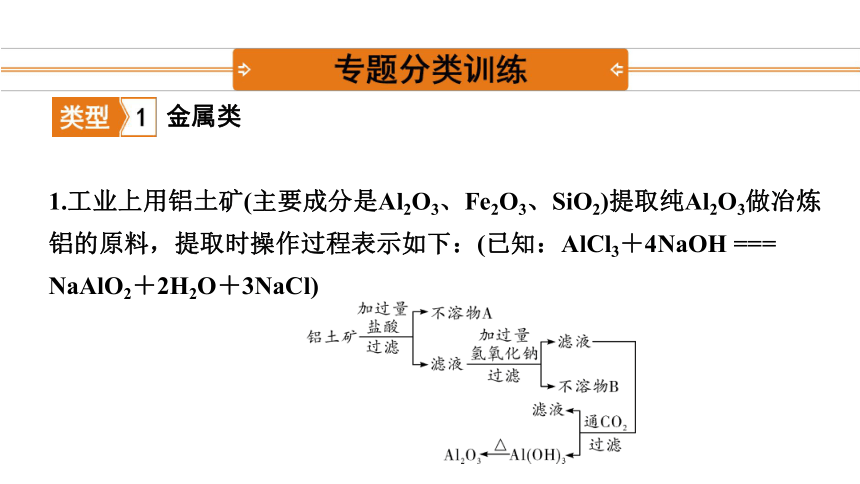
1.工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提取纯Al2O3做冶炼铝的原料,提取时操作过程表示如下:(已知:AlCl3+4NaOH === NaAlO2+2H2O+3NaCl)
金属类
(1)过滤操作中用到的玻璃仪器有哪些?
(2)请分析以上框图中不溶物A和不溶物B的成分。
(3)请写出以上框图中通入CO2所发生反应的化学方程式。
答:漏斗、烧杯、玻璃棒。
答:不溶物A为SiO2,不溶物B为Fe(OH)3。
答:2NaAlO2+CO2+3H2O === 2Al(OH)3↓+Na2CO3、2NaOH+CO2 === Na2CO3+H2O
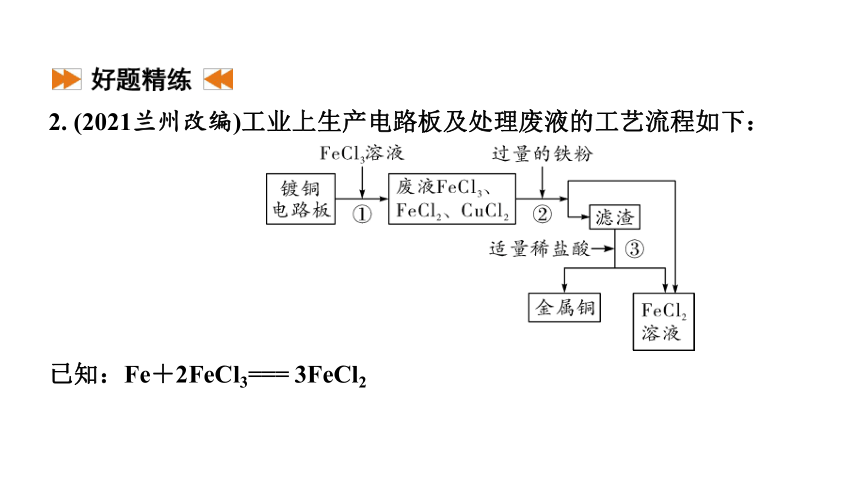
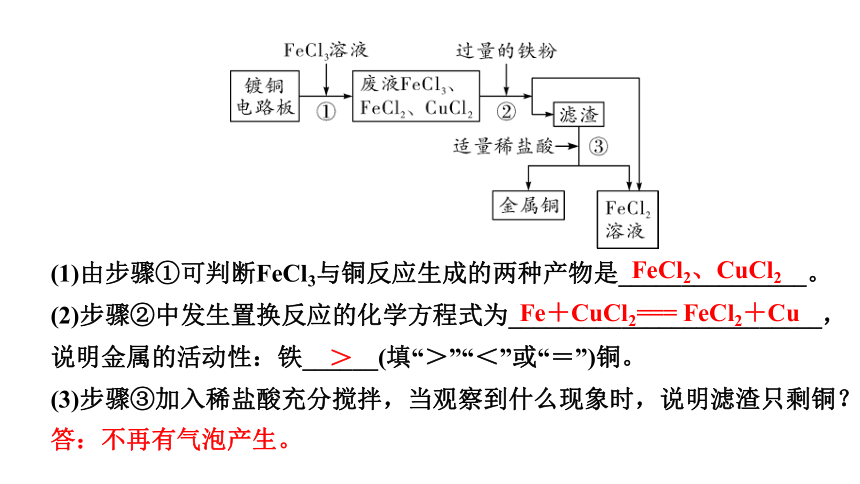
2. (2021兰州改编)工业上生产电路板及处理废液的工艺流程如下:
已知:Fe+2FeCl3=== 3FeCl2
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是_______________。
(2)步骤②中发生置换反应的化学方程式为_________________________,说明金属的活动性:铁______(填“>”“<”或“=”)铜。
(3)步骤③加入稀盐酸充分搅拌,当观察到什么现象时,说明滤渣只剩铜?
FeCl2、CuCl2
Fe+CuCl2=== FeCl2+Cu
>
答:不再有气泡产生。
3. (2021柳州改编)为了充分利用资源、保护环境,柳州市大力推行垃圾分类投放。某校化学课外小组进行垃圾分类活动时,在垃圾处理厂发现一些铜锌合金材料(主要含Cu、 Zn), 查阅资料后,同学们设计利用此铜锌合金回收铜并制取ZnSO4的工艺流程如下图: (反应条件已略去)
(1)金属活动性Zn_____(填“>”或“<”)Cu。加入稀硫酸之前需将合金粉碎,请简述其目的。
(2)请写出步骤①溶解过程中Cu发生反应的化学方程式。
>
答:增大接触面积(或提高反应速率,使反应更充分)。
答:Cu+H2O2+H2SO4 === CuSO4+2H2O
(3)“溶解池”中也可在酸性条件下通入过量氧气代替H2O2,与加入过量H2O2相比的优点是什么?
答:反应后不用除杂质。
(4)步骤②中加入NaOH溶液的量不能太多,请简述其原因。
答:产物硫酸锌中会混入较多的硫酸钠杂质(或加入氢氧化钠溶液过多,会使铜离子和锌离子生成沉淀,无法制得铜和硫酸锌)。
4. (2021雅安改编)氧化镁在医药、建筑等行业应用广泛。以菱镁矿(主要成分为MgCO3,含少量FeCO3和不溶性杂质)为原料制备高纯度氧化镁的工艺流程示意图如下:
(1)FeCO3的名称是__________。
(2)为了加快“酸溶”,可采取的措施有______________________________
___________(回答两条即可)。
(3)滤液Ⅰ里,存在的阳离子有__________________(填离子符号)。
碳酸亚铁
加热、搅拌(或粉碎矿石、增大硫
酸浓度等)
H+、Fe2+、Mg2+
(4)写出MgSO4固体与木炭反应的化学方程式。
(5)加入氨水调节溶液的 pH,可将杂质离子沉淀除去,写出该反应的化学方程式。
2MgSO4+C 2MgO+2SO2↑+CO2↑
Fe2(SO4)3+6NH3·H2O === 2Fe(OH)3↓+3(NH4)2SO4
5. (2021江西改编)江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。下图是一种生产钨的工业流程:
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨。
(1)操作1中粉碎白钨矿的目的是___________________________________
______________。
(2)操作2所得滤液中一定含有的阳离子是______________、____________。
(3)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原
因是什么?
增大反应物接触面积,加快反应速率,
使反应更充分
Ca2+(或钙离子)
H+(或氢离子)
答:不易获得高纯度的金属钨(或会引入碳杂质、会生成杂质碳化钨等)。
6. (2021检测改编)从氯碱工业产生的盐泥中回收BaSO4。其主要工艺流程如下图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。
酸碱盐类
(1)除去NaCl,利用的性质是_______________。
(2)请写出酸溶槽中发生中和反应的化学方程式。
(3)请写出过滤器中分离出固体的成分。
NaCl易溶于水
Mg(OH)2 +2HCl === MgCl2 + 2H2O
BaSO4
7.(2021岳阳改编)84消毒液(主要成分是NaClO)是一种常用的环境消毒剂, 某同学用粗盐(含CaCl2、MgCl2、Na2SO4、 泥沙等杂质)制84 消毒液的流程如下:
(1)操作①的名称是______。
(2)溶液E中加入适量稀盐酸的目的是什么?
过滤
答:除去过量的NaOH溶液和Na2CO3溶液。
(3)写出NaCl溶液通电时生成Cl2 (黄绿色气体)、H2和NaOH的化学方程式。
(4) NaClO溶液能与空气中的CO2反应而变质,所以84消毒液应______
储存。
密封
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
8.(2021广东改编)牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图所示。
(1)反应②的化学方程式为___________________________________,
该反应属于________(填基本反应类型)反应。
Na2CO3+CaCl2=== CaCO3↓+2NaCl
复分解
(2)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由。
(3)大气中CO2含量不断上升,会导致______________。我国在联合国大会上提出:努力争取2060年前实现碳中和。请提出一条实现碳中和的
措施。
答:有影响;生成的CaSO4微溶于水,溶液B中溶质的浓度较低,最终使制得的碳酸钙产率较低。
温室效应加剧
答:开发新能源。
9. 某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、KCl和KOH中的一种或几种。为探究其组成,进行如下实验,流程和现象记录如下:
【资料】CaCl2、BaCl2、KCl三种溶液均呈中性。
(1)依据步骤①的实验现象得出固体物质中一定不含________(填化学式)。
(2)写出步骤②中发生反应的化学方程式。
CuSO4
BaCl2+Na2CO3=== BaCO3↓+2NaCl
(3)根据上述实验得出固体物质中一
定含有_______________(填化学式,
下同),可能含有_______。
(4)为进一步确定可能含有的物质,
简述其方法(简要写出实验步骤、现
象和结论)。
Na2CO3、KOH
KCl
答:取少量无色溶液A于试管中,加入过量的稀硝酸,然后滴加硝酸银溶液,若产生白色沉淀,则固体中一定含有KCl,否则不含KCl。
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(一)
专题精讲
1
专题分类训练
2
1. 关注流程中的“箭头”
箭头进入表示投料(即反应物),箭头出去表示生成物(包括主产物和副产物)。如图所示,表示投料(反应物)的箭头为①②,表示生成物的箭头为③。
2. 关注流程中具体操作及其目的
(1)粉碎或研磨:目的是增大反应物间的接触面积,使反应更充分,加快反应(或加快溶解)的速率。
(2)溶解:通过加水,使可溶物溶解
(3)过滤:分离固体和液体的混合物
(4)蒸发:获得溶液中的溶质
(5)酸浸(或碱浸):使与酸或碱反应的物质溶解,与不溶物分离
(6)灼烧:使物质与氧气发生反应
3. 判断可循环利用的物质
图1 图2
(1)可逆线表示可循环利用的物质。如图1,物质A为可循环利用的物质。
(2)某设备或流程的生成物,为另一设备或流程的反应物,则该物质为可循环利用的物质。如图2,物质B为可循环利用的物质。
1.工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提取纯Al2O3做冶炼铝的原料,提取时操作过程表示如下:(已知:AlCl3+4NaOH === NaAlO2+2H2O+3NaCl)
金属类
(1)过滤操作中用到的玻璃仪器有哪些?
(2)请分析以上框图中不溶物A和不溶物B的成分。
(3)请写出以上框图中通入CO2所发生反应的化学方程式。
答:漏斗、烧杯、玻璃棒。
答:不溶物A为SiO2,不溶物B为Fe(OH)3。
答:2NaAlO2+CO2+3H2O === 2Al(OH)3↓+Na2CO3、2NaOH+CO2 === Na2CO3+H2O
2. (2021兰州改编)工业上生产电路板及处理废液的工艺流程如下:
已知:Fe+2FeCl3=== 3FeCl2
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是_______________。
(2)步骤②中发生置换反应的化学方程式为_________________________,说明金属的活动性:铁______(填“>”“<”或“=”)铜。
(3)步骤③加入稀盐酸充分搅拌,当观察到什么现象时,说明滤渣只剩铜?
FeCl2、CuCl2
Fe+CuCl2=== FeCl2+Cu
>
答:不再有气泡产生。
3. (2021柳州改编)为了充分利用资源、保护环境,柳州市大力推行垃圾分类投放。某校化学课外小组进行垃圾分类活动时,在垃圾处理厂发现一些铜锌合金材料(主要含Cu、 Zn), 查阅资料后,同学们设计利用此铜锌合金回收铜并制取ZnSO4的工艺流程如下图: (反应条件已略去)
(1)金属活动性Zn_____(填“>”或“<”)Cu。加入稀硫酸之前需将合金粉碎,请简述其目的。
(2)请写出步骤①溶解过程中Cu发生反应的化学方程式。
>
答:增大接触面积(或提高反应速率,使反应更充分)。
答:Cu+H2O2+H2SO4 === CuSO4+2H2O
(3)“溶解池”中也可在酸性条件下通入过量氧气代替H2O2,与加入过量H2O2相比的优点是什么?
答:反应后不用除杂质。
(4)步骤②中加入NaOH溶液的量不能太多,请简述其原因。
答:产物硫酸锌中会混入较多的硫酸钠杂质(或加入氢氧化钠溶液过多,会使铜离子和锌离子生成沉淀,无法制得铜和硫酸锌)。
4. (2021雅安改编)氧化镁在医药、建筑等行业应用广泛。以菱镁矿(主要成分为MgCO3,含少量FeCO3和不溶性杂质)为原料制备高纯度氧化镁的工艺流程示意图如下:
(1)FeCO3的名称是__________。
(2)为了加快“酸溶”,可采取的措施有______________________________
___________(回答两条即可)。
(3)滤液Ⅰ里,存在的阳离子有__________________(填离子符号)。
碳酸亚铁
加热、搅拌(或粉碎矿石、增大硫
酸浓度等)
H+、Fe2+、Mg2+
(4)写出MgSO4固体与木炭反应的化学方程式。
(5)加入氨水调节溶液的 pH,可将杂质离子沉淀除去,写出该反应的化学方程式。
2MgSO4+C 2MgO+2SO2↑+CO2↑
Fe2(SO4)3+6NH3·H2O === 2Fe(OH)3↓+3(NH4)2SO4
5. (2021江西改编)江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。下图是一种生产钨的工业流程:
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;碳在高温条件下会与金属钨反应生成碳化钨。
(1)操作1中粉碎白钨矿的目的是___________________________________
______________。
(2)操作2所得滤液中一定含有的阳离子是______________、____________。
(3)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原
因是什么?
增大反应物接触面积,加快反应速率,
使反应更充分
Ca2+(或钙离子)
H+(或氢离子)
答:不易获得高纯度的金属钨(或会引入碳杂质、会生成杂质碳化钨等)。
6. (2021检测改编)从氯碱工业产生的盐泥中回收BaSO4。其主要工艺流程如下图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。
酸碱盐类
(1)除去NaCl,利用的性质是_______________。
(2)请写出酸溶槽中发生中和反应的化学方程式。
(3)请写出过滤器中分离出固体的成分。
NaCl易溶于水
Mg(OH)2 +2HCl === MgCl2 + 2H2O
BaSO4
7.(2021岳阳改编)84消毒液(主要成分是NaClO)是一种常用的环境消毒剂, 某同学用粗盐(含CaCl2、MgCl2、Na2SO4、 泥沙等杂质)制84 消毒液的流程如下:
(1)操作①的名称是______。
(2)溶液E中加入适量稀盐酸的目的是什么?
过滤
答:除去过量的NaOH溶液和Na2CO3溶液。
(3)写出NaCl溶液通电时生成Cl2 (黄绿色气体)、H2和NaOH的化学方程式。
(4) NaClO溶液能与空气中的CO2反应而变质,所以84消毒液应______
储存。
密封
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
8.(2021广东改编)牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图所示。
(1)反应②的化学方程式为___________________________________,
该反应属于________(填基本反应类型)反应。
Na2CO3+CaCl2=== CaCO3↓+2NaCl
复分解
(2)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由。
(3)大气中CO2含量不断上升,会导致______________。我国在联合国大会上提出:努力争取2060年前实现碳中和。请提出一条实现碳中和的
措施。
答:有影响;生成的CaSO4微溶于水,溶液B中溶质的浓度较低,最终使制得的碳酸钙产率较低。
温室效应加剧
答:开发新能源。
9. 某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、KCl和KOH中的一种或几种。为探究其组成,进行如下实验,流程和现象记录如下:
【资料】CaCl2、BaCl2、KCl三种溶液均呈中性。
(1)依据步骤①的实验现象得出固体物质中一定不含________(填化学式)。
(2)写出步骤②中发生反应的化学方程式。
CuSO4
BaCl2+Na2CO3=== BaCO3↓+2NaCl
(3)根据上述实验得出固体物质中一
定含有_______________(填化学式,
下同),可能含有_______。
(4)为进一步确定可能含有的物质,
简述其方法(简要写出实验步骤、现
象和结论)。
Na2CO3、KOH
KCl
答:取少量无色溶液A于试管中,加入过量的稀硝酸,然后滴加硝酸银溶液,若产生白色沉淀,则固体中一定含有KCl,否则不含KCl。
同课章节目录
